Вторичная гиперурикемия – Гиперурикемия: что это такое, причины, симптомы, последствия, медикаментозное лечение, народные методы
Гиперурикемия: симптомы и лечение болезни
Гиперурикемия – состояние организма человека с повышенным (по отношению к норме) содержанием мочевой кислоты. Это говорит о болезненном состоянии организма и требует определенной терапии. В чем причина патологии? Как лечить и какую профилактику проводить? Об этом наша статья.
СодержаниеСвернуть
Гиперурикемия: этимология болезни
Гиперурикемия – недуг, причиной появления которого могут быть как внешние воздействия (питание, экология, образ жизни и т. д.), так и наследственные факторы. Также болезнь считается биохимическим показателем подагры. Названное нездоровое состояние служит признаком и других серьезных патологических изменений организма: лейкоза или лимфомы, анемии, хронической экземы, туберкулеза, сахарного диабета.

Гиперурикемия считается биохимическим показателем подагры
Виды болезни
Согласно медицинским исследованиям, классифицируют разные виды гиперурикемии:
- первичного типа;
- вторичной формы проявления.
Первичная гиперурикемия
Первичная гиперурикемия – это патология обмена пуринов (наследственная), обусловленная определенными генами. В данном случае в организме есть специфические энзимные генетические дефекты. С названным нарушением объединяют и сбои в работе ферментных систем почек. Подобные врожденные патологии могут никак не проявляться (встречается у 7-15 % взрослого населения и болезнью не считается).
Появлению симптоматики, характерной для гиперурикемии, способствуют экзогенные факторы:
- продолжительное переедание;
- злоупотребление алкоголем;
- частые запоры;
- чрезмерное употребление продуктов, в составе которых есть много пуриновых соединений.
Чаще всего формами первичной гиперурикемии выступают синдром Леша-Нихена, недостаточность глюкозо-6-фосфатазы, подагра.

Повышенный уровень уратов свойствен для вторичной гиперурикемии
Вторичная гиперурикемия
Для вторичной гиперурикемии свойствен повышенный уровень уратов, содержащихся в плазме крови.Такое состояние возникает при выраженном обмене нуклеиновых кислот, быстром росте злокачественных новообразований в процессе их лечения. Радиотерапия или применение цитотоксических лекарственных средств способствуют высвобождению нуклеиновых кислот и, как следствие, их последующему распаду, в результате чего развивается острая почечная недостаточность.
Например, процесс голодания тоже способствует повышению количества образующихся уратов. В этом случае развивается ацидоз. В условии полного отказа от пищи концентрация уратов достигает уровня 0,9 ммоль/л и больше. Гиперурикемия характерна при псориазе, при недостаточности почечных клубочков, в процессе лечения диуретиками.
Причины возникновения и факторы риска
Как было оговорено выше, человек может сам спровоцировать появление гиперурикемии путем ведения образа жизни, негативно влияющего на состояние организма: алкоголизм, курение, переедание, малая активность.
Симптоматика заболевания
Недуг часто не проявляется ярко выраженными симптомами, и поэтому сложно определить наличие в организме патологии. Достоверно выявить риск возникновения гиперурикемии можно по результатам анализа крови.

Нестабильность артериального давления может быть одним из симптомов заболевания
Среди остальных симптомов сложно выделить специфические:
- Частые боли и запоры.
- Ожирение, избыточная потливость.
- Дисбаланс в работе желчевыводящих путей.
- Неприятные ощущения при мочеиспускании.
- Нестабильность артериального давления.
- Ноющие боли в области поясницы.
Наличие перечисленных факторов не говорит об обязательном присутствии гиперурикемии, и характеризует другие патологии в организме.
Опасность заболевания и возможные последствия
Мочевая кислота (в умеренном количестве) берет участие во многих биохимических процессах организма. Избыток же имеет серьезные последствия: соли, которые входят в ее состав, превращаются в мелкие кристаллики, что дает толчок развитию такому сопутствующему заболеванию, как гиперурикозурия. Это генетическое заболевание, характеризующееся накоплением солей мочевой кислоты и образованием камней. Данное состояние развивается у людей разного возраста.
Кристаллы соли, оседающие в суставах, вызывают не только гиперурикемию, но и подагру. Если же накапливаются в почечных канальцах, то в мочевыделительной системе образуются камни. Когда они откладываются в сосудах, интенсивно запускаются процессы формирования атеросклеротических бляшек. Это приводит к заболеваниям сердечно-сосудистой системы, в том числе – и к гипертонии.

У людей разного возраста развивается заболевание
Методы диагностики
Определяют в организме подобного рода патологию по результатам анализа крови. В лаборатории выявляют наличие, уровень и количество вредной кислоты. Проводят исследование почек для оценки их функций (креатинина, мочевины), исследуют работу желудочно-кишечного тракта (билирубин, амилаз, АСТ, АЛТ, щелочная фосфатаза). Если возникло подозрение на развитие подагры, то пациенту делают рентгенографический снимок пораженных суставов.
Чтобы результаты анализов показали точные результаты, накануне их сдачи необходимо придерживаться таких правил:
- полностью исключить прием пищи за 8-9 часов до сдачи анализа;
- отказаться от употребления алкоголя и от богатых на содержание белка продуктов за 5-6 дней.
Результаты исследований обычно готовы в течение суток.
Как лечить гиперурикемию?
Чтобы провести успешное лечение заболевания, к решению проблемы нужно подходить комплексно. Необходимо вывести мочевую кислоту из крови и других пораженных тканей организма. Терапию проводят и традиционными методами, и приемами народной медицины. Если выявлены симптомы и поставлен диагноз гиперурикемия, медикаментозное лечение должно быть подобрано только специалистом.

Перечень препаратов включают традиционные способы лечения
Традиционное лечение
Традиционные способы лечения включают перечень препаратов, выводящих кислоту из организма. Самостоятельно покупать и назначать их категорически запрещено, так как можно спровоцировать необратимые для организма последствия. Врачом назначается прием препаратов на основе пробенецида, благодаря которому снижается уровень вредной мочевой кислоты в организме пациента. Также часто медикаментозная терапия включает ингибитор ксантиноксидазы и аллопуринол.
Народная медицина
Народное лечение считается более безопасным, оказывает щадящее действие на организм и практически не вызывает побочных эффектов.
Среди самых эффективных народных рецептов выделяют:
- Отвар на основе каштана. Для приготовления понадобятся цветки, плоды и даже кора растения. Указанные ингредиенты берутся примерно в равных количествах, измельчаются и смешиваются. Затем 1 столовую ложку смеси заливают стаканом воды, кипятят около 25 минут в закрытой емкости на медленном огне, потом остужают и процеживают. Принимать отвар необходимо натощак по утрам.
- Картофельный сок – эффективное средство для растворения и выведения вредных уратов из организма. Принимать необходимо по половине или четверти стакана три раза на день на протяжении 10 дней. После недельного перерыва продолжают лечение.
- Отвар из листьев и почек березы. 2 столовые ложки указанных ингредиентов заливают двумя стаканами воды (100 С°), затем 15-20 минут кипятят на медленном огне, настаивают (минимум полчаса), процеживают и принимают по полстакана три раза в день.

Эффективное средство при лечении гиперурикемии-сок из листьев крапивы
- Сок из листьев крапивы, который отжимают перед самим употреблением, – эффективное средство при лечении гиперурикемии. Для этого необходимо листья измельчить и отжать сок через марлю. Затем принимать по 1 ч. л. три раза на день.
- Действенным является и состав из чеснока и лимона. Для смеси понадобятся 3-4 лимона (с кожурой), 2-3 головки чеснока и полтора литра кипятка. Все перемешивают, настаивают 24 ч, процеживают. Рекомендованная доза: четверть стакана настойки раз в сутки.
Народная медицина – надежный и доступный способ лечения. Но недостаток такой терапии – в медленном процессе выздоровления.
Рекомендуемая диета при гиперурикемии
Борьба с этим заболеванием начинается с диеты и режима питания. Из ежедневного рациона полностью исключают пуриносодержащие продукты. Рассмотрим подробнее, каких правил следует придерживаться больным гиперурикемией во время диеты.
Ограничения белковой пищи
Не рекомендуется вводить в пищу мясо индейки, курицы, кролика, молочнокислые продукты. Даже блюда на рыбных бульонах не очень полезны.
Оптимально придерживаться вегетарианской системы питания, отдавая предпочтение свежим овощам, фруктам, кашам и зелени. Приемлемым считается употребление нежирных, диетических сортов мяса и рыбы (не чаще трех раз в неделю).
Для лечебной терапии важно наличие продуктов, содержащих калий:
- баклажанов;
- тыквы;
- белокочанной капусты;
- огурцов;
- перцев болгарских.
Употребляют свежими или готовят блюда из фруктов:
- винограда;
- яблок;
- ягод;
- абрикосов;
- дынь.
Питьевая диета
При гиперурикемии пьют много воды (2 л и больше в сутки). Употребление супов, бульонов и каш из артишоков также способствует выведению из организма вредных уратов.
Полезно раз в неделю проводить разгрузочные дни:
- утром натощак делают клизму с добавлением отвара ромашки или календулы;
- на протяжении дня пьют воду, зеленый или травяные чаи, обязательно без сахара и меда;
- вечером делают клизму еще раз;
- следующие два дня употребляют приготовленные на пару овощи или каши без молока и избегают «тяжелой» пищи.
Минимум животных жиров
Животные жиры: сало, колбасы, сливочное масло и другие продукты имеют негативное воздействие на печень, поэтому должны быть исключены из рациона.
Запрет алкоголя
Как известно, спирт является одним из наиболее губительных веществ, разрушающих структуру печени, ухудшающих работу этого органа. По этой причине все напитки, содержащие алкоголь, категорически запрещены.
Особенности приготовления пищи
Все блюда должны вариться или тушиться. Лучше употреблять свежие овощи, фрукты, зелень. Жареное и даже печеное меню противопоказаны.
Пища – источник энергии и важных микроэлементов, чтобы быть здоровым, важно следить за тем, что составляет ежедневных рацион и откорректировать питание согласно рекомендованной диете.
Профилактика гиперурикемии
Чтобы не пришлось бороться с проблемой гиперурикемии, лучше предпринять профилактические меры. Для этого обогащают свой рацион кисломолочными продуктами: нежирным кефиром, творогом. Полезно также употреблять диетическое нежирное мясо и рыбу (в отварном виде и не более 3-4 раз в неделю), яйца, овощи, фрукты, пшеничные отруби. Регулирует полезное содержание мочевой кислоты в организме отвар из шиповника.
Гиперурикемия – заболевание достаточно распространенное, но поддающееся лечению. Главным условием на пути к выздоровлению и профилактике является правильное питание и здоровый образ жизни.
симптомы, диета, лечение и причины
Если у человека выявляется повышение уровня мочевой кислоты в крови, говорят о развитии гиперурикемии. Причины гиперурикемии различны и касаются как серьезных нарушений в обменных процессах, так и рациона человека. По статистике, патологию диагностируют у каждого 5-го взрослого человека в мире, у детей болезнь встречается редко. Это заболевание является одной из причин развития подагры, и провоцирует серьезные поражения почек.
Гиперурикемия – это следствие сбоя в обменных процессах, которое проявляется повышенным уровнем кислоты в урине.Что это такое?
Верхняя граница нормы мочевой кислоты в крови составляет 360 мкм/л у женщин, и 400 мкм/л ― у мужчин. Увеличение этого показателя на 5% говорит о формировании гиперурикемии.
Гиперурикемия ― увеличение количества мочевой кислоты в крови под воздействием ряда факторов. Вследствие расщепления пуриновых веществ в печени формируется мочевая кислота. Образовавшаяся кислота покидает организм через мочевыделительную систему, потому оказывает непосредственное влияние на почки. Рост концентрации кислоты в крови говорит о развитии патологий, приводящих к гиперурикемии, например, сахарного диабета, заболеваний печени или почек, анемии и т. д.
Патология приводит к развитию подагры и поражению почечной паренхимы. Если есть нарушения, почки повышают степень выделения уратов, что приводит к кристаллизации солей в парном органе. При повреждении структур почек солями развивается гиперурикозурия. Гиперурикозурия возникает из-за большого объема в крови пуриновых веществ, поступающих в организм с продуктами питания. Поэтому диета при гиперурикемии считается неотъемлемой частью лечения патологии.
Врачи разделяют гиперурикемию на врождённую и приобретённую в течении жизни.Вернуться к оглавлениюКлассификация
Чтобы подобрать эффективное лечение болезни, важно выявить ее вид. Выделяют следующую классификацию патологии:
| Вид болезни | Особенности |
| Метаболический | Высокое содержание мочевой кислоты в крови и моче |
| Почечный | Ухудшение выведения кислоты |
| Смешанный | Присутствие признаков двух первых видов параллельно с уратурией |
| Врожденный | Выявляется у младенца, встречается редко |
| Вторичный (приобретенный) | Развивается под воздействием ряда факторов, наблюдается наиболее часто |
Каковы причины возникновения патологии?
К основным причинам нарушения относится:
Гиперурикемия развивается из-за нездорового питания, диабета, онкологии, болезни крови, соблюдении истощающих диет.- злоупотребление жирными, жареными блюдами, фастфудом;
- неконтролируемое голодание, соблюдение жестких диет, в результате чего организм потребляет питательные вещества из собственных мышц;
- раковые опухоли;
- наличие заболевание, негативно отражающихся на состоянии почек;
- употребление алкоголя;
- применение лекарств без предварительной консультации с врачом;
- сахарный диабет, атеросклероз, гипертония;
- болезни крови.
Факторы риска
Бессимптомная гиперурикемия не позволяет своевременно выявить проблему и предупредить осложнения. Потому важно устранить факторы риска развития патологии, к которым относятся:
- наличие пурина в обмене веществ;
- снижение функциональности почек;
- употребление в пищу большого количества фруктозы;
- избыточный вес;
- злоупотребление алкоголем;
- бесконтрольный прием мочегонных средств.
Вернуться к оглавлениюГиперурикемию эффективно лечит диетотерапия.
Каковы симптомы гиперурикемии?
Гиперурикемия вызывает учащение диуреза, боли, нервозность, свето- и звукобоязнь.У детей патология проявляется следующими симптомами:
- болевые ощущения в мышцах и суставах;
- нервный тик;
- частое мочеиспускание по ночам;
- состояние интоксикации;
- болезненное восприятие света и звука.
У взрослых патология развивается зачастую без симптомов, иногда возможны болевые ощущения в области поясницы. Поэтому ее выявляют на более поздних стадиях, когда в почках образовались камни или развился пиелонефрит. Мочекаменную болезнь при этом провоцируют гиперурикурия и гиперурикемия ― специфическое нарушение обмена веществ. На фоне этого нередко развиваются патологии в работе ЖКТ.
Вернуться к оглавлениюКак выявить патологию?
Основным методом диагностики гиперурикемии является биохимия крови. Кроме этого, проводится:
- клинический анализ мочи;
- выявление мочевой кислоты в кровяной сыворотке;
- рентген почек и суставов, если подозревается подагра;
- УЗИ почек и мочеточников.
Обследование требует определенной подготовки. За 4 дня до сдачи анализов рекомендуется сократить потребление белков, отказаться от алкоголя. Анализы сдают натощак, последний прием пищи должен был минимум за 8 часов до сбора анализов. На основе полученных результатов подбирается индивидуальное лечение в зависимости от причины патологии и степени ее развития.
Вернуться к оглавлениюЛечение патологии
Лечить заболевание нужно комплексно, при этом правильное питание при гиперурикемии играет главную роль. Недостаточно устранить симптомы нарушения или бороться только с осложнениями. Важно устранить факторы, способствующие развитию заболевания. Общими рекомендациями при лечении гиперурикемии является контроль над массой тела, изменение рациона, борьба с вредными привычками, особенно с употреблением алкоголя.
Вернуться к оглавлениюЛекарственные препараты
Для снижения уровня опасного вещества в организме назначают специальные лекарственные препараты, например, «Мулирут» («Аллопуринол»). Благодаря блокированию препаратом фермента ксантиноксидазы предотвращается формирование мочевой кислоты. Медикаментозное лечение гиперурикемии подразумевает применение:
- нестероидных противовоспалительных средств;
- урикозурических препаратов;
- цитратных комплексов, растворяющих соли.
Необходимая диета
Диета при гиперурикемии – обязательный пункт для выздоровления.Медикаментозная терапия дополняется диетой. Подразумевается отказ от продуктов с высоким содержанием пуриновых веществ. Следует отказаться от употребления жареных и тушеных блюд, наваристых бульонов, копченостей, субпродуктов, консервов. Ограничивается употребление в пищу бобовых, сыра, шоколада. Разрешаются вегетарианские блюда, нежирное мясо птицы или кролика, молочные продукты, овощи.
Судя по тому, что вы сейчас читаете эти строки – победа в борьбе с почечными заболеваниями пока не на вашей стороне…
И вы уже думали о хирургическом вмешательстве? Оно и понятно, ведь почки – очень важный орган, а их правильное функционирование- залог здоровья и хорошего самочувствия. Слабость, отечность, потеря аппетита, боли в спине и пояснице… Все эти симптомы знакомы вам не понаслышке.
Но возможно правильнее лечить не следствие, а причину? Рекомендуем прочитать историю Галины Савиной, как она вылечила почки… Читать статью >>
ВАЖНО ЗНАТЬ! Даже ‘запущенные’ почки лечатся дома, без операций и уколов. Просто прочитайте что сделала Галина Савина читать далее…
Бессимптомная гиперурикемия – польза или вред? | Ильина А.Е., Барскова В.Г., Насонов Е.Л.
Согласно рекомендациям EULAR (Европейской антиревматической лиги) гиперурикемией (ГУ) считается повышение мочевой кислоты (МК) сыворотки крови выше 360 мкмоль/л [1,2]. Бессимптомное увеличение уровня МК имеют 5–8% популяции, из них только у 5–20% развивается подагра – системное заболевание, при котором в различных тканях откладываются кристаллы моноурата натрия и у лиц с ГУ развивается воспаление, обусловленное внешнесредовыми и/или генетическими факторами [1,3]. Наиболее распространенными причинами, влияющими на уровень МК, являются ожирение, инсулинорезистентность, метаболический синдром [4–7], артериальная гипертензия [8–14], применение диуретиков и низких доз ацетилсалициловой кислоты [15–21], избыточное употребление алкоголя [22,23], пожилой возраст [24–27], почечная недостаточность [28,29]. Среди них лидирует метаболический синдром и его компоненты. Распространение метаболического синдрома возрастает с каждым годом, что отчасти объясняет увеличение частоты встречаемости ГУ и подагры [30]. Так, за период с 1950 по 1980 г. в популяции средний уровень МК в сыворотке крови повысился с 5 до 6 мг/дл [31].
В настоящее время все более актуальным становится вопрос: насколько «безвредна» бессимптомная ГУ [32]? По мнению некоторых исследователей, повышение МК может благоприятно влиять на организм. Например, Orowan E. утверждает, что по своей химической структуре МК сходна с триметилированным ксантин кофеином и поэтому способна повышать умственную и физическую работоспособность [33]. Многочисленные исследования в 1960–70–х годах подтверждали, что люди с ГУ отличаются более высоким интеллектом и быстротой реакции [34–36]. Однако в большинстве работ показан сравнительно небольшой биологический эффект, к тому же возможное влияние оказал социо–экономический статус участников. Тем не менее эти исследования являются некоторым подтверждением умеренного нейростимулирующего действия МК.Другим полезным свойством МК считается ее способность действовать в качестве антиоксиданта, блокирующего супероксид, пероксинитрит и катализируемые железом окислительные реакции [37]. Ряд авторов свидетельствуют, что повышенная МК может быть одним из ключевых антиоксидантов плазмы и предотвращать связанный со старением окислительный стресс, тем самым способствуя продлению жизни [37]. Как показали исследования, инфузия МК людям повышает антиоксидантную активность сыворотки и улучшает функцию эндотелия [38]. Способность ГУ уменьшать пероксинитрит–опосредованное образование нитротирозина свидетельствует о нейропротекторных свойствах МК, что особенно важно при рассеянном склерозе, болезни Паркинсона, инсульте и других неврологических заболеваниях. По данным эпидемиологических исследований, лица с ГУ значительно реже страдают рассеянным склерозом, болезнью Паркинсона и Альцгеймера, а инфузия МК может уменьшать неврологические проявления, полученные экспериментальным путем (например, при экспериментальном аллергическом энцефаломиелите) [39]. Недавние исследования показали, что благоприятный эффект МК при этих состояниях связан, скорее, не с ее нитротирозин–подавляющим антиоксидантным действием, а со способностью блокировать гемато–энцефалический барьер или с воздействием на астроглиальные клетки [40,41].
Наряду с данными о некотором положительном влиянии МК, большинство работ связывают ГУ с развитием кардиоваскулярных заболеваний (КВЗ) и поражением почек [42]. Так, повышение МК ассоциировано с артериальной гипертензией, повышенной реабсорбцией натрия в проксимальных почечных канальцах, микроальбуминурией, протеинурией, поражением почек, ожирением, гипертриглицеридемией, низким содержанием холестерина липопротеидов высокой плотности, гиперинсулинемией, гиперлептинемией, гипоадипонектинемией, поражением периферических, сонных и коронарных артерий, эндотелиальной дисфункцией, окислительным стрессом, увеличением концентрации ренина, эндотелина и С–реактивного белка. Уровень МК выше у постменопаузальных женщин по сравнению с женщинами в пременопаузе и у городских жителей по сравнению с сельскими [31,43,44].
Связь между ГУ и риском развития КВЗ установлена в ходе крупных эпидемиологических исследований [45–48]. Доказана взаимосвязь ГУ с артериальной гипертензией, сахарным диабетом, инсулинорезистентностью, ожирением и обусловленными атеросклерозом сердечно–сосудистыми заболеваниями [45–49]. Однако остается неясным, является ли ГУ причиной или следствием кардиоваскулярной патологии, отражая наличие других факторов риска, таких как артериальная гипертензия, дислипидемия и диабет [50]. В исследовании NHANES I (the National Health and Nutrition Examination Survey) выявлена независимая связь между ГУ и ростом сердечно–сосудистой летальности. С повышением уровня МК риск смерти от ИБС возрастал на 77% у мужчин и на 300% у женщин. Увеличение концентрации МК на 1 мг/дл (59,5 мкмоль/л) ассоциировалось со значительным увеличением летальности от КВЗ как среди мужчин, так и среди женщин [10]. 12–летнее исследование (PIUMA), в котором участвовало более 1500 ранее не леченных пациентов с АГ, также продемонстрировало, что уровень МК сыворотки – сильный предиктор кардиоваскулярной заболеваемости и смертности [51]. У пациентов с сердечной недостаточностью повышение уровня МК рассматривается как показатель плохого прогноза и свидетельствует о необходимости трансплантации сердца [52]. Изучение больных сахарным диабетом 2 типа показало значительное повышение частоты инсульта при росте уровня МК. При этом связь оставалась значимой даже после исключения других кардиоваскулярных факторов риска [53]. Между тем результаты Фрамингемского исследования не выявили значительной связи между уровнем МК и кардиоваскулярной заболеваемостью [50]. Изучалась ассоциация уровня МК с поражением органов–мишеней у пациентов с АГ. Полученные результаты также неоднозначны. В ряде исследований получена взаимосвязь ГУ с массой миокарда левого желудочка и другими маркерами органного поражения [54–57]. Другие авторы не выявили значимой ассоциации МК с массой ЛЖ, поражением сонных артерий или микроальбуминурией [58]. В отличие от популяционных данных, результаты которых в отношении независимого значения МК, как фактора риска, противоречивы; в группах больных, собранных по нозологическому принципу, установленa значимость ГУ в качестве фактора риска развития КВЗ и связанных с ними осложнений. Это касается больных подагрой, а также пациентов с ревматоидным артритом [59] и системной склеродермией [60]. При этом показано, что не только кристаллы моноурата натрия, но и растворимая мочевая кислота при бессимптомной ГУ может приводить к увеличению уровня воспалительных медиаторов и индуцировать пролиферацию сосудистых гладкомышечных клеток in vitro [43,61–65]. Многие из этих «провоспалительных» медиаторов имеют фундаментальное значение в патогенезе атеросклеротического поражения сосудов и его осложнений [64,65].
В настоящее время предложено несколько механизмов, с помощью которых МК может участвовать в развитии КВЗ. Так, Johnson R.J. и соавт. в серии экспериментов на животных показали, что умеренное повышение МК может вызывать едва заметные гломерулотубулярные повреждения, способствующие активации ренин–ангиотензиновой системы (РАС) и повышению АД, при этом все изменения претерпевали обратное развитие после устранения ГУ [43, 66]. Sanchez–Lozada L.G. и соавт., изучая афферентные артериолы на крысиных моделях подагры, нашли, что высокие цифры МК могут индуцировать сосудистое повреждение, прекращавшееся при использовании аллопуринола [67]. Также показано, что ГУ вызывает констрикцию почечных сосудов, коррелирует с активностью РАС [67–69], участвует в развитии дисфункции эндотелия [70]. Имеются данные о том, что МК индуцирует пролиферацию сосудистых гладкомышечных клеток in vitro [62], активируя факторы транскрипции и сигнальные молекулы, вызывая гиперэкспрессию циклооксигеназы, тромбоцитарного фактора роста и моноцитарного хемоаттрактантного белка. МК и фермент ксантиноксидаза часто выявляются в атеросклеротических бляшках [71,72]. Свободные радикалы, встречающиеся при ГУ, стимулируют перекисное окисление липидов, ответственное за утолщение комплекса интима–медиа сонных артерий [62,68]. Другие потенциальные механизмы, с помощью которых ГУ и/или повышенная активность ксантиноксидазы могут способствовать сосудистому повреждению, включают адгезию тромбоцитов, пролиферацию гладкомышечных клеток сосудов и стимуляцию воспалительного ответа. Таким образом, ГУ может реализовывать свое патологическое влияние на сосуды различными путями [42].
У крыс не развивается ГУ за счет наличия у них фермента уриказы, превращающего МК в аллантоин. Интересно, что подавление уриказы у крыс приводит к возникновению гипертензии, опосредованной эндотелиальной дисфункцией и активацией ренин–ангиотензиновой системы, со временем переходящей в нефрогенную в связи с развитием у них артериолосклеротического повреждения сосудов [73,74]. С этим согласуются данные других исследований, в которых ГУ предшествовала возникновению АГ [75,76]. ГУ была обнаружена у почти 90% подростков с впервые диагностированной АГ [77]. В пилотных исследованиях уменьшению уровня МК аллопуринолом сопутствовало снижение АД [78].
Результаты исследований свидетельствуют, что коррекция ГУ может предотвращать развитие сердечно–сосудистых катастроф. Исследование LIFE впервые показало, что у больных с АГ и гипертрофией левого желудочка медикаментозное снижение МК может уменьшать кардиоваскулярный риск [79,80].
Таким образом, значение ГУ в развитии КВЗ вызывает много вопросов. Так, если острое повышение МК оказывает антиоксидантное действие и благоприятно влияет на функцию эндотелия, то хроническая ГУ, напротив, способствует развитию окислительного стресса и эндотелиальной дисфункции. Возможно, это связано с различными внутриклеточным и внутрисосудистым влияниями острой и хронической ГУ [81, 82].
Клинические исследования показали, что блокатор ксантиноксидазы аллопуринол может улучшать функцию эндотелия, снижать кардиоваскулярные осложнения у пациентов, перенесших аорто–коронарное шунтирование, и улучшать кардиальную функцию у пациентов с дилатационной кардиомиопатией и застойной сердечной недостаточностью [83–86]. Однако другие уратснижающие агенты не продемонстрировали подобных результатов [87,88]. Нельзя исключить, что эти эффекты обусловлены ингибированием ксантиноксидазы и не связаны со снижением МК или ингибиторы ксантиноксидазы преимущественно влияют на внутриклеточную МК, с которой связывают большинство кардиоренальных эффектов [89]. Если ГУ действительно влияет на клинические исходы, то диетарные и фармакологические вмешательства, направленные на снижение МК, могут стать новым методом профилактики сердечно–сосудистых заболеваний. Будем надеяться, что дальнейшие исследования в скором времени подскажут ответы на эти вопросы.
Литература
1. Ревматология: национальное руководство, 2008.
2. W Zhang, M Doherty, E Pascual, T Bardin, V Barskova, P Conaghan, J Gerster, J Jacobs, B Leeb, F Liote?, G McCarthy, P Netter, G Nuki, F Perez–Ruiz, A Pignone, J Pimenta?o, L Punzi, E Roddy, T Uhlig, I Zimmermann–Go`rska. EULAR evidence based recommendations for gout. Part I: Diagnosis. Report of a task force of the standing committee for international clinical studies including therapeutics (ESCISIT). Ann Rheum Dis 2006; 65:1301–1311.
3. Campion E.W.; Glynn R.J.; DeLabry L.O. Asymptomatic hyperuricemia. Risks and consequences in the Normative Aging Study. Am J Med. 1987; 82(3):421–6.
4. Choi H.K., Atkinson K., Karlson E.W., Curhan G. Obesity, weight change, hypertension, diuretic use, and risk of gout in men: the Health Professionals Follow–up Study // Arch Intern Med.– 2005.– № 165.– р. 742–748.
5. Dessein P.H., Shipton E.A., Stanwix A.E., Joffe B.I., Ramokgadi J. Beneficial effects of weight loss associated with moderate calorie/carbohydrate restriction, and increased proportional intake of protein and unsaturated fat on serum urate and lipoprotein levels in gout: a pilot study // Ann Rheum Dis.– 2000.– № 59.– р. 539–543.
6. Fam A.G. Gout, diet, and the insulin resistance syndrome // J Rheumatol.– 2002.– № 29.– р. 1350–5.
7. Lin K.C., Lin H.Y., Chou P. Community based epidemiological study on hyperuricemia and gout in Kin–Hu, Kinmen // J Rheum.– 2000.– № 27.– р. 1045–50.
8. Alper A.B. Jr, Chen W., Yau L., Srinivasan S.R., Berenson G.S., Hamm L.L. Childhood uric acid predicts adult blood pressure: the Bogalusa Heart Study // Hypertension. – 2005.– №45.– р. 34–38.
9. Grodzicki T., Palmer A., Bulpitt C.J., Incidence of diabetes and gout in hypertensive patients during 8 year of follow–up // J Hum Hypertens.– 1997.– № 11.– р. 583–585.
10. Fang J., Alderman M. Serum uric acid and cardiovascular mortality: The NHANES I epidemiologic follow–up study, 1971–1992. National Health and Nutrition Examination Survey // JAMA.– 2000.– № 238.– р. 2404–10.
11. Johnson R.J., Kang D.H., Feig D., et al. Is there a pathogenetic role for uric acid in hypertension and cardiovascular and renal disease? // Hypertension.– 2003.– № 41.– р. 1183–90.
12. Mazzali M., Hughes J., Kim Y.G., et al. Elevated uric acid increases blood pressure in the rat by a novel crystal–independent mechanism // Hypertension.– 2001.– № 38.– р. 1101–6.
13. Tykarski A. Evaluation of renal handling of uric acid in essential hypertension: hyperuricemia related to decreased urate secretion // Nephron.– 1991.– № 59.– р. 364–368.
14. Breckenridge A. Hypertension and hyperuricaemia // Lancet.– 1966.–№ 1. р. 15–18.
15. Aronoff A. Acute gouty arthritis precipitated by chlorotiazide // N Engl J Med.– 1960.– № 262.– р. 767–769.
16. Campion E.W., Glynn RJ, DeLabry LO. Asymptomatic hyperuricemia. Risks and consequences in the Normative Aging Study // Am J Med.– 1987.–№ 82.– р. 421–426.
17. Grodzicki T., Palmer A., Bulpitt C.J., Incidence of diabetes and gout in hypertensive patients during 8 year of follow–up // J Hum Hypertens.– 1997.– № 11.– р. 583–585.
18. Lane P. Drug–induced gout // Br. Med J.– 1960.– № 2.– р. 1383–4.
19. Laragh J.H., Heinemann H.O. Demartini F.F. Effect of chlorothiazide on electrolyte transport in man; its use in the treatment of edema of congestive heart failure, nephrosis, and cirrhosis // JAMA.– 1958.– № 166.– р. 145–152.
20. Lin K.C., Lin H.Y., Chou P. Community based epidemiological study on hyperuricemia and gout in Kin–Hu, Kinmen // J Rheum.– 2000.– № 27.– р. 1045–50.
21. Oren B.G., Rich M., Belle M.S. Chlorothiazide (Diuril) as a hyperuricacidemic agent // JAMA.– 1958.– № 168.– р. 2128–9.
22. Drum D.E., Goldman P.A., Jankowski C.B. Elevation of serum uric acid as a clue to alcohol abuse // Arch Intern Med.– 1981.– № 141.– р. 477–479.
23. Sharpe C.R. A case–control study of alcohol consumption and drinking behavior on patients with acute gout // Can Med Assoc J.– 1984.– № 131.– р. 563–567.
24. Arromdee E., Michet C.J., Crowson C.S. et al. Epidemiology of Gout: Is the Incidence Rising? //J Rheumatol.– 2002.– № 29.– р. 2403–6.
25. Adams P.F., Hendershot G.E., Marano M.A. Current estimates from the National Health Interview Survey, 1996.– Vital Health Stat 10.– 1999.– 200р.
26. Fam A.G. Gout in the elderly: clinical presentation and treatment // Drug Aging.– 1998.– № 13.– р. 229–243.
27. Troen B.R. The biology of aging // Mt Sinai J Med.– 2003.– № 70.– р. 3–22.
28. US Renal Data System. USRDS 1999 annual data report. Bethesda (MD): National Institute of Health (US), National Institute of diabetes and Digestive and Kidney Diseases.– 1999.
29. Ahn K.J., Kim Y.S., Lee H.C., Park K., Huh K.B. Cyclosporine–induced hyperuricemia after renal transplant: clinical characteristics and mechanisms // Transplant Proc.– 1992.– № 24.– р. 1391–2.
30. Saag K.G., Choi H. Epidemiology, risk factors, and lifestyle modifications for gout. Arthritis Res Ther. 2006; 8 (suppl 1): S2.
31. Johnson RJ, Titte S, Cade JR, Rideout BA, Oliver WJ. Uric acid, evolution and primitive cultures. Semin Nephrol 2005;25:3–8.
32. Neogi T. Asymptomatic Hyperuricemia: Perhaps Not So Benign? The J of Rheumatol. 2008, 5, 734–737.
33. Orowan E. The origin of man. Nature 1955;175:683–4.
34. Bloch S, Brackenridge CJ. Psychological, performance and biochemical factors in medical students under examination stress. J Psychosom Res 1972;16:25–33.
35. Brooks GW, Mueller E. Serum urate concentrations among university professors; relation to drive, achievement, and leadership. JAMA 1966;195:415–8.
36. Stetten D Jr, Hearon JZ. Intellectual level measured by army classification battery and serum uric acid concentration. Science 1959;129:1737.
37. Ames BN, Cathcart R, Schwiers E, Hochstein P. Uric acid provides an antioxidant defense in humans against oxidant– and radical–caused aging and cancer: a hypothesis. Proc Natl Acad Sci USA 1981;78:6858–62.
38. Waring WS, McKnight JA, Webb DJ, Maxwell SR. Uric acid restores endothelial function in patients with type 1 diabetes and regular smokers. Diabetes 2006;55:3127–32.
39. Kutzing MK, Firestein BL. Altered uric acid levels and disease states. J Pharmacol Exp Ther 2008;324:1–7.
40. Du Y, Chen CP, Tseng CY, Eisenberg Y, Firestein BL. Astroglia–mediated effects of uric acid to protect spinal cord neurons from glutamate toxicity. Glia 2007;55:463–72.
41. Spitsin SV, Scott GS, Mikheeva T, et al. Comparison of uric acid and ascorbic acid in protection against EAE. Free Radic Biol Med 2002;33:1363–71.
42. Baker JF, Krishnan E, Chen L, Schumacher HR. Serum uric acid and cardiovascular disease: recent developments, and where do they leave us? Am J Med 2005;118:816–26.
43. Johnson RJ, Kang DH, Feig D, et al. Is there a pathogenetic role for uric acid in hypertension and cardiovascular and renal disease? Hypertension 2003;41:1183–90.
44. Nakanishi N, Okamoto M, Yoshida H, Matsuo Y, Suzuki K, Tatara K. Serum uric acid and risk for development of hypertension and impaired fasting glucose or Type II diabetes in Japanese male office workers. Eur J Epidemiol 2003;18:523–30.
45. Fang J., Alderman M. Serum uric acid and cardiovascular mortality: The NHANES I epidemiologic follow–up study, 1971–1992. National Health and Nutrition Examination Survey // JAMA.– 2000.– № 238.– р. 2404–10.
46. Freedman D.S, Willamson D.F., Gunter E.W., Byers T. Relation of serum uric acid to mortality and ishemic heart disease. The NHANES 1 Epidemiologic Follow–up Study // Am. J. Epidemiol.– 1995.– № 141(7).–р. 637–644.
47. Brand F.N., McGee D.L., Kannel W.B. et al. Hyperuricemia as a risk factor of coronary heart disease: The Framingham Study // Am. J. Epidemiol.– 1985. Vol. 121. P.11.
48. Niskanen L.K., Laaksonen D.E., Nyyssonen K. et al. Uric acid level as a risk factor for cardiovascular and all–cause mortality in middle–aged men: a prospective cohort study // Arch. Intern. Med.–2004.–Vol.164, p. 1546.
49. Барскова В.Г., Ильиных Е.В., Елисеев М.С., Зилов А.В., Насонов Е.Л. Кардиоваскулярный риск у больных подагрой. Ожирение и метаболизм. 2006, 3(8), 40–44.
50. Culleton B.F., Larson M. G., Kannel W.B., D. Levy. Serum Uric Acid and Risk for Cardiovascular Disease and Death: The Framingham Heart Study // Ann. Intern. Med.– 1999.– № 131.– р. 7–13.
51. Verdecchia P., Schillaci G., Reboldi G. et al. Relation between serum uric acid and risk of cardiovascular disease in essential hypertension. The PUIMA study. Hypertension 2000; 36: 1072–8.
52. Anker S.D., Doehner W., Rauchhaus M. et al. Uric acid and survival in chronic heart failure: validation and application in metabolic, functional, and hemodynamic staging. Circulation 2003; 107: 1991–7.
53. Lehto S., Niskanen L., Ronnemaa T. et al. Serum uric acid is a strong predictor of stroke in patients with non–insulin–independent diabetes mellitus. Stroke 1998; 29: 635–9.
54. Alderman M.N., Cohen H., Madhvan S. et al. Serum uric acid and cardiovascular events in successfully treated hypertensive patients. Hypertension. 1999; 34: 144–150.
55. Campo C., Ruilope L.M., Segura J. Et al. Hyperuricemia, low urine urate excretion and target organ damage in arterial hypertension. Blood press. 2003; 12: 277–283.
56. Viazzi F., Parodi D., Leoncini G. Et al. Serum uric acid and target organ damage in primary hypertension. Hypertension. 2005; 45: 991–996.
57. Iribarren C., Folsom A.R., Eckfeldt J.H. et al. Correlates of uric acid and its association with asymptomatic carotid atherosclerosis: the ARIC study. Ann Epidemiol. 1996; 6: 331–340.
58. Cuspidi C., Valerio C., Sala C. Et al. Lack of association between serum uric acid and organ damage in a never–treated essential hypertensive population at low prevalence of hyperuricemia. Am J Hypertens. 2007; 20: 678–685.
59. Panoulas V.F., Milionis H.J., Douglas K.M. et al. Association of serum uric acid with cardiovascular disease in rheumatoid arthritis. Rheumatology (Oxford). – 2007; 46 (9): 1466–1470.
60. Chen C.H., Chen H.A., Wang H.P. et al. Pulmonary arterial hypertension in autoimmune diseases: an analysis of 19 cases from a medical center in northern Taiwan. J Micribiol Immunol Infect.–2006; 39 (2): p. 162–168.
61. Leyva F., Anker S., Godsland I.F. et al. Uric acid in chronic heart failure: a marker of chronic inflammation // Eur. Heart. J. – 1998. Vol.19.– P.1814 –1822.
62. Rao G.N., Corson M.A., Berk B.C. Uric acid stimulates vascular smooth muscle cell proliferation by increasing platelet–derived growth factor A–chain expression // J.Biol.Chem.–1991.–Vol. 266.–P.8604–8608.
63. Schumacher H.R. Jr. Crystal–induced arthritis: an overview // Am J Med.– 1996.– № 100.– р. 46S–52S.
64. Насонов Е.Л. Проблема атеротромбоза в ревматологии. Вестник РАМН, 2003; 7: 6–10.
65. Насонов Е.Л., Насонова В.А., Барскова В.Г. Механизмы развития подагрического воспаления. Тер арх. 2006, 6 (78), 77–84.
66. Johnson R.J., Rodriguez–Iturbe B., Kang D.H. et al. A unifying pathway for essential hypertension. Am J Hypertens. 2005; 18: 431–440.
67. Sanchez–Lozada L.G., Tapia E., Avila–Casado C. Et al. Mild hyperuricemia induces glomerular hypertension in normal rats. Am J Physiol. 2002; 283:F1105–F1110.
68. Mazzali M., Kanellis J., Han L. Et al. Hyperuricemia induces a primary arteriolopathy in rats by a blood pressure–independent mechanism. Am J Physiol. 2002; 282:F 991–F997.
69. Saito I., Saruta T., Kondon K. Et al. Serum uric acid and the renin–angiotensin system in hypertension. J Am Geriatr Soc. 1978; 26: 241–247.
70. Waring W.S., Webb D.J., Maxwell S.R.J. et al. Effect of local hyperucemia on endothelial function in the human forearm vascular bed. Br J Clin Pharmacol. 2000; 49:511.
71. Suarna C., Dean R.T., May J. et al. Human atherosclerotic plaque contains both oxidized lipids and relatively large amounts of alpha–tocopherol and ascorbate. Artherioscler Thromb Vasc Biol. 1995; 15: 1616–1624.
72. Iribarren C., Folsom A.R., Eckfeldt J.H. et al. Correlates of uric acid and its association with asymptomatic carotid atherosclerosis: the ARIC Study: Atherosclerosis Risk in Communities. Stroke. 1999; 29:635–639.
73. Mazzali M, Hughes J, Kim YG, et al. Elevated uric acid increases blood pressure in the rat by a novel crystal–independent mechanism. Hypertension 2001;38:1101–6.
74. Watanabe S, Kang DH, Feng L, et al. Uric acid, hominoid evolution, and the pathogenesis of salt–sensitivity. Hypertension 2002;40:355–60.
75. Masuo K, Kawaguchi H, Mikami H, Ogihara T, Tuck ML. Serum uric acid and plasma norepinephrine concentrations predict subsequent weight gain and blood pressure elevation. Hypertension 2003;42:474–80.
76. Sundstrom J, Sullivan L, D’Agostino RB, Levy D, Kannel WB, Vasan RS. Relations of serum uric acid to longitudinal blood pressure tracking and hypertension incidence. Hypertension 2005;45:28–33.
77. Feig DI, Johnson RJ. Hyperuricemia in childhood primary hypertension. Hypertension 2003;42:247–52.
78. Feig DI, Nakagawa T, Karumanchi SA, et al. Hypothesis: Uric acid, nephron number, and the pathogenesis of essential hypertension. Kidney Int 2004;66:281–7.
79. Dahlof B., Devereux R.B., Kjeldsen S.E. et al. Cardiovascular morbidity and mortality in the Losartan Intervention For Endpoint reduction in hypertension study (LIFE): a randomized trial against atenolol. Lancet 2002; 359: 995–1003.
80. Hoieggen A., Alderman M.H., Kjeldsen S.E. et al. The impact of serum uric acid on cardiovascular outcomes in the LIFE study. Kidney Int. 2004; 65: 1041–1049.
81. Santos CX, Anjos EI, Augusto O. Uric acid oxidation by peroxynitrite: multiple reactions, free radical formation, and amplification of lipid oxidation. Arch Biochem Biophys 1999;372:285–94.
82. Sautin YY, Nakagawa T, Zharikov S, Johnson RJ. Adverse effects of the classical antioxidant uric acid in adipocytes: NADPH oxidase–mediated oxidative/nitrosative stress. Am J Physiol Cell Physiol 2007;293:C584–96.
83. Doehner V., Schoene N., Rauchhaus M. Et al. Effects of xantine oxidase inhibition with allopurinol on endothelial function and peripheral blood flow in hyperuricemic patients with chronic heart failure: results from 2 placebo–controlled studies. Circulation 2002; 105: 2619–2624.
84. Coghlan J.G., Flitter W.D., Clutton S.M. et al. Allopurinol pretreatment improves postoperative recovery and reduces lipid peroxidation in patients undergoing coronary artery bypass grafting. J Thorac Cardiovasc Surg. 1994; 107: 248–256.
85. Weimert N.A., Tanke W.F., Sims JJ. Allopurinol as a cardioprotective during coronary artery bypass graft surgery. Ann Pharmacother 2003; 37: 1708–1711.
86. Cappola T.P., Kass D.A., Nelson G.S. et al. Allopurinol improves myocardial effeciency in patients with idiopathic dilated cardiomyopathy. Circulation 2001; 104: 2407–2411.
87. George J, Carr E, Davies J, Belch JJ, Struthers A. High–dose allopurinol improves endothelial function by profoundly reducing vascular oxidative stress and not by lowering uric acid. Circulation 2006;114:2508–16.
88. Waring WS, McKnight JA, Webb DJ, Maxwell SR. Lowering serum urate does not improve endothelial function in patients with type 2 diabetes. Diabetologia 2007;50:2572–9.
89. Kang DH, Park SK, Lee IK, Johnson RJ. Uric acid–induced C–reactive protein expression: implication on cell proliferation and nitric oxide production of human vascular cells. J Am Soc Nephrol 2005;16:3553–62.
1.1. Первичная гиперурикемия
Причиной первичной гиперурикемии может быть стимуляция синтеза пуринов и угнетение секреции уратов в почках.
Наиболее распространенными формами выступают: синдром Леша-Нихена, недостаточность глюкоозо-6-фосфатазы, подагра.
Синдром Леша-Нихена (ювенильная гиперурикемия)
Врожденное, наследственное заболевание. У маленьких мальчиков развивается тяжелая гиперурикемия.
Гуаннин+фосфорибозилпиросфосфат(ФРПФ)─█─►ГМФ+пирофосфат
Гипоксантин + фосфорибозилпиросфосфат─█─► ИМФ + PPi
В этиопатогенезе заболевания – недостаточность фермента гипоксантингуанин-фосфорибозилтрансферазы (ГГФРТ), катализирующего повторное использование пуриновых оснований для синтеза соответствующих нуклеотидов.
В физиологических условиях гуанин распадается до мочевой кислоты через стадии гипоксантина и ксантина.
В результате ферментного блока происходит накопление гуанина, гипоксантина, ксантина и, как следствие, мочевой кислоты, а также ФРПФ, являющееся ключевым соединением, запускающим образование пуринов.
Согласно представленному пути метаболизма происходит нарастание содержания АМФ и ГМФ и при их катаболизме, образуются ураты:
Р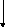 ибозо-5-фосфат
ибозо-5-фосфат
пирофосфорилаза
5 -фосфорибозил-1-
пирофосфат (ФРПФ)
-фосфорибозил-1-
пирофосфат (ФРПФ)
Инозиновая кислота (ИМФ)


гуаниновая кислота (ГМФ) адениловая кислота (АМФ)
Биосинтез пуринов может нарастать также и за счет инактивации фермента, катализирующего образование фосфорибозиламина.
ФРПФ в присутствии глутамина и фермента переходит в фосфорибозиламин, глютамат PP. Фосфорибозиламин является субстратом для образования через ряд стадий ИМФ. Суммируя все выше приведенное, можно представить метаболизм при болезни Леша-Нихена в виде схемы ( схема прилагается)
При данной патологии на ранних стадиях наблюдается; частая рвота, гематурия, жажда, полиурия. В крови – прогрессирующая анемия, устойчивая к терапии витамином В12 и железом. В эритроцитах – высокое содержание ФРПФ. В крови и моче – повышенное количество мочевой кислоты. На поздних стадиях – умственная отсталость, склонность к самоистязанию, агрессивность поведения, спастическая параплегия, атетоз.
Лечение: аллопуринол, ингибитор ксантиноксидазы. Обязателен контроль за состоянием почек.
Подагра
Из этиологических факторов, вызывающих развитие подагры следует, прежде всего, назвать избыточное поступление пуринов в организм. К этиофакторам подагры следует также отнести и избыточное поступление молибдена, который входит в состав ксантиноксидазы, катализирующей образование мочевой кислоты.
К подагре имеется и конституциональная предрасположенность в виде гиперурикемии. Пол и возраст также играет определенную роль в возникновении подагры (болеют в основном мужчины, женщины заболевают обычно после климакса). Возможно, что уровень половых гормонов оказывает влияние на экскрецию уратов с мочой. Заболевание чаще в пожилом возрасте в связи с развитием возрастной гиперурикемии.
Патогенез подагры включает:
1) Накопление мочекислых соединений в организме может быть связано с недостаточным выделением их почками, а также вследствие их усиленного образования.
2) Отложение солей мочевой кислоты, видимо, зависит от повышенного связывания этих солей тканями (уратогистехия). В суставах, суставных сумках, хрящах кровоснабжение слабое и всегда имеется тенденция к закислению среды. В кислой среде натриевая соль мочевой кислоты легче выпадает в осадок. Местный воспалительный процесс, обусловленный преципитацией уратов, вызывает увеличение числа лейкоцитов в очаге воспаления. Образование этими клетками молочной кислоты локально понижает величину рН. Эти процессы приводят к уменьшению растворимости уратов – установлению порочного цикла, следствием чего является дальнейшая преципитация уратов.
3) Острое подагрическое воспаление суставов, являющееся следствием отложения в них уратов. Суставы резко болезненны, отечны, гиперемированы. В мелких суставах отложение солей мочевой кислоты образует подагрические узлы, поражение крупных суставов приводит к их деформации.
4) Приступы подагры часто сопровождаются аллергическими явлениями (крапивница, эозинофилия).


