Аутопластика передней крестообразной связки – Пластика передней крестообразной связки коленного сустава – суть процедуры
Артроскопическая аутопластика передней крестообразной связки коленного сустава
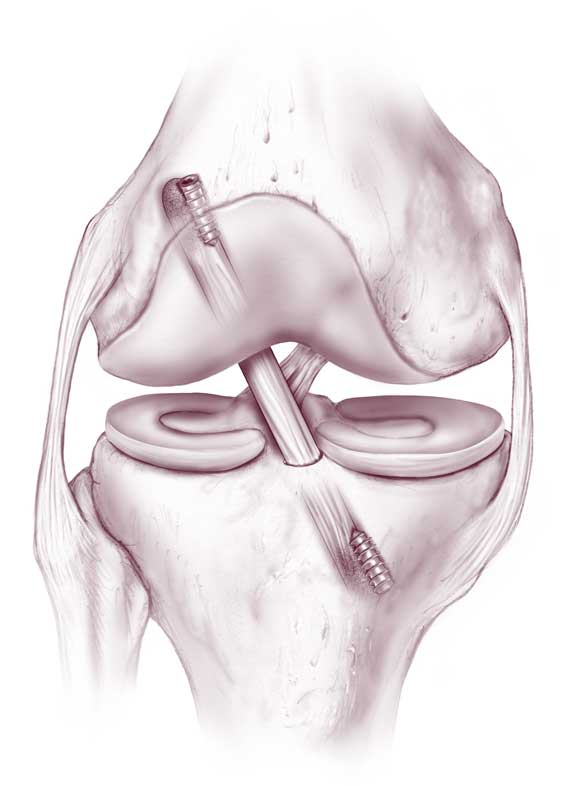
Аутопластика из собственной связки надколенника пациента является «золотым стандартом» среди методов восстановления передней крестообразной связки.
После удаления остатков передней крестообразной связки производится взятие аутотрансплантата с костными блоками. Затем аутотрансплантат под контролем артроскопа фиксируется в подготовленных каналах особыми рассасывающимися винтами. Накладываются косметические швы, асептические повязки.
Впоследствии коленный сустав фиксируется специальным жестким брейсом с регулируемым объемом движений, что позволяет с первых недель после операции начинать движения в суставе, улучшить реабилитацию и быстрее восстановить функцию сустава с новой функциональной связкой.
При выполнении этой операции применяются биодеградируемые “саморассасывающиеся” винты, аналогичные применяющимся в остеосинтезе, и расходные материалы ведущих мировых медицинских производителей, используется особый инструментарий, направители, риммеры.
Обычно продолжительность операции составляет полтора-два часа под адекватной анестезией. И уже через два часа после операции пациент уже может передвигаться, но необходимо недолгое нахождение в стационаре.
В послеоперационном периоде пациент обеспечивается обезболивающими препаратами, антибактериальной профилактической терапией, сосудистыми препаратами. Проводятся регулярные перевязки. До 4-6 недель после операции по восстановлению связочного аппарата необходимо перемещаться на костылях. Швы обычно снимаются на 12 сутки, после чего пациент выписывается на амбулаторное лечение и реабилитацию, под наблюдение оперирующего хирурга и врача-реабилитолога.
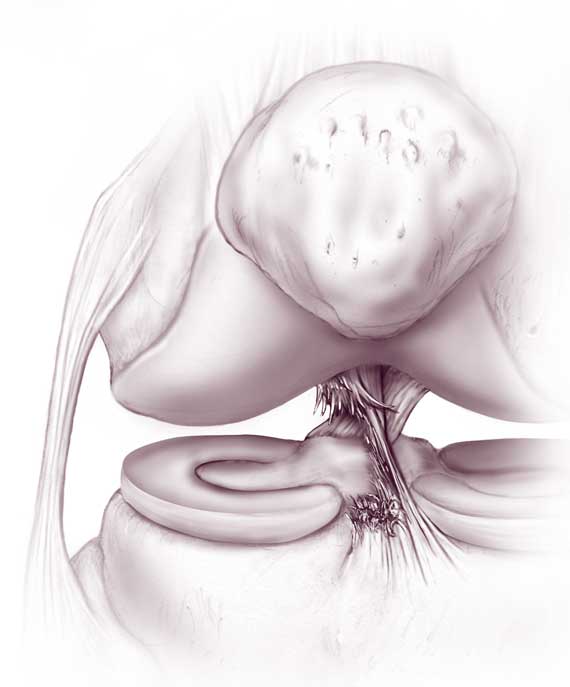
При артроскопической ревизии полости коленного сустава часто выявляются и различные повреждения менисков, суставного хряща суставных поверхностей голени, бедра, надколенника.
Смотрите видео
www.ortclinic.ruАртроскопическая пластика передней крестообразной связки трансплантатом из сухожилия четырехглавой мышцы бедра
13 декабря 2019 г. Дискуссионный клуб «Проблемы патологии хряща и варианты их решения»
Подробнее
29 ноября 2019 года Современные подходы при пластике ПКС. Ошибки и осложнения
Подробнее
12 апреля 2019 года Дискуссионный клуб «Проблемы патологии хряща и варианты их решения»
Подробнее
Уникальные технологии в ортезировании
Уникальные технологии клеточной регенерации
Повреждения передней крестообразной связки (ПКС) занимают лидирующие позиции в структуре травм коленного сустава. На протяжении многих лет подходы к лечению больных с повреждениями передней крестообразной связки неоднократно видоизменялись. Это было связано с внедрением в клиническую практику современных артроскопических технологий, совершенствованием хирургических методик и способов фиксации аутотрансплантатов, разработкой новых хирургических инструментов, изменениями в тактике реабилитации больных и многим другим. В настоящее время многие узловые вопросы артроскопической пластики передней крестообразной связки остаются не до конца решенными. Предметом дискуссий продолжает оставаться выбор оптимального пластического материала, к которому можно отнести свободный трансплантат из сухожилия четырехглавой мышцы бедра (ЧГМБ). Мы постарались в сжатой форме изложить наш опыт артроскопической пластики передней крестообразной связки трансплантатом из сухожилия четырехглавой мышцы бедра. Надеемся, что представленный ниже материал позволит читателю расширить спектр хирургических возможностей и улучшить результаты лечения больных с повреждениями ПКС.
Ревизионная артроскопическая аутопластика передней крестообразной связки трансплантатом из сухожилия четырехглавой мышцы бедра.
Техника забора и моделирования ауто трансплантата из сухожилия четырехглавой мышцы бедра с использованием инструментария KARL STORZ. Оперирует профессор Лазишвили Гурам Давидович
koleno21.ru
операция, реабилитация, восстановление после разрыва, травмы. Стоимость услуги – ЦКБ РАН
Опорно-двигательный аппарат не может нормально функционировать без системы связок. Именно это звено является ключевым в полноценном движении. Травмы в этой области – явление распространенное. Особенно подвержен травмированию коленный сустав за счет особенностей его строения. Повреждения могут сопровождаться разрывом или растяжением крестообразных связок и мениска. Хирургические вмешательство и пластика колена – единственно верное решение в такой ситуации. Только так можно быстро восстановить ткани и вернуть двигательную функцию колена. Речь о пластике передней крестообразной связки.
Все травмы ПКС подразделяются на типы в зависимости от степени повреждения:
- Первая степень – растяжение.
- Вторая степень – надрыв связок, чаще происходит в быту.
- Третья степень – разрыв связок, встречается чаще в профессиональном спорте.
Симптомы разрыва связок колена
Для постановки диагноза проводится осмотр, рентген. Среди внешних проявлений можно отметить:
- Усиление болевых ощущений при попытке наступить на ногу.
- Травмирование сопровождалось щелчком.
- Поврежденная область быстро отекает.
- Есть гематома или открытое кровотечение.
- Сустав приобретает необычную подвижность, появляется смещение.
Методы лечения
После травм первой и второй категории используется консервативный подход. На поврежденный сустав накладывается шина, бандаж. Срок ношения – около полутора месяцев. Если есть кровоизлияние, сгустки удаляются, полость сустава очищается от посторонних включений. Во время ношения шины периодически проводятся снимки для контроля ситуации. Второй этап
Пластика поврежденной связки
После разрыва необходима пластика связок коленного сустава. Замена связок производится сторонними материалами или с использованием собственных тканей пациента. Искусственный материал не уступает по прочности натуральным связкам. После артроскопической пластики период восстановления минимальный. В ходе операции ткани повреждаются незначительно, замена тканей выполняется через проколы. Для выполнения операции используется местное обезболивание или общий наркоз.
Пластика коленного сустава проводится с применением современного высокоточного оборудования и включает несколько этапов:
- Проколы кожи в нужных местах.
- Введение инструментов, камеры для передачи изображения на экран.
- Обследование состояния сустава, его полости объема повреждения.
- Удаление тканей, коррекция мениска при необходимости.
- Введение новых тканей, фиксация трансплантата швами.
Пластика коленного сустава не оставляет рубцов и шрамов благодаря применению современного хирургического оборудования.
Показания и противопоказания для операции
Аутопластика показана в случаях:
- Полного разрыва связок.
- Медленного заживления после использования консервативных методов лечения.
- Лигаментоза.
- После повторных травм, которые сопровождались разрывами и растяжениями.
Среди преимуществ такого вмешательства:
- Пересадка собственных тканей пациента.
- Операция не приводит к потере функциональности сустава.
- Пересаженные ткани не могут быть отторгнуты организмом.
К противопоказаниям для пересадки ПКС относятся:
- Контрактура сустава, затрудненный доступ к мягким тканям.
- Воспалительные, гнойные процессы.
- Обострение тяжелых хронических заболеваний, не позволяющие провести анестезию.
- Серьезные патологии сердечно-сосудистой системы.
- Заболевания дыхательных и мочевыводящих путей.
Какие могут быть осложнения
После вмешательства есть риск развития нежелательных последствий. Среди них:
- Контрактура сустава (может возникать при неправильном вмешательстве).
- Артроз, дегенеративные изменения в колене.
- Боль, ограничение подвижности.
- Смещение или отрыв пересаженной ткани.
- Отторжение материала – происходит крайне редко.
- Аллергическая реакция на наркоз.
Полное восстановление занимает около четырех месяцев. В 95 случаях из 100 операция оказывается успешной.
Период после операции
Послеоперационный период – важнейший этап, от которого во многом зависит успех реабилитации пациента. Хирургическое вмешательство – это только первый шаг. Далее следует послеоперационное лечение, которое включает несколько этапов:
- Первые недели (обычно до месяца) пациент находится в специализированном центре реабилитации и носит гипсовую повязку для фиксации сустава. В этот период используется физиотерапия, ношение ортеза, призванного защищать сустав, способствовать его скорейшему восстановлению и контролировать тонус мышц.
- По прошествии месяца пациент может начинать нагружать сустав. Это возможно только при условии полного контроля мышц и отсутствия отеков. Еще через две недели пациент может возвращаться к привычной жизни.
Основные мероприятия по реабилитации:
- Компрессы.
- Массаж.
- Растирание.
- Упражнения ЛФК.
- Неинтенсивные прогулки.
Общее время приживления трансплантата – около трех недель. В течение всего этого времени связки остаются уязвимыми и слабыми. Обращение должно быть максимально осторожным и деликатным. Пациенту нельзя стоять на коленях, резко приседать, прыгать. Дополнительную защиту дает ортез.
Восстановление функций ноги после трансплантации требует усилий и упражнений. В общей сложности полная адаптация занимает около года. Все это время пациент может ощущать некоторый дискомфорт, тепло в зоне вмешательства, а также наблюдать некоторую отечность. Колено после пластики не станет абсолютно таким же, как и до этого. Однако при грамотном подходе восстановить полную функциональность и даже вернуться к спортивным занятиям вполне возможно.
Где сделать пластику коленного сустава в Москве
Узнать стоимость операции и всех сопутствующих манипуляций в ЦКБ РАН в Москве можно по телефону или на сайте клиники. Время восстановления, цена и объем вмешательства зависят от сложности ситуации. В любом случае после восстановления пациент сможет использовать сустав без боли и дискомфорта.
www.ckbran.ru
Восстановление передней крестообразной связки коленного сустава
Пластика по методу «Легамис»Для реконструкции берется специальный имплантат, представляющий собой полиэтиленовую нить и гипоаллергенную стальную втулку. Нить фиксируется к кости бедра, втулка устанавливается в кость голени. Синтетическая нить протягивается вдоль проблемной связки, соединяя ее разорванные части, а затем в оптимальном натяжении соединяется с концом втулки.
Таким образом, достигается надежная стабилизация колена, за счет чего создаются благоприятные условия для естественного сращения разрыва. Метод целесообразен только при свежей травме, давностью не более 3 недель. На сегодняшний день данный способ практикуется в единичных клиниках Европы, как правило, в медицинских центрах Германии. Собственно, немецкими специалистами эта технология и была разработана.
Показания к хирургическому вмешательству
Артроскопическая пластика ПКС коленного сустава сразу после случившегося инцидента не выполняется во избежание осложнений. Как правило, оперативный сеанс не назначается до тех пор, пока не ликвидируется воспалительный очаг и отек. Весь этот период организовывается грамотная консервативная медицинская помощь и иммобилизация конечности.
При каких выявленных проблемах придется пройти пластику ПКС коленного сустава по истечении некоторого времени? Существуют определенные факторы, являющиеся однозначным поводом для проведения пластической операции методом артроскопии, это:
- поперечный разрыв связки по всей линии ширины;
- абсолютный отрыв волокон от места крепления к кости;
- частичное повреждение с выраженным градусом нестабильности колена;
- неудачно проведенная пластика травмированной ПКС коленного сустава, которая не поспособствовала стабилизации вследствие некорректной трансплантации;
- хронически повторяющиеся растяжения и разрывы;
- безрезультативное консервативное лечение.
Важно! Еще раз напомним, что вмиг после травмы реконструктивная процедура не делается, но это не означает, что пострадавшему не нужна помощь врача-травматолога. Чтобы не усугубить проблему, нужно безотлагательно обследоваться, получить от специалиста квалифицированные рекомендации и немедленно приступить к их выполнению! В порядке исключения незамедлительная хирургия может быть проведена либо при обширной сочетанной травме (разрыв ПКС в комбинации с повреждениями костей, менисков, других связок), или спортсменам для быстрого возвращения в профессиональный спорт.
Противопоказания к операции
Несмотря на тот факт, что пластика крестообразной связки коленного сустава является одной из самых популярных методик благодаря высокой эффективности и минимальной инвазивности, она не каждому может быть выполнена. Противопоказаний, к счастью, не так много:
- выраженная контрактура сустава;
- местные кожные инфекции, воспаления, гнойные абсцессы, язвы;
- тяжелой формы патологии сердца, дыхательной системы, вен и сосудов ног;
- любые хронические болезни в стадии обострения;
- аллергия на медицинские препараты, используемые для наркоза.
Если предполагается трансплантация собственных сухожилий из четырехглавой мышцы бедра или связок наколенника, а у пациента имеются проблемы с мышечно-сухожильными элементами сгибательного/разгибательного аппарата, такую процедуру провести невозможно. Однако ему может быть предложен один из двух альтернативных вариантов: сделать аллотрансплантацию или имплантировать систему «Легамис». Конечно, если клиника оказывает подобные услуги.
Реабилитация пациента после хирургии
После пластики крестообразных связок коленного сустава положено в течение 1 месяца передвигаться только на костылях, не опираясь на ногу. Примерно столько же длится иммобилизация прооперированного отдела, которая достигается посредством использования гипсовой повязки, тутора или ортеза, жестко зафиксированных в положении полного разгибания. Нагрузки на сустав весь этот период исключены. На раннем этапе прописывают обезболивающие и противовоспалительные лекарства. Обычно несколько дней колют определенный антибиотик.

На протяжении 2-х недель, начиная примерно с 3-х суток, выполняются изометрические упражнения на сокращение ЧГМБ, сгибание/разгибание голеностопа, в положении лежа делается осторожное поднимание конечности с удержанием. Дополнительно пациент проходит сеансы физиотерапии: магнитолечение; УВЧ, электромиостимуляцию и пр. Где-то через 4 недели, путем постепенного увеличения нагрузки на ногу, плавно переходят с костылей на трость, а после – на ходьбу без поддерживающих приспособлений. На этом этапе жесткий фиксатор меняют на полужесткий ортез, предпочтительнее каркасной модели.

Лечебную физкультуру и комплекс физиотерапевтических процедур желательно проходить в условиях реабилитационного центра минимум 8 недель под руководством методиста-реабилитолога. К этому времени должна быть достигнута полная амплитуда движений в колене, отработана правильная походка. Занятия проводятся уже в специальном наколеннике нежесткого типа. Вернуться к обычной жизни без ограничений разрешается сугубо после прочного укрепления связки-заместителя. Окончательное восстановление крестообразной связки коленного сустава, если была использована пластика, наступает не ранее чем через 3 месяца, иногда только через полгода.
https://cyberleninka.ru/article/v/opyt-hirurgicheskogo-lecheniya-povrezhdeniy-peredney-krestoobraznoy-svyazki-u-podrostkov
https://cyberleninka.ru/article/v/analiz-effektivnosti-tehnologiy-artroskopicheskoy-plastiki-peredney-krestoobraznoy-svyazki-kolennogo-sustava
https://www.mayoclinic.org/tests-procedures/acl-reconstruction/about/pac-20384598
https://drrobertlaprademd.com/acl-reconstruction/
Добавить комментарий Отменить ответ
»
Пластика ПКС является одним из наиболее эффективных способов лечения заболеваний коленного сустава. Данный отдел опорно-двигательного аппарата состоит из 2 костей и надколенника. Сустав считается нестабильным ввиду недостаточной сопоставимости поверхностей. Движения осуществляются благодаря связкам и хрящам. Переднее крестообразное сухожилие предупреждает переразгибание колена, заднее препятствует смещению бедра. Последнее практически не травмируется отдельно, его повреждение всегда сопровождается разрывом ПКС.

Показания к операции
Артроскопическая пластика передней крестообразной связки коленного сустава — наиболее надежный способ устранения последствий травм. При ее проведении разрушенные волокна заменяются трансплантатом из донорских или искусственных материалов, обладающих высокой прочностью. Операция отличается коротким восстановительным периодом и низким риском возникновения осложнений. Через небольшие проколы вводятся хирургические инструменты и камера. На коже после операции не остается крупных рубцов.
Плпастика крестообразной связки имеет свои показания и противопоказания. Хирургическое вмешательство рекомендовано при:
- полном отрыве мягких тканей в местах их прикрепления к костям;
- продольных разрывах;
- неэффективности медикаментозного лечения;
- застарелых травмах, способствующих появлению болей в суставах;
- послеоперационных осложнениях;
- лигаментозе.

Материал для изготовления трансплантата при пластике ПКС чаще всего получают из четырехглавой бедренной мышцы. Имплант не отторгается организмом, кроме того, при заборе тканей не нарушаются функции иных отделов опорно-двигательного аппарата.
Операция по восстановлению ПКС противопоказана при наличии некоторых сопутствующих заболеваний. Врач должен провести детальное обследование и решить, возможно ли выполнение хирургического вмешательства.
К противопоказаниям можно отнести контрактуру колена. Сращение частей сустава не позволяет провести все необходимые манипуляции. Операция при разрыве связок не назначается пациентам, имеющим патологии сердечно-сосудистой системы, печени и почек, которые препятствуют постановке анестезии.

Аллергические реакции на наркоз встречаются достаточно редко. Проблему устраняют путем подбора другого препарата. При атрофии сухожилий четырехглавой мышцы трансплантат изготавливается из иных материалов, например, донорских тканей, полученных посмертно. Герпетические и гнойничковые высыпания на коже нижних конечностей также считаются противопоказаниями к операции. Большинство описанных выше состояний устраняют путем предварительного лечения. После улучшения состояния пациента начинается подготовка к операции.
Техника выполнения
 Пластика крестообразной связки начинается с постановки анестезии, которая может быть как местной, так и общей. После оценки чувствительности операционное поле обрабатывают антисептиком и делают проколы на коже и расположенных ниже мягких тканях. Они будут использоваться для введения инструментов. Синовиальную полость заполняют физраствором, который растягивает ткани, создавая пространство для размещения инструментов. Сустав осматривают с помощью камеры, подающей изображение на монитор. После выявления пораженных тканей производится их удаление и замена трансплантатом.
Пластика крестообразной связки начинается с постановки анестезии, которая может быть как местной, так и общей. После оценки чувствительности операционное поле обрабатывают антисептиком и делают проколы на коже и расположенных ниже мягких тканях. Они будут использоваться для введения инструментов. Синовиальную полость заполняют физраствором, который растягивает ткани, создавая пространство для размещения инструментов. Сустав осматривают с помощью камеры, подающей изображение на монитор. После выявления пораженных тканей производится их удаление и замена трансплантатом.
Существует несколько вариантов операций на переднюю крестообразную связку. Для восстановления мягких тканей надколенника берется средняя часть волокон, расположенных ближе к берцовой кости. Эта связка дополняет крепкое сухожилие четырехглавой мышцы. Ее забор никак не отражается на работе ноги. Подколенные сухожилия бедренных мышц отделяют специальным инструментом.
При невозможности применения аутотрансплантанта применяются ткани, полученные от донора. В таком случае риск отторжения многократно повышается. Полученную связку складывают вдвое и закрепляют на кости в местах крепления разрушенной ПКС.
Возможные осложнения
Даже при проведении малоинвазивных хирургических вмешательств риск развития негативных последствий сохраняется. Если после операции не двигается нога или не разгибается колено, речь идет о контрактуре. Избежать появления патологических изменений помогает правильное выполнение восстановительных процедур.
Деформирующий артроз — дегенеративный процесс, при котором наблюдаются боли в переднем отделе колена. Развитию заболевания способствует забор части четырехглавой мышцы. Отрыв транспланта возникает при оказании чрезмерных нагрузок на замененную связку. Устраняется путем повторного хирургического вмешательства. Вероятность аллергической реакции на обезболивание снижается при тщательном обследовании пациента анестезиологом. При развитии патологии больного переводят в реанимацию.

Отек и температура после операции свидетельствуют о присоединении бактериальной инфекции либо начавшемся отторжении. Так как чаще всего используются собственные ткани, подобные осложнения практически не возникают. Пациент должен своевременно сообщать специалистам об имеющихся заболеваниях, возможности аллергических реакций на те или иные препараты.
Послеоперационный период
Сколько длится больничный срок после замены крестообразной связки? Все зависит от:
- характера травмы;
- сложности хирургического вмешательства;
- общего состояния организма.
 Основным принципом реабилитации является сохранение подвижности сустава, которого добиваются путем выполнения несложных упражнений. В первые дни после операции нагрузки на сустав должны быть минимальными. Конечность обездвиживают с помощью специальных устройств. Они фиксируют колено, препятствуют совершению резких движений, восстанавливают функции сустава.
Основным принципом реабилитации является сохранение подвижности сустава, которого добиваются путем выполнения несложных упражнений. В первые дни после операции нагрузки на сустав должны быть минимальными. Конечность обездвиживают с помощью специальных устройств. Они фиксируют колено, препятствуют совершению резких движений, восстанавливают функции сустава.
После того как была проведена пластика ПКС коленного сустава, при ходьбе рекомендуется использовать вспомогательные приспособления. В первые дни — это костыли, через несколько недель — трость. Нагрузки на сустав увеличивают плавно.
Выбор типов упражнений — задача лечащего врача.
Восстановление проходит быстрее при применении физиотерапевтических процедур. Через несколько месяцев после операции можно переходить к занятиям на велотренажере и беговой дорожке. Продолжительность больничного в большинстве случаев не превышает 4 месяцев.
Прогноз зависит от правильности выполнения рекомендаций врача. В 90% случаев крестообразная связка восстанавливается полностью. К занятию спортом можно приступать через полгода после операции.
Реабилитация после пластики передней или задней крестообразной связки колена является важным этапом полного восстановления его функциональности. Можно ли осуществлять восстановление в домашних условиях? Сколько восстанавливается после разрыва крестообразная связка? Возможны ли осложнения после хирургического вмешательства? Об этом и многом другом вы прочитаете нашей статье.
Когда начинается восстановительный период
Точных сроков начала восстановительного периода после оперативного вмешательства не существует, поскольку на необходимость подобного мероприятия в контексте его введения влияет достаточно много факторов. В первую очередь это тяжесть, степень и характер ранее полученной травмы, которая привела к повреждению крестов колена.
Также немаловажную роль играет и сам тип операции по восстановлению функциональности коленного сустава, будь то малотравматичная артроскопия, либо же классическая форма вскрытия полости сустава в виде артротомии.
После проведения артроскопии связок колена реабилитационный период может начинаться уже после 2-3 суток со дня проведения оперативного вмешательства, а при артротомии же необходимые мероприятия иногда начинаются спустя несколько недель после интенсивной консервативной терапии.
Где проходит реабилитация
Вне зависимости от обстоятельств, как минимум первые несколько дней после оперативного вмешательства даже незначительного характера пациент находится под присмотром врачей.
Далее, в зависимости от текущего состояния, рациональности и необходимости, человек может продолжить свое пребывание в стационаре либо же специалист рекомендует поменять реабилитационный схему со стационарной на амбулаторную или нахождение в домашних условиях.
Как показывает современная клиническая практика при повреждении крестов коленного сустава первой и частично второй степени среднее время пребывания в стационаре составляет около 2 недель.
Восстановительные мероприятия после операции
Основной целью восстановления является возврат полной функциональности нижней конечности и колена у пациента. При этом существенную роль играет необходимость возвращения к профессиональной активности, например занятию спортом, поскольку в таком случае реабилитации затягивается на более длительный период.
Непосредственно в период реабилитации после операции на переднюю или заднюю крестообразную связку коленного сустава специалист обычно назначает пациенту установку ортеза, который сохраняет и лишь частично уменьшает текущий диапазон движения коленного сустава, улучшает стабильность данной структуры, обеспечивает надежную профилактику вероятности повторной травмы в первые недели реабилитационного периода.
При этом устройство нужно носить только в повседневной деятельности, а во время восстановительных мероприятий оно снимается. Вторая важная веха необходимого восстановительного периода – это ведение комплексных упражнений послеоперационной реабилитации.
Вначале ЛФК является пассивной, однако постепенно нагрузки линейно увеличиваются к полноценным, позволяющим создать положительную динамическую стабилизацию сустава и стимулировать мышцы для их целенаправленного укрепления.
Помимо этого в первые недели реабилитации после операции по восстановлению крестообразной связки назначается консервативно-инструментальная терапия в виде дренажа полости коленного сустава, профилактики осложнений вторичных бактериальных инфекций, общего обезболивания, применение венотоников, при необходимости – миорелаксантов, хондропротекторов и так далее.
Восстановление после пластики передней крестообразной связки
В общем случае восстановление передней крестообразной связки коленного сустава после проведения хирургического вмешательства совпадают с вышеописанными процедурами.
При этом основной упор делается на индукцию разгибательной активности коленного сустава. Как показывает практика, при поражениях передней крестообразной связки реже формируются осложнения, поэтому в среднем.
Восстановительный период не продолжается более 5-6 недель, если конечно у пациента не было полного разрыва крестов коленного сустава с их трансплантацией в рамках хирургической операции.
Реабилитация после разрыва крестообразной связки может занимать около 3 месяцев, параллельно проводятся необходимые действия по снижению рисков отторжения имплантата при использовании материалов от донора.
Восстановление после операции на заднюю крестообразную связку
Основной перечень мероприятий восстановительного периода при проведении операций на латеральную, заднюю, медиальную крестообразные связки не отличаются друг от друга, однако есть специфика в рамках выполнения комплексов ЛФК.
Изолированные повреждения медиальной и латеральных связок встречаются достаточно редко, чаще всего этот вид проблемы дополняется надрывом либо растяжением основных передних, либо задних структур — в этой ситуации нагрузки распределяются в рамках лечебной физкультуры равномерно, как на сгибание/разгибание, так и на осевое движение.
Сроки реабилитационного периода
Точных сроков восстановления, пациентам после разрыва крестов коленного сустава не сможет назвать вам не один профильный специалист, поскольку на данный процесс влияет целый ряд факторов, от тяжести ранее полученной травмы и эффективности проведения хирургического вмешательства до рисков формирования осложнений и точного соблюдения необходимых рекомендаций врачей.
Упражнения для восстановления функциональности сустава
Базовые упражнения для восстановления крестообразных связок колена:
- Классическую ходьбу с помощью костылей. Основная опора производится на ногу с оперированным мениском, при этом стопа полностью ставится на горизонтальную поверхность. Длительность процедуры составляет от 5 до 15 минут не более 5 раз в течение суток;
- Опорные нагрузки. Пациент осуществляет упор на оперированную ногу с нагрузкой, которая идентична массе конечности. При этом основная опора производится на пятку, а не носок, сама же нагрузка и не должна вызывать болевые ощущения в коленном суставе. Несколько подходов по 5 минут в течение комплексных процедур ЛФК не более 4 раз за сутки;
- Разгибательные и сгибательные движения. Осуществляется со стопами. Сначала носки тянутся на себя, а потом – от себя. Не более 30 раз каждые несколько часов в течение суток;
- Напряжение мышц бедра. В произвольном порядке осуществляется напряжение задних и передних мышц бедра в течение 7 секунд по 15 подходов около 5 раз за сутки;
Следует отметить, что в рамках ЛФК при хождении с опорой запрещено сгибать ногу, при этом активное разгибание голени в коленном суставе должно варьироваться в диапазоне от 0 максимум до 40 градусов.
Дополнительно вводится восстановление подвижности надколенника со смещением коленной чашечки рукой вверх и вниз, поднятие прямых ног на весу из положения лежа, активное сгибание и пассивное разгибание колена до начала болевого синдрома.
Помимо этого рекомендовано проведение и отведение ног в положении лежа на боку, сгибание ноги в колене, используя ручную тягу, полуприседания, поднятие нижних конечностей из положения стоя с внешним сопротивлением и так далее.
Возможные последствия и осложнения
Потенциальные осложнения операционного периода зависит от типа проводимого хирургического вмешательства.
К основным осложнениям после проведения артротомии относят:
- Тромбоэмболию;
- Рефлекторную дистрофию;
- Комплексное повреждение нервных корешков;
- Формирование гемартроза;
- Синовита;
- Прямое травмирование сустава хирургическими инструментами;
- Вторичных воспалительных процессов инфекционной природы.
При артроскопии чаще всего формируются негативные последствия в виде:
- Повреждения нервных окончаний, сосудов;
- Развития вторичных инфекций;
- Образования нейротрофического синдрома;
- Нарушений работы периферических сосудов в указанной локализации.
Вне зависимости от вида хирургического вмешательства при установке имплантата могут возникать:
- Проблемы с фиксаторами связок и повторные разрывы крестообразных структур;
- Тромбозы периферических сосудов;
- Контрактуры сустава.
Общие рекомендации на послеоперационный период
К основным рекомендациям в рамках реабилитационного периода можно отнести следующие тезисы:
- Четкое неукоснительное соблюдение рекомендаций реабилитолога, физиотерапевта и прочих специалистов. В большинстве случаев схема восстановления разрабатываются индивидуально для пациента с учетом особенностей его травмы, эффективности произведенных операций и так далее. В данном контексте важнейшим пунктом, позволяющим ускорить выздоровление, считается соблюдение всех рекомендаций врачей;
- Исключения самолечения. Народные методы терапии, рекомендации друзей и прочие процедуры, не вписывающиеся в основной терапевтический процесс, должны быть полностью исключены. В крайнем случае, перед использованием подобных методик необходимо в обязательном порядке проконсультироваться с вашим лечащим врачом и получить его одобрение;
- Правильный настрой. Положительное настроение, отсутствие стрессов и общий благожелательный фон помогут быстрее преодолеть сложный период в жизни и вернуться к повседневной нормальной деятельности.
Виктор Системов — эксперт сайта 1Travmpunkt
>
boligolovnie.ru
Ошибки и осложнения, характерные для аутопластики передней крестообразной связки коленного сустава
Технические ошибки, связанные с выполнением операции:
1. Нестабильность фиксаторов наблюдали у 9 (6,5%) пациентов контрольной группы и у 3 (2,2%) основной группы.
2. Разрыв сухожилия и трещина в костном блоке трансплантата при внедрении его в канал. Мы наблюдали всего один (0,8%) случай раскалывания костного блока и разволокнения сухожилия аутотрансплантата из средней трети связки надколенника в контрольной группе, что сделало его непригодным для аутопластики. Пациенту была выполнена лавсанопластика.
Осложнения в ближайшем послеоперационном периоде (до 1 месяца):
1. Боли в области забора аутотрансплантата – наблюдали у 18 (12,9%) пациентов контрольной группы (11 больных после B-Pt-B пластики и 7 после hamstring пластики) и у 6 (4,3%) пациентов основной группы (все 6 пациентов после B-Pt-B пластики).
2. Кровотечение с гематомой на месте забора трансплантата – было выявлено у 11 (7,9%) больных контрольной группы после B-Pt-B пластики и у 4 (2,9%) пациентов основной группы также после B-Pt-B пластики.
Осложнения в отдаленном (более 6 месяцев) послеоперационном периоде при аутопластике передней крестообразной связки:
1. Контрактура коленного сустава. Наблюдали у 29 (20,9%) пациентов контрольной группы и у 6 (4,3%) пациентов основной группы после B-Pt-B пластики.
2. Рефлекторная симпатическая дистрофия и гипотрофия мышц была у 24 (17,3%) больных контрольной группы (11 пациентов после B-Pt-B пластики и 13 после hamstring пластики). В основной группе данное осложнение не наблюдали.
3. Боль в пателло-феморальном сочленении наблюдали у 3 (2,2%) пациентов контрольной группы после B-Pt-B пластики.
4. Пателлярный тендинит в месте забора аутотрансплантата из связки надколенника встретился у 3 (2,2%) пациентов контрольной группы после B-Pt-B пластики.
5. Impingement-синдром наблюдали у 3 (2,2%) пациентов контрольной группы (2 пациента после B-Pt-B пластики и 1 после hamstring пластики). Использование специальной навигационной системы позволило избежать impingement-синдрома в основной группе.
5. Атртрофиброз коленного сустава («cyclop» – синдром) наблюдали у одного (0,7%) пациента контрольной группы после B-Pt-B пластики.
Осложнения, характерные для лавсанопластики передней крестообразной связки
Осложнения в ближайшем послеоперационном периоде:
1. Нагноение послеоперационных ран, гнойный артрит были у 3 (2,4%) наших больных контрольной группы.
2. Гематомы в месте фиксации протеза наблюдали у 9 (6,5%) пациентов контрольной группы и у 4 (2,9%) пациентов основной группы.
Осложнения в отдаленном послеоперационном периоде:
1. Рецидив нестабильности после вынужденного удаления протеза наблюдали у 9 (6,5%) больных контрольной группы. В основной группе данное осложнение не наблюдали.
2. Рецидивирующие синовиты (реакция сустава на введение протеза) были у 5 (3,6%) пациентов контрольной группы и у 3 (2,2%) основной группы.
3. Impingement-синдром наблюдали у 7 (5,0%) больных контрольной группы. Использование специальной навигационной системы позволило избежать impingement-синдрома в основной группе.
4. Нестабильность или повреждение фиксатора (пробки, винта, штифта), выпадение его в полость сустава наблюдали у одного (0,8%) больного основной группы.
При оперативном лечении повреждений передней крестообразной связки отличные, хорошие и удовлетворительные результаты были достигнуты у 39 (28,1%), 42 (30,2%) и 43 (30,9%) больных соответственно. Неудовлетворительные результаты были у 15 (10,8%). Причинами неудовлетворительных исходов были осложнения в позднем послеоперационном периоде в виде несостоятельности трансплантата, нагноения, стойкой контрактуры коленного сустава. Таким образом, успех после оперативного лечения достигнут у 89,2% больных.
Положительные исходы ауто- и лавсанопластики – 95,5% и 83,6% соответственно. Неудовлетворительные результаты после аутопластики были у 3 (2,2%) пациентов, после лавсанопластики – у 12 (8,6%). Основные причины неудовлетворительных результатов оперативного лечения при аутопластике передней крестообразной связки: позднее включение лечебной физкультуры в послеоперационном периоде; длительная иммобилизация сустава; ранняя нагрузка на сустав; неправильно подобранный источник пластического материала. Причины неудовлетворительных результатов лавсанопластики: нарушение техники изометричного расположения протеза; погрешности в асептике; индивидуальная воспалительная реакция тканей пациента на протез.
В старшей возрастной группе пациентов лавсанопластика передней крестообразной связки позволила достигнуть успеха в 96,2%, а аутопластика в 80%. В молодой группе лавсанопластика позволила достигнуть успеха в 76%, а аутопластика в 97,6%.
При изолированном повреждении передней крестообразной связки необходимо отдавать предпочтение аутопластике, особенно у лиц молодого возраста, ведущих физически активный образ жизни и предъявляющих повышенные требования к функции коленного сустава. У пациентов старшей возрастной группы при наличии контрактуры коленного сустава, гипотрофии мышц бедра, при необходимости максимально быстро восстановить функцию коленного сустава, показана лавсанопластика передней крестообразной связки.
Из 139 наших пациентов 37 (26,6%) основной группы были прооперированы с использованием артроскопической техники. Артроскопические операции, по сравнению с открытыми, обладают неоспоримыми преимуществами в отношении как травматичности вмешательства, так и сроков пребывания в стационаре (средний койко-день – 15 при артроскопии против 25 при открытой методике). Реабилитация после артроскопической методики аутопластики передней крестообразной связки занимала в 1,5 раза меньше времени, чем после открытой.
Благодаря усовершенствованной нами хирургической технике было достигнуто улучшение результатов лечения в основной группе пациентов по сравнению с контрольной.
Выводы
Наиболее часто повреждается передняя крестообразная связка у мужчин (70,5%) преимущественно в возрасте от 21 года до 30 лет (24,5%), ведущих физически активный, спортивный образ жизни. В большинстве случаев наблюдаются застарелые (93,5%) и изолированные (41,7%) повреждения передней крестообразной связки и передняя нестабильность коленного сустава (67,6%).
Для диагностики острой и хронической нестабильности коленного сустава наибольшее значение имеет сочетание клинического, магнитно-резонансного и артроскопического методов исследования (точность диагностики 99,8±0,1%). Артроскопия занимает ведущее место среди всех диагностических методов исследования (точность диагностики 98,9±0,3%).
При изолированном повреждении передней крестообразной связки необходимо отдавать предпочтение аутопластике, особенно у лиц молодого возраста, ведущих физически активный образ жизни, а пациентам старшей возрастной группы, для быстрого восстановления функции коленного сустава, показана лавсанопластика.
Артроскопические операции, по сравнению с открытыми, менее травматичны, позволяют сократить средний койко-день с 23,3±1,8 до 15,7± 1,2 и уменьшить время реабилитации в 1,5 раза.
При застарелых повреждениях передней крестообразной связки показана лавсанопластика путем фиксации протеза акриловыми пробками в каналах бедра и большеберцовой кости.
Дифференциальный подход к лечению повреждений передней крестообразной связки с применением артроскопической техники при аутопластике и фиксации протеза акриловыми пробками при лавсанопластике позволили получить положительные исходы у 97,3% и 95,1% больных соответственно.
studfile.net
Расширение костных тоннелей после аутопластики передней крестообразной связки трансплантатами из сухожилий подколенных мышц Текст научной статьи по специальности «Клиническая медицина»
DOI: 10.23934/2223-9022-2017-6-3-233-237
расширение костных тоннелей после аутопластики передней крестообразной связки трансплантатами из сухожилий подколенных мышц (обзор литературы)
В.В. Сластинин*, А.М. Файн, А.Ю. Ваза
ГБУЗ «НИИ скорой помощи им. Н.В. Склифосовского Департамента здравоохранения г. Москвы», Москва, Российская Федерация
* Контактная информация: Сластинин Владимир Викторович, младший научный сотрудник отделения неотложной травматологии опорно-двигательного аппарата НИИ СП им. Н.В.Склифосовского. E-mail: [email protected]
РЕЗЮМЕ
Ключевые слова:
Ссылка для цитирования
Конфликт интересов Благодарности
Такой феномен, как расширение костных тоннелей после пластики передней крестообразной связки с использованием сухожилий подколенных мышц, известен на протяжении 30 лет. Несмотря на длительную историю данной проблемы, этиология остается до конца не изученной. На процесс расширения костных тоннелей влияет множество факторов, таких как метод фиксации трансплантата, особенности хирургической техники, протокол реабилитации, а также различные биологические факторы. Считается, что на функциональные результаты лечения данный феномен не влияет, но может создать серьезные проблемы при ревизионной пластике передней крестообразной связки. Учитывая возрастающий интерес к использованию трансплантатов из сухожилий подколенных мышц для пластики передней крестообразной связки, увеличение количества данных операций и, как следствие, ревизионных вмешательств, поиск методов профилактики расширения костных тоннелей становится все более актуальным.
расширение костных тоннелей, пластика передней крестообразной связки, осложнения, обзор литературы
Сластинин В.В., Файн А.М., Ваза А.Ю. Расширение костных тоннелей после аутопластики передней крестообразной связки трансплантатами из сухожилий подколенных мышц (обзор литературы). Журнал им. Н.В. Склифосовского Неотложная медицинская помощь. 2017; 6(3): 233-237. DOI: 10.23934/2223-9022-2017-6-3-233-237
Авторы заявляют об отсутствии конфликтов интересов
Исследование не имеет спонсорской поддержки
О расширении костных тоннелей в бедренной и большеберцовой костях после пластики передней крестообразной связки с использованием сухожилий подколенных мышц (полусухожильной и нежной мышц) известно на протяжении нескольких десятков лет. На процесс расширения костных тоннелей влияет множество факторов, таких как метод фиксации трансплантата, особенности хирургической техники, протокол реабилитации, а также различные биологические факторы. Большинство современных исследований показывают, что на функциональные результаты лечения данный феномен не влияет, но расширение костных тоннелей может создать серьезные проблемы при ревизионной пластике передней крестообразной связки. Нередко в данной ситуации требуются несколько этапов оперативного лечения — костная пластика с последующей пластикой крестообразной связки. Учитывая возрастающий интерес к использованию трансплантатов из сухожилий подколенных мышц для пластики передней крестообразной связки, увеличение количества данных операций и, как следствие, ревизионных вмешательств, поиск методов профилактики расширения костных тоннелей становится все более актуальным.
Имеются биомеханические исследования, доказывающие лучшие прочностные характеристики трансплантата из сухожилий подколенных мышц по сравнению с трансплантатом из связки надколенника диаметром 10 мм. Использование сухожилий
подколенных мышц для пластики передней крестообразной связки наращивает свою популярность из-за значительного травмирования донорской зоны при заборе трансплантата связки надколенника. Данные исследования подтверждают рациональность использования сухожилий подколенных мышц в качестве трансплантата для пластики передней крестообразной связки [1, 2].
Интеграция сухожилия и кости при использовании для пластики передней крестообразной связки сухожилий подколенных мышц является основной проблемой. Биологические процессы, протекающие на границе сухожильный трансплантат — костный тоннель, остаются до конца не изученными [3].
Наибольшее число авторов едины во мнении, что феномен расширения костных тоннелей не имеет четкой взаимосвязи с клиническими результатами пластики передней крестообразной связки [4-7]. В то же время он создает значительные проблемы при ревизионных операциях, что может потребовать дополнительного этапа лечения в виде костной пластики [8].
За последние 25 лет опубликовано множество статей, посвященных такому феномену, как расширение костных тоннелей после пластики передней крестообразной связки. Частота этого осложнения в случае использования сухожилий подколенных мышц на бедренной кости оценивается различными авторами от 25 до 100%, а на большеберцовой кости — от 29 до 100%. Расширение оценивается как разница между
диаметром использованного для формирования тоннеля сверла и размером наиболее широкой части тоннеля, оцененного по стандартным рентгенограммам (расстояние между внутренними границами склеро-зированного слоя костного тоннеля). Однако точные измерения по стандартным рентгенограммам затруднительны из-за эффекта увеличения и дивергенции рентгеновских лучей. Эти проблемы можно решить, используя компьютерную томографию [9].
Согласно исследованию Chen B. et al., опубликованному в 2007 г., расширение тоннелей происходит обычно в течение 3-6 мес после операции и остается неизменным через 12-24 мес после операции [10]. Оценка степени расширения костных тоннелей по рентгенограммам наиболее информативна на сроках не ранее 6 мес после операции, когда склероз стенок канала становится отчетливым [8].
Расширение костного тоннеля может произойти по всей его длине или только в одной его части. В литературе описаны три типа расширения: конический тип, линейный (или цилиндрический) и полостной тип [11]. При этом для бедренного тоннеля наиболее характерным является коническое расширение с наибольшим диаметром ближайшего к межмыщелковой зоне участка. Для большеберцового тоннеля наиболее типичным является цилиндрическое расширение. Форма тоннеля зависит от типа фиксации — при наибольшем удалении точки фиксации трансплантата от сустава формируется конический тоннель. Цилиндрический тип расширения наиболее часто возникает при фиксации интерферентными винтами [9].
Этиология расширения костных тоннелей многофакторна, при этом выделяют биомеханические и биологические факторы. По мнению некоторых авторов, биомеханические факторы в расширении костных тоннелей после пластики передней крестообразной связки играют ключевую роль [12]. В то же время в ряде исследований обнаружено, что большинство бедренных и большеберцовых тоннелей имеют веретенообразные расширения в центральной их части, что можно объяснить более значимым влиянием биологических, а не механических факторов [13].
Среди основных механических факторов можно выделить особенности техники и методов фиксации трансплантата, а также техники рассверливания каналов.
Рассверливание каналов в бедренной и больше-берцовой костях без направляющей спицы, нежесткая фиксация сверла могут привести к созданию тоннеля большего диаметра [9]. Убедительной разницы в степени расширения тоннелей при сравнении использования экстракционных и компактирующих сверел нет [14].
Очень важно, чтобы диаметр тоннеля точно соответствовал диаметру трансплантата. Имплантация очень тонкого относительно тоннеля трансплантата приводит к образованию так называемого мертвого пространства, в котором возможны дополнительные движения, а это является главным механическим фактором в этиологии расширения тоннелей. Многие авторы утверждают, что использование очень прочной и жесткой внутриканальной фиксации со смещением точки фиксации максимально близко к суставной линии способствует уменьшению вероятности расширения костных каналов. Идеальное анатомическое расположение костных тоннелей является необходимым
условием для достижения физиологической нагрузки на трансплантат, что позволяет избежать чрезмерного растяжения трансплантата и обеспечить хорошую интеграцию на границе кость-трансплантат [9].
В настоящее время доказана зависимость расширения большеберцового костного тоннеля от расстояния между интерферентным винтом и линией сустава — чем ближе к линии сустава интерферентный винт расположен в канале, тем ниже частота расширения костного тоннеля [15]. Расширение костного тоннеля происходит в области наибольшего давления трансплантата [16].
Использование кортикальных фиксаторов (фиксаторов-застежек) приводит к подвижности трансплантата в костном канале, с другой стороны, применение интерферентных винтов также способствует расширению тоннелей. В одном из исследований, сравнивающих накостную (фиксация на бедре ЕМоЬыПоп, на голени — кортикальный винт с шайбой) и анатомическую (интерферентные винты) фиксацию, выявлено, что расширение костных тоннелей происходит и в том, и в другом случае, только при фиксации винтами это происходит сразу за счет сминания стенки канала винтами, а при накостной фиксации расширение происходит в течение первых 6 мес, а затем оно уменьшается. В этом же исследовании выявлено, что расширение костных тоннелей никак не влияло на стабильность сустава и клинический результат за период наблюдения 2 года [17].
Широко известны связанные с использованием кортикальных фиксаторов «эффект подтяжек» и «эффект стеклоочистителя». Под первым феноменом подразумеваются движения трансплантата в костном канале в продольном направлении за счет относительно большого расстояния между областью фиксации и линией сустава. Второй феномен связан с движениями трансплантата в костном канале в поперечном направлении. Чем больше расстояние между областью фиксации трансплантата и суставной поверхностью, тем больше степень подвижности трансплантата в тоннеле. Оба эффекта затрудняют интеграцию сухожилия и кости [9].
Во время сверления канала возникает высокая температура, которая оказывает негативное действие на окружающие ткани. Возникающий локальный некроз может увеличить диаметр тоннеля и уменьшить регенеративный потенциал [9].
Не последнюю роль в расширении костных тоннелей играют и биологические факторы. Синовиальная жидкость содержит факторы воспаления, такие как ТШ-а, Д,-1beta, Д.-6, Д.-8, которые могут привести к остеолизу. После фиксации трансплантата может возникнуть так называемый эффект синовиальной ванны, который заключается в попадании синовиальной жидкости в те области, где трансплантат неплотно прилегает к стенкам костного канала. При этом создается агрессивная среда, препятствующая интеграции трансплантата и кости, а также стимулируются остеокласты, которые способствуют резорбции кости [18].
Имеет место прямая зависимость расширения костных тоннелей от скорости реабилитации при использовании сухожилий подколенных мышц — чем агрессивнее реабилитация, тем выраженнее расширение костного тоннеля большеберцовой кости [19]. Более сдержанная реабилитация на протяжении по крайней мере первых 6 нед после операции (ограничение
амплитуды движений на первые 3 нед от 0 до 60°, на последующие 3 нед — от 0 до 90° с разрешением полной нагрузки через 6 нед) дает возможность более полноценной интеграции трансплантата и костного тоннеля, что предотвращает расширение костного тоннеля [20].
Иммобилизация коленного сустава в течение 2 нед после пластики передней крестообразной связки трансплантатом из сухожилий подколенных мышц позволяет защитить область трансплантат-кость в первой и наиболее важной фазе интеграции трансплантата, уменьшая риск расширения костных тоннелей без влияния на конечный объем движений в коленном суставе [21].
При сохранении культи передней крестообразной связки ускоряется биологическая интеграция трансплантата. Более того, ткани культи за счет адгезии между ними и трансплантатом препятствуют затеканию синовиальной жидкости в костный канал, что предотвращает негативное действие цитокинов [22]. По данным некоторых авторов, сохранение культи передней крестообразной связки при ее пластике позволяет уменьшить расширение костного большебер-цового тоннеля [8].
В одном из исследований обнаружено, что плотная установка цилиндра из губчатой кости между трансплантатом и стенкой костного тоннеля уменьшает проксимальное расширение костного тоннеля и улучшает контакт между костью и сухожильным трансплантатом [23]. В другом исследовании отмечается, что основными преимуществами установки костного блока между трансплантатом и стенкой костного тоннеля являются предотвращение затекания суставной жидкости в область контакта трансплантат-кость, уменьшение движения трансплантата в тоннеле в продольном и поперечном направлениях и улучшение контакта трансплантат-кость. Отсутствие инородных фиксирующих материалов в тоннеле исключает проблемы, связанные с ними, облегчает ревизионные вмешательства и уменьшает стоимость операции [24].
В настоящее время ведется поиск средств, в основном в экспериментах на животных, позволяющих уменьшить негативное влияние внутрисуставной жидкости и усилить регенеративный потенциал на
ЛИТЕРАТУРА
1. Hamner D.L., Brown C.H. Jr., Steiner M.E., et al. Hamstring tendon grafts for reconstruction of the anterior cruciate ligament: biomechanical evaluation of the use of multiple strands and tensioning techniques. J. Bone Joint Surg. Am. 1999; 81(4): 549-557. PMID: 10225801.
2. Schimoler P.J., Braun D.T., Miller M.C., et al. Quadrupled Hamstring Graft Strength as a Function of Clinical Sizing. Arthroscopy. 2015; 31(6): 1091-1096. DOI: 10.1016/j.arthro.2015.01.013.
3. Chen C.H. Strategies to enhance tendon graft-bone healing in anterior cruciate ligament reconstruction. Chang Gung. Med. J. 2009; 32(5): 483-493. PMID: 19840505.
4. Lind M., Feller J., Webster K.E. Bone tunnel widening after anterior cruciate ligament reconstruction using EndoButton or EndoButton continuous loop. Arthroscopy. 2009; 25(11): 1275-1280. DOI: 10.1016/ j.arthro.2009.06.003.
5. IorioR., Di Sanzo V., Vadala A., et al. ACL reconstruction with hamstrings: how different technique and fixation devices influence bone tunnel enlargement. Eur. Rev. Med. Pharmacol. Sci. 2013; 17(21): 2956-2961. PMID: 24254567.
6. Weber A.E., Delos D., Oltean H.N., et al. Tibial and Femoral Tunnel Changes After ACL Reconstruction: A Prospective 2-Year Longitudinal MRI Study. Am. J. Sports Med. 2015; 43(5): 1147-1156. DOI: 10.1177/0 363546515570461.
границе трансплантат-кость. Для уменьшения влияния провоспалительных цитокинов в экспериментах на кроликах описано внутрисуставное применение альфа-2-макроглобулина, в результате чего уменьшается активность металлопротеиназ в суставной жидкости, что улучшает процессы интеграции трансплантата и окружающих тканей [25]. Обнадеживающие результаты получены в результате использования клеток-предшественников надкостницы в эксперименте на кроликах [26]. В других исследованиях на крысах обнаружено, что клетки CD34 (+), полученные из разорванной передней крестообразной связки человека, способствуют улучшению регенеративных процессов на границе сухожилие-кость за счет усиления ангио-генеза и остеогенеза, что также способствует увеличению биомеханической прочности [27].
Одним из наиболее доступных в настоящее время в клинической практике методов биологического воздействия на область сухожильный трансплантат-кость является использование надкостницы. В надкостнице содержатся мультипотентные мезодермальные клетки, а также клетки-предшественницы костной и хрящевой ткани, благодаря чему ткань надкостницы может использоваться для улучшения интеграции сухожилия и кости. Более того, надкостница способствует быстрому заполнению пространства межу трансплантатом и стенками костного тоннеля, препятствуя попаданию внутрисуставной жидкости между ними, за счет чего может быть уменьшено расширение костных тоннелей после пластики. Надкостницу несложно получить из области прикрепления сухожилий подколенных мышц на голени во время забора сухожилий [3].
На сегодняшний день проблема расширения костных тоннелей после пластики передней крестообразной связки с использованием сухожилий подколенных мышц остается до конца не изученной. Основными путями решения данной проблемы являются модификация методов фиксации трансплантата и хирургической техники, увеличение сроков послеоперационной иммобилизации коленного сустава, а также применение клеточных технологий, способствующих уменьшению агрессивности внутрисуставной жидкости и ускорению процессов интеграции трансплантата.
7. Lind M., Feller J., Webster K.E. Tibial bone tunnel widening is reduced by polylactate/hydroxyapatite interference screws compared to metal screws after ACL reconstruction with hamstring grafts. Knee. 2009; 16(6): 447-451. DOI: 10.1016/j.knee.2009.04.003.
8. Zhang Q., Zhang S., Cao X., et al. The effect of remnant preservation on tibial tunnel enlargement in ACL reconstruction with hamstring autograft: a prospective randomized controlled trial. Knee Surg. Sports Traumatol. Arthrosc. 2014; 22(1): 166-173. DOI: 10.1007/s00167-012-2341-7.
9. Stolarz M., Ficek K., Binkowski M., Wrobel Z. Bone tunnel enlargement following hamstring anterior cruciate ligament reconstruction: a comprehensive review. Phys Sportsmed. 2016: 45(1): 31-40. DOI: 10.1080/00913847.2017.1253429.
10. Chen B.C., Sun R., WangX.F., et al. The incidence and variation of tunnel enlargement after anterior cruciate ligament reconstruction. Zhonghua Wai Ke Za Zhi. 2007; 45(2): 78-81. PMID: 17418030.
11. Höher J., Möller H.D., Fu F.H. Bone tunnel enlargement after anterior cruciate ligament reconstruction: fact or fiction? Knee Surg. Sports Traumatol. Arthrosc. 1998; 6(4): 231-240. DOI: 10.1007/ s001670050105.
12. Jagodzinski M., Foerstemann T., Mall G., et al. Analysis of forces of ACL reconstructions at the tunnel entrance: is tunnel enlargement a biomechanical problem? J. Biomech. 2005; 38(1): 23-31. DOI: 10.1016/ j.jbiomech.2004.03.021.
13. Dave L.Y., Leong O.K., Karim S.A., Chong C.H. Tunnel enlargement 5 years after anterior cruciate ligament reconstruction: a radiographic and functional evaluation. Eur. J. Orthop. Surg. Traumatol. 2014; 24(2): 217-223. DOI: 10.1007/s00590-013-1175-4.
14. Siebold R., Kiss Z.S., Morris H.G. Effect of compaction drilling during ACL reconstruction with hamstrings on postoperative tunnel widening. Arch. Orthop. Trauma Surg. 2008; 128(5): 461-468. PMID: 17899135.
15. Giron F., Aglietti P., Cuomo P., et al. Anterior cruciate ligament reconstruction with double-looped semitendinosus and gracilis tendon graft directly fixed to cortical bone: 5-year results. Knee Surg. Sports Traumatol. Arthrosc. 2005: 13(2): 81-91. DOI: 10.1007/s00167-004-0553-1.
16. Xu Y., Ao Y., Wang J., et al. Relation of tunnel enlargement and tunnel placement after single-bundle anterior cruciate ligament reconstruction. Arthroscopy. 2011: 27 (7): 923-932. DOI: 10.1016/ j.arthro.2011.02.020.
17. Buelow J.U., Siebold R., Ellermann A. A prospective evaluation of tunnel enlargement in anterior cruciate ligament reconstruction with hamstrings: extracortical versus anatomical fixation. Knee Surg. Sports Traumatol. Arthrosc. 2002; 10(2): 80-85. DOI: 10.1007/s00167-001-0267-6.
18. Iorio R., Vadalà A., Di Vavo I., et al. Tunnel enlargement after anterior cruciate ligament reconstruction in patients with post-operative septic arthritis. Knee Surg. Sports Traumatol. Arthrosc. 2008: 16(10): 921-927. DOI: 10.1007/s00167-008-0575-1.
19. Yu f.K., Paessler H.H. Relationship between tunnel widening and different rehabilitation procedures after anterior cruciate ligament reconstruction with quadrupled hamstring tendons. Chin. Med. J. (Engl). 2005; 118(4): 320-326. PMID: 15740671.
20. Hantes M.E., Mastrokalos D.S., Yu J., Paessler H.H. The effect of early motion on tibial tunnel widening after anterior cruciate ligament replacement using hamstring tendon grafts. Arthroscopy. 2004; 20(6): 572-580. PMID: 15241306.
REFERENCES
1. Hamner D.L., Brown C.H. Jr., Steiner M.E., et al. Hamstring tendon grafts for reconstruction of the anterior cruciate ligament: biomechanical evaluation of the use of multiple strands and tensioning techniques. J Bone Joint Surg Am. 1999; 81(4): 549-557. PMID: 10225801.
2. Schimoler P.J., Braun D.T., Miller M.C., et al. Quadrupled Hamstring Graft Strength as a Function of Clinical Sizing. Arthroscopy. 2015; 31(6): 1091-1096. DOI: 10.1016/j.arthro.2015.01.013.
3. Chen C.H. Strategies to enhance tendon graft-bone healing in anterior cruciate ligament reconstruction. Chang Gung Med J. 2009; 32(5): 483-493. PMID: 19840505.
4. Lind M., Feller J., Webster K.E. Bone tunnel widening after anterior cruciate ligament reconstruction using EndoButton or EndoButton continuous loop. Arthroscopy. 2009; 25(11): 1275-1280. DOI: 10.1016/ j.arthro.2009.06.003.
5. Iorio R., Di Sanzo V., Vadalà A., et al. ACL reconstruction with hamstrings: how different technique and fixation devices influence bone tunnel enlargement. Eur Rev Med Pharmacol Sci. 2013; 17(21): 2956-2961. PMID: 24254567.
6. Weber A.E., Delos D., Oltean H.N., et al. Tibial and Femoral Tunnel Changes After ACL Reconstruction: A Prospective 2-Year Longitudinal MRI Study. Am J Sports Med. 2015; 43(5): 1147-1156. DOI: 10.1177/036 3546515570461.
7. Lind M., Feller J., Webster K.E. Tibial bone tunnel widening is reduced by polylactate/hydroxyapatite interference screws compared to metal screws after ACL reconstruction with hamstring grafts. Knee. 2009; 16(6): 447-451. DOI: 10.1016/j.knee.2009.04.003.
8. Zhang Q., Zhang S., Cao X., et al. The effect of remnant preservation on tibial tunnel enlargement in ACL reconstruction with hamstring autograft: a prospective randomized controlled trial. Knee Surg Sports Traumatol Arthrosc. 2014; 22(1): 166-173. DOI: 10.1007/s00167-012-2341-7.
9. Stolarz M., Ficek K., Binkowski M., Wrobel Z. Bone tunnel enlargement following hamstring anterior cruciate ligament reconstruction: a comprehensive review. Phys Sportsmed. 2016: 45(1): 31-40. DOI: 10.1080/00913847.2017.1253429.
10. Chen B.C., Sun R., Wang X.F., et al. The incidence and variation of tunnel enlargement after anterior cruciate ligament reconstruction. Zhonghua Wai Ke Za Zhi. 2007; 45(2): 78-81. PMID:17418030.
11. Höher J., Möller H.D., Fu F.H. Bone tunnel enlargement after anterior cruciate ligament reconstruction: fact or fiction? Knee Surg. Sports Traumatol Arthrosc. 1998; 6(4): 231-240. DOI: 10.1007/s001670050105.
12. Jagodzinski M., Foerstemann T., Mall G., et al. Analysis of forces of ACL reconstructions at the tunnel entrance: is tunnel enlargement a biomechanical problem? JBiomech. 2005; 38(1): 23-31. DOI: 10.1016/ j.jbiomech.2004.03.021.
13. Dave L.Y., Leong O.K., Karim S.A., Chong C.H. Tunnel enlargement 5 years after anterior cruciate ligament reconstruction: a radiographic and functional evaluation. Eur J Orthop Surg Traumatol. 2014; 24(2): 217-223. DOI: 10.1007/s00590-013-1175-4.
21. Vadala A., Iorio R., De Carli A., et al. The effect of accelerated, brace free, rehabilitation on bone tunnel enlargement after ACL reconstruction using hamstring tendons: a CT study. Knee Surg. Sports Traumatol. Arthrosc. 2007; 15(4): 365-371. DOI: 10.1007/s00167-006-0219-2.
22. Ahn J.H., Wang J.H., Lee Y.S., et al. Anterior cruciate ligament reconstruction using remnant preservation and a femoral tensioning technique: clinical and magnetic resonance imaging results.Arthroscopy. 2011; 27(8): 1079-1089. DOI: 10.1016/j.arthro.2011.03.002.
23. Geiges B., von Falck C., Knobloch K., et al. Biodegradable screw versus a press-fit bone plug fixation for ACL reconstruction: a prospective randomized study. Unfallchirurg. 2013; 116(2): 109-117. DOI: 10.1007/ s00113-011-2060-4.
24. Paessler H.H., Mastrokalos D.S. Anterior cruciate ligament reconstruction using semitendinosus and gracilis tendons, bone patellar tendon, or quadriceps tendon-graft with press-fit fixation without hardware. A new and innovative procedure. Orthop. Clin. North Am. 2003; 34(1): 49-64. PMID: 12735201.
25. Demirag B., Sarisozen B., Ozer O., et al. Enhancement of tendon-bone healing of anterior cruciate ligament grafts by blockage of matrix metalloproteinases. J. Bone Joint Surg. Am. 2005; 87(11): 2401-2410. DOI: 10.2106/JBJS.D.01952.
26. Chang C.H., Chen C.H., Liu H.W., et al. Bioengineered periosteal progenitor cell sheets to enhance tendon-bone healing in a bone tunnel. Biomed. J. 2012; 35(6): 473-480. DOI: 10.4103/2319-4170.104412.
27. Mifune Y., Matsumoto T., Ota S., et al. Therapeutic potential of anterior cruciate ligament-derived stem cells for anterior cruciate ligament reconstruction. Cell. Transplant. 2012; 21(8): 1651-1665. DOI: 10.3727 /096368912X647234.
14. Siebold R., Kiss Z.S., Morris H.G. Effect of compaction drilling during ACL reconstruction with hamstrings on postoperative tunnel widening. Arch Orthop Trauma Surg. 2008; 128(5): 461-468. PMID: 17899135.
15. Giron F., Aglietti P., Cuomo P., et al. Anterior cruciate ligament reconstruction with double-looped semitendinosus and gracilis tendon graft directly fixed to cortical bone: 5-year results. Knee Surg Sports Traumatol Arthrosc. 2005: 13(2): 81-91. DOI: 10.1007/s00167-004-0553-1.
16. Xu Y., Ao Y., Wang J., et al. Relation of tunnel enlargement and tunnel placement after single-bundle anterior cruciate ligament reconstruction. Arthroscopy. 2011: 27 (7): 923-932. DOI: 10.1016/ j.arthro.2011.02.020.
17. Buelow J.U., Siebold R., Ellermann A. A prospective evaluation of tunnel enlargement in anterior cruciate ligament reconstruction with hamstrings: extracortical versus anatomical fixation. Knee Surg Sports Traumatol Arthrosc. 2002; 10(2): 80-85. DOI: 10.1007/s00167-001-0267-6.
18. Iorio R., Vadalà A., Di Vavo I., et al. Tunnel enlargement after anterior cruciate ligament reconstruction in patients with post-operative septic arthritis. Knee Surg Sports Traumatol Arthrosc. 2008: 16(10): 921-927. DOI: 10.1007/s00167-008-0575-1.
19. Yu J.K., Paessler H.H. Relationship between tunnel widening and different rehabilitation procedures after anterior cruciate ligament reconstruction with quadrupled hamstring tendons. Chin Med J (Engl). 2005; 118(4): 320-326. PMID: 15740671.
20. Hantes M.E., Mastrokalos D.S., Yu J., Paessler H.H. The effect of early motion on tibial tunnel widening after anterior cruciate ligament replacement using hamstring tendon grafts. Arthroscopy. 2004; 20(6): 572-580. PMID: 15241306.
21. Vadalà A., Iorio R., De Carli A., et al. The effect of accelerated, brace free, rehabilitation on bone tunnel enlargement after ACL reconstruction using hamstring tendons: a CT study. Knee Surg Sports Traumatol Arthrosc. 2007; 15(4): 365-371. DOI: 10.1007/s00167-006-0219-2.
22. Ahn J.H., Wang J.H., Lee Y.S., et al. Anterior cruciate ligament reconstruction using remnant preservation and a femoral tensioning technique: clinical and magnetic resonance imaging results. Arthroscopy. 2011; 27(8): 1079-1089. DOI: 10.1016/j.arthro.2011.03.002.
23. Geiges B., von Falck C., Knobloch K., et al. Biodegradable screw versus a press-fit bone plug fixation for ACL reconstruction: a prospective randomized study. Unfallchirurg. 2013; 116(2): 109-117. DOI: 10.1007/ s00113-011-2060-4.
24. Paessler H.H., MastrokalosD.S.Anterior cruciate ligament reconstruction using semitendinosus and gracilis tendons, bone patellar tendon, or quadriceps tendon-graft with press-fit fixation without hardware. A new and innovative procedure. Orthop Clin North Am. 2003; 34(1): 49-64. PMID: 12735201.
25. Demirag B., Sarisozen B., Ozer O., et al. Enhancement of tendon-bone healing of anterior cruciate ligament grafts by blockage of matrix metalloproteinases. J Bone Joint Surg Am. 2005; 87(11): 2401-2410. DOI: 10.2106/JBJS.D.01952.
26. Chang C.H., Chen C.H., Liu H.W., et al. Bioengineered periosteal progenitor cell sheets to enhance tendon-bone healing in a bone tunnel. Biomed J. 2012; 35(6): 473-480. DOI: 10.4103/2319-4170.104412.
27. Mifune Y., Matsumoto T., Ota S., et al. Therapeutic potential of anterior cruciate ligament-derived stem cells for anterior cruciate ligament reconstruction. Cell Transplant. 2012; 21(8): 1651-1665. DOI: 10.3727/ 096368912X647234.
Received on 02.03.2017 Поступила 02.03.2017
BONE TuNNEL wIDENING AFTER ANTERIOR CRuCIATE LIGAMENT AuTOPLASTY wITH HAMSTRINGS (LITERATuRE REVIEw) V.V. Slastinin*, A.M. Fain, A.Y. Vaza
N.V. Sklifosovsky research Institute for Emergency Medicine of the Moscow Healthcare Department, Moscow, Russian Federation
* Contacts: Vladimir Victorovich Slastinin, Junior Researcher of the Department for Emergency Traumatology of Musculoskeletal System, N.V. Sklifosovsky Research Institute for Emergency Medicine of the Moscow Healthcare Department. E-mail: [email protected]
abstract Such a phenomenon as bone tunnel widening after anterior cruciate ligament autoplasty with hamstrings has been known for 30 years. Despite the long history of this issue, the etiology is still not fully understood. The process of expansion of the bone tunnels is influenced by many factors such as graft fixation technique, surgical technique and rehabilitation protocol, as well as various biological factors. It is believed that this phenomenon has no influence on a functional result, but may create serious problems in revision anterior cruciate ligament surgery. Given the growing interest in the use of hamstring tendon grafts for anterior cruciate ligament reconstruction, increasing number of these operations and as a result, of revision procedures, the search for methods of bone tunnel widening prevention is becoming more urgent.
Keywords bone tunnel widening, anterior cruciate ligament reconstruction, complications
For citation Slastinin V.V, Fain A.M., Vaza A.Y. Bone tunnel widening after anterior cruciate ligament autoplasty with hamstrings (literature review). Sklifosovsky Journal of Emergency Medical Care. 2017; 6(3): 233-237. DOI: 10.23934/2223-9022-2017-6-3-233-237 (In Russian) Conflict of intere; Authors declare lack of the conflicts of interests Acknowledgment The study had no sponsorship
cyberleninka.ru
Анатомические варианты строения сухожилия полусухожильной мышцы
АНАТОМИЧЕСКИЕ ВАРИАНТЫ СТРОЕНИЯ СУХОЖИЛИЯ ПОЛУСУХОЖИЛЬНОЙ МЫШЦЫ – ТРАНСПЛАНТАТА, ИСПОЛЬЗУЕМОГО ПРИ АРТРОСКОПИЧЕСКОЙ АУТОПЛАСТИКЕ ПЕРЕДНЕЙ КРЕСТООБРАЗНОЙ СВЯЗКИ КОЛЕННОГО СУСТАВА
И.А. Кузнецов, A.B. Рыбин
ФГУ «Российский научно-исследовательский институт травматологии и ортопедии им. Р. Р. Вредена Федерального агентства по здравоохранению и социальному развитию», директор – д.м.н. профессор Р.М. Тихилов Санкт-Петербург
Повреждения капсуло-связочного аппарата в структуре травматической патологии коленного сустава занимают второе место по частоте после патологии менисков (до 52%). Среди изолированных травм связочных структур первое место занимают повреждения передней крестообразной связки (ПКС) (33%-92%) [1-4].
Возникающая нестабильность приводит к перенапряжению анатомических структур коленного сустава, нарушению биомеханики, конгруэнтности суставных поверхностей, что, в свою очередь, ведет к развитию хронических дегенеративно-дистрофических процессов с вовлечением первоначально неизмененных элементов сустава с достаточно быстрым исходом в артроз, который приводит к ограничению физической активности, снижению трудоспособности и, в конечном итоге, – инвалидности. Проблема диагностики и лечения посттравматической нестабильности коленного сустава, обусловленной повреждением ПКС, актуальна в медицинском и социальном планах [9]. Ее решение возможно только с помощью комплекса мероприятий, основу которых составляют своевременная и точная диагностика, индивидуальный выбор тактики лечения, минимальная трав-матичность оперативного вмешательства, рациональная реабилитация.
В настоящее время для лечения изолированных разрывов ПКС наиболее эффективной является артроскопическая пластика с применением свободных аутотрансплантатов [5, 9].
Основным преимуществом аутопластики является наилучшая и наиболее быстрая биологическая инкорпорация и ремоделирование трансплантата, а также отсутствие реакций биологической и иммунологической несовместимости.
Если в середине 80-х годов применение трансплантата из средней трети связки надколенника считалось «золотым стандартом» и использовалось практически в 90% реконструкций ПКС, то в 1992 году, по данным Американской ортопедической ассоциации спортивной медицины и Арт-роскопической ассоциации Северной Америки, сухожилия полусухожильной и нежной мышц
использовались в 40% случаев, а в настоящее время – в 60% и более [12].
При использовании подобной техники имеется возможность реконструкции пучкового строения ПКС, что важно для восстановления адекватной стабильности коленного сустава. Возросший интерес к использованию сухожилий гусиной лапки связан также с возможностью увеличения поперечного сечения трансплантата, а, следовательно, и его прочности, которая может вдвое превысить этот показатель у нативной ПКС методом удвоения, утроения или счетверения [7]. Подобный трансплантат также обладает жесткостью, приближенной к нормальной ПКС, и хорошей биологической приживляемостью вследствие большой площади поверхности для реваскуляризации и хорошей адаптируемости [9].
Среди преимуществ такого вида пластики перед оперативным вмешательством с использованием трансплантата из средней трети собственной связки надколенника с костными блоками также можно отметить малотравматичность при заборе трансплантата, отсутствие повреждения разгиба-тельного аппарата голени, отсутствие «болезней донорского места» и мышечной недостаточности, хороший косметический результат операции.
Однако если в современной литературе досконально описаны особенности оперативной техники в разных вариантах и применение различного рода фиксаторов, то вопросы предоперационного планирования и забора трансплантата как этапа операции, а также возможные при этом осложнения освещены недостаточно, что и послужило основанием для выполнения данной научно-исследовательской работы.
С 1999 г. в РНИИТО им. P.P. Вредена на отделении эндоскопической хирургии суставов при изолированных повреждениях ПКС применяется методика артроскопической аутопластики с использованием в качестве свободного трансплантата счетверенного сухожилия полусухожильной мышцы. При использовании подобной техники имеется возможность реконструкции пучкового строения ПКС, что важно для восста-
новления адекватной стабильности коленного сустава.
Важным этапом указанной операции является забор сухожильного трансплантата, который производится из небольшого доступа в верхней трети голени с использованием сухожильного стриппера, т.е. по сути «закрыто». С целью исключения повреждения трансплантата при его заборе требуется уточнение и подробное описание анатомии данной зоны с учетом вариабельности анатомического строения комплекса сухожилий «гусиной лапки» по данным литературы и собственным наблюдениям.
В экспериментальном исследовании на трупах нами была изучена анатомия комплекса сухожилий гусиной лапки, а также выявлены и описаны варианты прохождения сухожилия полусухожильной мышцы с учетом его связей с ближайшими анатомическими структурами. Для этого были исследованы 51 трупный коленный сустав (31 правых и 20 левых).
При послойной препаровке первым обнаруживалось сухожилие портняжной мышцы (первый слой), которое имеет ленточную форму, связано с собственной фасцией голени посредством сухожильных растяжений и прикрепляется с медиальной стороны гребня большеберцовой кости в среднем на 1,4 см (от 1,0 до 1,8 см) дистальнее верхушки бугристости. Второй слой образуют сухожилия тонкой и полусухожильной мышц, которые сливаются вместе вблизи места прикрепления. Точка бифуркации располагалась в среднем за 2,8 см (от 2,4 до 3,2 см) до места прикрепления, которое, в свою очередь, определялось дистальнее верхушки бугристости на 2,3 см (от 2,0 до 2,6 см). Дистальные части сухожилий тонкой и полусухожильной мышц имеют апоневротичес-кие мембраны, которые сливаются с собственной фасцией голени, а также фасцией, покрывающей медиальную головку икроножной мышцы. Однако, если сухожилие тонкой мышцы во всех случаях представлялось одинаково в виде отдельно идущего ствола, то сухожилие полусухожильной мышцы имело, по крайней мере, три типа строения. Данный факт являлся особенно важным для нас, так как именно это сухожилие мы применяем для аутопластики ПКС.
В 27 (53%) наблюдениях определялся тип, при котором от ствола сухожилия в составе апонев-ротической мембраны отходила одна, реже две сухожильные перемычки к фасциальному покрытию медиальной головки икроножной мышцы (рис. 1).
В отдельных случаях сухожильные перемычки по толщине были сопоставимы с основным стволом сухожилия. Отхождение перемычек имело место на расстоянии 7-10 см (наиболее
Рис. 1. Тип строения сухожильного ствола с отхож-дением перемычки.
часто – 9 см) от места прикрепления сухожилия. Реже (33,3%) наблюдалось равномерное утолщение апоневротической мембраны без выраженных перемычек. Такая мембрана начиналась от ствола сухожилия на 9-10 см прокси-мальнее места прикрепления и имела вид паруса, вплетаясь в собственную фасцию голени (рис. 2).
Рис. 2. Тип строения сухожильного ствола в виде «паруса».
Лишь в 13,7% случаев сухожилие полусухожильной мышцы шло в виде отдельного ствола, который принимал веерообразный вид за 4-5 см до места прикрепления (рис. 3).
Рис. 3. Сухожилие полусухожильной мышцы в виде отдельного ствола.
28
1(39) – 2006 ТРАВМАТОЛОГИЯ И ОРТОПЕДИЯ РОССИИ
Для хорошей визуализации использовался перевернутый Ь-образный доступ, который брал начало на 5 см дистальнее бугристости, следовал проксимально в проекции гребня большеберцо-вой кости до нижнего полюса надколенника, а затем менял направление кзади и проксимально в проекции медиального мыщелка большеберцо-вой кости.
Наиболее значимым осложнением при заборе сухожилия полусухожильной мышцы мы считаем преждевременную ампутацию сухожилия стриппером. Такое осложнение наиболее вероятно при первом типе анатомического строения с выраженными перемычками, когда рабочая часть стриппера, упираясь в точку отхождения перемычки, меняет направление и срезает основной ствол (рис. 4).
В таком случае длины сухожилия полусухожильной мышцы для формирования трансплантата становится недостаточно, при взятии еще и сухожилия тонкой мышцы увеличивается трав-
матичность операции.
Определение типа строения сухожилия полусухожильной мышцы возможно из операционной раны. Для этого хирург, прошив дистальный конец сухожилия и отделив его от места прикрепления, до начала работы стриппером должен пропаль-пировать ствол сухожилия полусухожильной мышцы, скользя пальцем по апоневротической мембране кзади и проксимально на 10 см. Сухожильные перемычки пальпируются в виде валиков, отходящих от основного ствола. При втором типе апо-невротическая мембрана равномерно утолщена. Выделенные типы строения сухожилия полусухожильной мышцы определяют технику взятия трансплантата. Так, при первом типе строения для высвобождения сухожилия до заготовки с помощью сухожильного стриппера обязательно требуется тупое или острое рассечение перемычек. При втором типе строения данное осложнение маловероятно, а при третьем – невозможно.
Рис. 4. Преждевременная ампутация ствола сухожилия при работе с сухожильным стриппером: а — рабочая часть инструмента в месте отхождения перемыгчки; б — ампутация сухожильного ствола.
Литература
1. Кузнецов И.А. Артроскопическая хирургия коленного сустава. Итоги 15 лет: Актовая речь / И.А. Кузнецов. – СПб.: б.и., 2000. – 41 с.
2. Миронов С.П. Повреждение связок коленного сустава / С.П. Миронов, З.С. Миронова // Вестник травматологии и ортопедии им. Приорова. — 1999.
— №2. — С. 51—55.
3. Трачук А.П. Реконструкция передней крестообразной связки с использованием артроскопии / А.П. Трачук, Р.М. Тихилов // I Конгресс Российского артроскопического общества: Сборник материалов.
— М., 1996. — С. 46.
4. Alm A. Old injuries of the ligament of the knee joint / A. Alm // Acta Chir. Scand. — 1974. — Vol. 140. — P. 283 — 286.
5. Brand J.Jr. Graft fixation in cruciate ligament reconstruction / J.Jr. Brand, A. Weiler, D.N.M. Caborn et al. // Am. J. Sports Med. — 2000. — Vol. 28, N 5.
— Р. 761 — 774.
6. Ferrari J.D. The semitendinosus: Anatomic consideration in tendon harvesting / J.D. Ferrari, D.A. Ferrari // Orthop. Rev. — 1991. — Vol. 20. — P. 1085—1088.
7. Hamner D.L. Hamstring tendon grafts for reconstruction of the anterior cruciate ligament: Biomechanical evaluation of the use of multiple strands and tensioning techniques / D.L. Hamner, C.H.Jr. Brown, M.E. Steiner
// J. Bone Joint Surg. – 1999. – Vol. 81-A. – P. 549-557.
8. Ivey M. Anatomic variations of the pes anserinus: A cadaver study / M. Ivey, J. Prud’homme // Orthopaedics. – 1993. – Vol. 16. – P. 601-606.
9. Noyes F.R. The symptomatic anterior cruciate deficient knee / F.R. Noyes, D.S. Matthews, P.A. Mooar // J. Bone Joint Surg. – 1983. – Vol. 65-A. – P. 154-174.
10. Noyes F.R. Biomechanical analysis of human ligament grafts used in knee-ligament repairs and reconstructions / F.R. Noyes, D.L. Butler, E.S. Grood // J. Bone Joint Surg. – 1984. – Vol. 66-A. – P. 344-352.
11. Pagnani M.J. Anatomic considerations in harvesting the semitendinosus and gracilis tendons and a technique of harvest / M.J. Pagnani, J.J.P. Warner, S.J. O’Brien et al.// Am. J. Sports Med. – 1993. -Vol. 21. – P. 565-571.
12. Shino K. Reconstruction of the anterior cruciate ligament using allogeneic tendon: long-term follow-up / K. Shino, M. Inoue, S. Horibe et al. // Am. J. Sports Med. – 1990. – Vol. 18 – P. 457-465.
13. Tillett E. Localization of the semitendinosus-gracilis tendon bifurcation point relative to the tibial tuberosity: An aid to Hamstring tendon harvest / E. Tillett, R. Madsen, R. Rogers, J. Nyland // Arthroscopy. – 2004. – Vol. 20, N 1. – P. 51-54.
cyberleninka.ru

