Аномалия киммерле с1 шейного отдела лечение: симптомы и лечение в СПБ, отзывы и цены
симптомы и лечение в СПБ, отзывы и цены
Аномалия Киммерли – врожденная патология строения зоны сочленения черепа с первым шейным позвонком, когда в структуре позвонка есть дополнительная костная дужка, ограничивающая движения позвоночной артерии и сдавливающая ее. Это сказывается на кровообращении головного мозга и способствует развитию ишемии в задних его отделах.
Причинами развития патологии (а она возникает еще в утробе матери) считают:
- генетическую предрасположенность;
- нездоровый образ жизни родителей;
- плохую экологию и т.д.
Симптомы
О наличии аномалии Киммерли могут говорить такие признаки:
- внезапное потемнение и «фейерверки» в глазах;
- мигрени, при которых боль обычно концентрируется в затылочной части;
- тремор рук;
- проблемы с координацией;
- частые головокружения и неустойчивая походка, возникающие после резкого поворота головы;
- обмороки;
- шум и звон в ушах.

Такие признаки, впрочем, могут говорить о многих других болезнях, но оставлять проявления нездоровья без внимания нельзя в любом случае. Сама патология не угрожает жизни человека, но если аномалию Киммерли не лечить, возможны серьезные осложнения. И прежде всего – ишемический инсульт, который может повлечь за собой инвалидность и даже смерть.
Диагностика и лечение
Поставить диагноз можно только на основании целого ряда исследований:
- электроэнцефалограммы;
- дуплексного сканирования сосудов шеи и головы;
- ультразвукового исследования шейного отдела позвоночника и др.
Также нужно посетить отоларинголога, чтобы удостовериться в отсутствии проблем с органами слуха.
Лечение направлено на то, чтобы улучшить самочувствие пациента и минимизировать проявления аномалии. Обычно назначаются препараты для активизации мозгового кровообращения и реологических свойств крови. Также в списке лекарств могут быть антиоксиданты, ноотропы, метаболические препараты, нейропротекторы – список медикаментов подбирается сугубо индивидуально.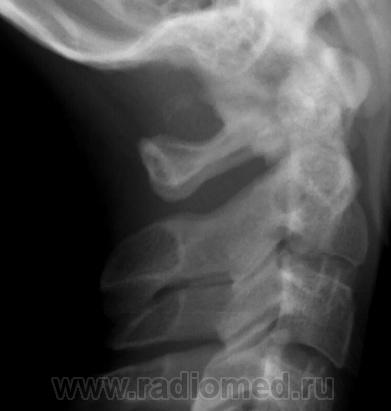
Помимо этого, рекомендована физиотерапия, в частности, массаж. Но иногда единственной возможностью помочь пациенту становится операция – дужку в позвонке удаляют хирургически.
Обязательное наблюдение невролога
Если у человека выявлена аномалия Киммерли, но она не проявляется, ему в любом случае рекомендуется наблюдаться у невролога. Врач расскажет, как поддерживать хороший кровоток мозга и избежать неприятных проявлений этой анатомической особенности в будущем.
Почему Вам нужна клиника «Долголетие»
Обращаясь к нам, не сомневайтесь, что с Вами будут работать отличные неврологи, врачи высшей категории. Лечение в клинике «Долголетие» имеет целый ряд преимуществ:
- методы лечения – эффективные, современные, признанные в мировой практике;
- медикаменты – качественные, безопасные, прошедшие всестороннее тестирование;
- результат – стабильный и устойчивый.
Мы работаем без выходных и праздников, поэтому для встречи с врачом и прохождения исследований можно подобрать максимально удобный для пациента день.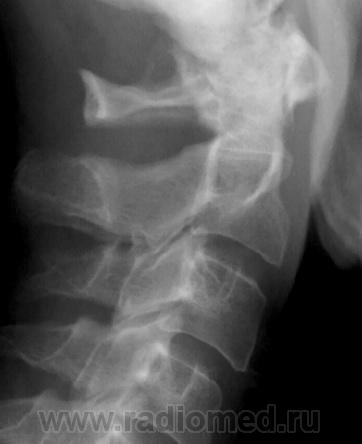 Персонал клиники позаботится о том, чтобы процесс лечения проходил максимально гладко, спокойно и позитивно.
Персонал клиники позаботится о том, чтобы процесс лечения проходил максимально гладко, спокойно и позитивно.
Клиника «Долголетие» вернет Вам радость здоровой жизни!
Запись на прием осуществляется по телефону: +7 (812) 671-01-70.
Аномалия Киммерле
Над созданием работали:
Начальник ФКУЗ «Центральная поликлиника № 2 МВД России»
подполковник внутренней службы, кандидат медицинских наук В.Е. Милов
Заместитель начальника по медицинской части ФКУЗ «ЦП № 2 МВД России»
полковник внутренней службы Е.В. Максимова
Начальник неврологического отделения ФКУЗ «Центральная поликлиника № 2 МВД России», кандидат медицинских наук Ю.О. Камаев
Врач-невролог неврологического отделения ФКУЗ «Центральная поликлиника № 2 МВД России» Пачина Н.Н.
Врач-рентгенолог кабинета МРТ отделения лучевой диагностики ФКУЗ «Центральная поликлиника № 2 МВД России» Волкова А.А.
Аномалия Киммерле ( Ponticulus posticus) – это патологическое изменение атланта (первого шейного позвонка), выражающуюся в формировании дополнительного костного «мостика» костной дуги (стрелка на рис.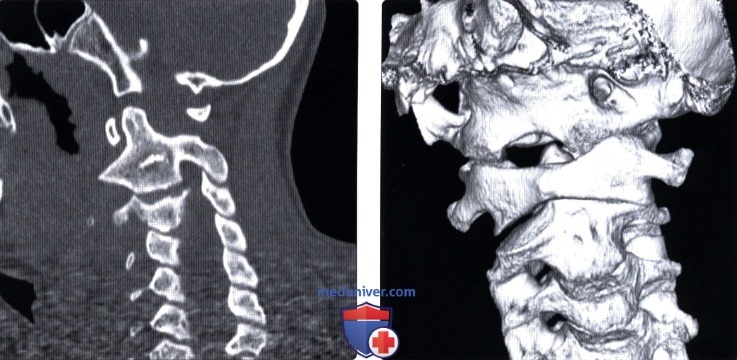 1 указывает на патологию, на противоположной стороне костный «мостик» отсутствует).
1 указывает на патологию, на противоположной стороне костный «мостик» отсутствует).
рис.1
Среди обследуемых пациентов аномалия Киммерле встречается в 12 – 30% случаев, наиболее часто патология выявляется у женщин.
Заболевание можно условно разделить по типу происхождения:
- Врожденная аномалия Киммерле – вариант патологии внутриутробного развития.
- Приобретенная аномалия Киммерле – развивается по механизму дегенеративно-дистрофических изменений.
Также условно можно разделить по типу рентгенологической картины:
Полная аномалия Киммерле – имеется костная дужка в виде полукольца и атлантозатылочная латеральная связка, которая постепенно окостеневает (рис. 2). Такой вариант наиболее часто может давать клиническую симптоматику.
Рис. 2
Неполная аномалия Киммерле – Диагностируется только дополнительная костная дужка, которая представляет собой дугообразный вырост (рис.3) и как правило не проявляет себя клинически.
рис.3
Какие могут быть симптомы при аномалии Киммерле?
1) Наиболее часто Аномалия Киммерле характеризуется:
- Спонтанным головокружением, которое усиливается при наклоне или разгибании головы;
- Головной болью в области затылка;
- Болью в шее и спазмом мышц шеи;
- Шумом в ушах;
- Шаткостью походки и расстройством координации;
2) Реже встречаются следующие симптомы:
- Ощущение «мушек» и эпизоды потемнения в глазах;
- Внезапное развитие чувства «прилива жара» к голове или шее, сопровождающееся немотивированным страхом, тревогой;
- Ощущение «волоска» на языке;
- Приступы потери сознания и внезапной мышечной слабости
3) Крайне редко возникают:
- двигательные и чувствительные расстройства;
Наличие аномалии Киммерле не говорит о том, что именно она неизбежно вызывает вышеперечисленные симптомы, более того нет достоверной информации о связи, что аномалия Киммерле может провоцировать сосудистые нарушения в бассейне позвоночной артерии.
Диагностика:
Диагностируется аномалия Киммерле, как правило по сценарию случайной находки. Аномалия Киммерле хорошо визуализируется при рентгенографическом исследовании шейного отдела позвоночника. Так же информативным методом является компьютерная томография – она лучше показывает костные ткани основания черепа и верхние шейные позвонки (атлант и аксис).
Рис. 4. 3D реконструкция шейного отдела позвоночника – костный канал для позвоночной артерии замкнут полностью (Полная аномалия Киммерле).
Рис. 5. 3D реконструкция шейного отдела позвоночника – костный канал для позвоночной артерии замкнут частичное (Частичная аномалия Киммерле).
По усмотрению лечащего врача может быть дополнительно назначено проведение магнитно-резонансной ангиографии, дуплексного сканирования и УЗДГ сосудов головы и шеи.
Лечение:
Поскольку сама аномалия Киммерле представляет собой костное разрастание на дужке атланта, принципы консервативной терапии исходят исключительно из позиций симптоматической терапии, в редких случаях выполняется хирургическое вмешательство, направленное на устранение костного «мостика» и при необходимости, выполняется пластика сосуда.
Аномалия Киммерли
Аномалия Киммерли – это патологическое изменение атланта, первого шейного позвонка. Заболевание наиболее распространенно как врожденный порок развития, встречается также аномалия Киммерли в форме заболевания, приобретенного в течение жизни. Аномалия Киммерли — наличие в структуре первого шейного позвонка дополнительной костной дужки, ограничивающей движения позвоночной артерии и вызывающей синдром ее сдавления.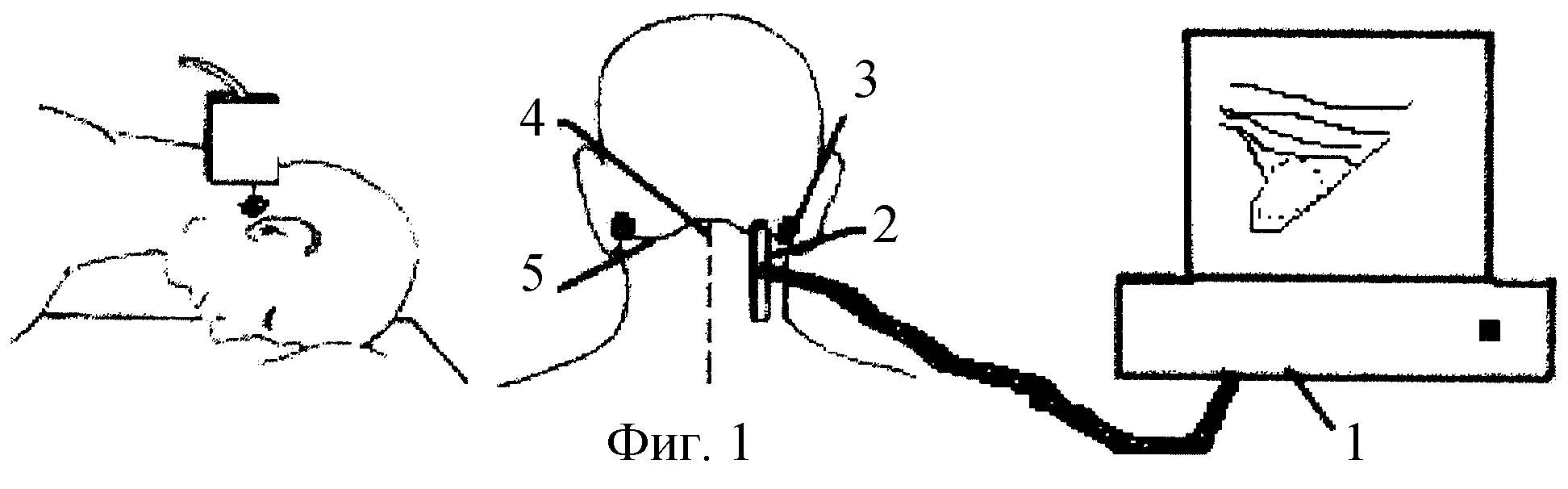
 Однако такая ситуация возникает далеко не всегда. Сама по себе аномалия Киммерли не является заболеванием , и ее наличие не говорит о том, что именно она вызывает сосудистые нарушения в бассейне позвоночной артерии. При обследовании пациентов, у которых имеется синдром позвоночной артерии и аномалия Киммерли, лишь у 25% обнаруживается причинно-следственная связь между наличием аномалии и развитием синдрома. Патогенез сосудистых нарушений при аномалии Киммерли Правая и левая позвоночные артерии отходят от соответствующих подключичных артерий. Каждая позвоночная артерия проходит вдоль шейного отдела позвоночника, находясь в канале, образованном отверстиями поперечных отростков его позвонков. Затем она входит в большое затылочное отверстие, попадая таким образом в полость черепа. Позвоночные артерии и их ветви образуют так называемый вертебрально-базилярный бассейн, кровоснабжающий часть спинного мозга в шейном отделе позвоночника, мозжечок и ствол мозга. Выходя из шейного канала, позвоночная артерия огибает шейный позвонок и горизонтально проходит в широкой костной борозде, где она может свободно перемещаться при движениях головы.
Однако такая ситуация возникает далеко не всегда. Сама по себе аномалия Киммерли не является заболеванием , и ее наличие не говорит о том, что именно она вызывает сосудистые нарушения в бассейне позвоночной артерии. При обследовании пациентов, у которых имеется синдром позвоночной артерии и аномалия Киммерли, лишь у 25% обнаруживается причинно-следственная связь между наличием аномалии и развитием синдрома. Патогенез сосудистых нарушений при аномалии Киммерли Правая и левая позвоночные артерии отходят от соответствующих подключичных артерий. Каждая позвоночная артерия проходит вдоль шейного отдела позвоночника, находясь в канале, образованном отверстиями поперечных отростков его позвонков. Затем она входит в большое затылочное отверстие, попадая таким образом в полость черепа. Позвоночные артерии и их ветви образуют так называемый вертебрально-базилярный бассейн, кровоснабжающий часть спинного мозга в шейном отделе позвоночника, мозжечок и ствол мозга. Выходя из шейного канала, позвоночная артерия огибает шейный позвонок и горизонтально проходит в широкой костной борозде, где она может свободно перемещаться при движениях головы.
 Классификация аномалии Киммерли В неврологии выделяют 2 вида аномалии Киммерли. Первая характеризуется наличием костной дужки, соединяющей суставной отросток атланта с его задней дугой. Во втором варианте аномалия Киммерли представлена костной дужкой между суставным отростком атланта и его поперечным отростком. Аномалия Киммерли может иметь односторонний характер или наблюдаться с обоих сторон первого шейного позвонка. Кроме того, аномалия Киммерли может быть полной и неполной. Полная аномальная костная дужка имеет вид полукольца, неполная костная дужка представляет собой дугообразный вырост. Симптомы аномалии Киммерли Клинические проявления, которыми сопровождается аномалия Киммерли, обусловлены уменьшенным притоком крови к задним отделам головного мозга. В результате пациенты испытывают шум в ухе или обоих ушах (свист, звон, гул, шипение), мелькание «мушек» или мерцание «звездочек» перед глазами, внезапное преходящее потемнение в глазах. Указанные симптомы усиливаются при поворотах головы.
Классификация аномалии Киммерли В неврологии выделяют 2 вида аномалии Киммерли. Первая характеризуется наличием костной дужки, соединяющей суставной отросток атланта с его задней дугой. Во втором варианте аномалия Киммерли представлена костной дужкой между суставным отростком атланта и его поперечным отростком. Аномалия Киммерли может иметь односторонний характер или наблюдаться с обоих сторон первого шейного позвонка. Кроме того, аномалия Киммерли может быть полной и неполной. Полная аномальная костная дужка имеет вид полукольца, неполная костная дужка представляет собой дугообразный вырост. Симптомы аномалии Киммерли Клинические проявления, которыми сопровождается аномалия Киммерли, обусловлены уменьшенным притоком крови к задним отделам головного мозга. В результате пациенты испытывают шум в ухе или обоих ушах (свист, звон, гул, шипение), мелькание «мушек» или мерцание «звездочек» перед глазами, внезапное преходящее потемнение в глазах. Указанные симптомы усиливаются при поворотах головы. Поскольку аномалия Киммерли сопровождается нарушением кровоснабжения мозжечка, то возникают головокружение и шаткость походки, которые также могут усугубляться при поворотах головой. На фоне некомфортного положения головы или перенапряжения мышц шеи при аномалии Киммерли у пациентов могут наблюдаться приступы потери сознания. Возможна внезапно возникающая мышечная слабость, приводящая к падению больного без потери сознания. В случаях более тяжелого течения аномалия Киммерли может сопровождаться головной болью, тремором рук и ног, нистагмом, нарушениями координации, гипестезией и/или мышечной слабостью части лица или туловища, чувствительными и двигательными расстройствами одной или нескольких конечностей. Могут наблюдаться транзиторные ишемические атаки в вертебрально-базилярном бассейне. Особо тяжелым осложнением наличия аномалии Киммерли является ишемический инсульт. Диагностика аномалии Киммерли При обращении пациента с симптомами недостаточности кровообращения в вертебрально-базилярном бассейне головного мозга в первую очередь производят рентгенографию черепа и рентгенографию позвоночника в шейном отделе.
Поскольку аномалия Киммерли сопровождается нарушением кровоснабжения мозжечка, то возникают головокружение и шаткость походки, которые также могут усугубляться при поворотах головой. На фоне некомфортного положения головы или перенапряжения мышц шеи при аномалии Киммерли у пациентов могут наблюдаться приступы потери сознания. Возможна внезапно возникающая мышечная слабость, приводящая к падению больного без потери сознания. В случаях более тяжелого течения аномалия Киммерли может сопровождаться головной болью, тремором рук и ног, нистагмом, нарушениями координации, гипестезией и/или мышечной слабостью части лица или туловища, чувствительными и двигательными расстройствами одной или нескольких конечностей. Могут наблюдаться транзиторные ишемические атаки в вертебрально-базилярном бассейне. Особо тяжелым осложнением наличия аномалии Киммерли является ишемический инсульт. Диагностика аномалии Киммерли При обращении пациента с симптомами недостаточности кровообращения в вертебрально-базилярном бассейне головного мозга в первую очередь производят рентгенографию черепа и рентгенографию позвоночника в шейном отделе.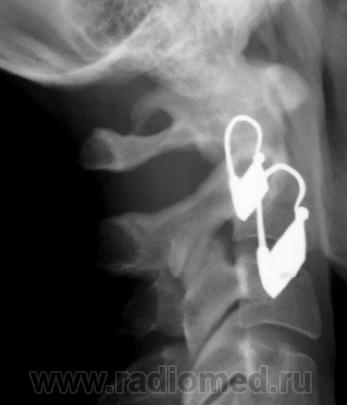 Аномалия Киммерли, как правило, достаточно четко визуализируется на боковых рентгенограммах области краниовертебрального перехода. При наличие ушного шума для исключения лор-патологии (кохлеарный неврит, хронический средний отит, лабиринтит) может потребоваться консультация отоларинголога, проведение аудиометрии и других исследований слуха. Производится также исследование вестибулярного анализатора (вестибулометрии, электронистагмографии, стабилографии). Поскольку выявленная аномалия Киммерли может не являться причиной синдрома позвоночной артерии, неврологу необходимо исключить другие возможные причины вертебрально-базилярной недостаточности. Выявить тромбоз, артерио-венозную мальформацию или аневризму сосудов головного мозга, сдавление сосуда объемным образованием (опухоль, киста или абсцесс головного мозга) способна контрастная ангиография. Определить насколько клинически значима аномалия Киммерли, т. е. степень ее влияния на кровообращение в вертебрально-базилярном бассейне, позволяет применение целого ряда гемодинамических исследований: УЗДГ экстракраниальных сосудов, транскраниальной допплерографии, дуплексного сканирования и магнитно-резонансной ангиографии сосудов головного мозга.
Аномалия Киммерли, как правило, достаточно четко визуализируется на боковых рентгенограммах области краниовертебрального перехода. При наличие ушного шума для исключения лор-патологии (кохлеарный неврит, хронический средний отит, лабиринтит) может потребоваться консультация отоларинголога, проведение аудиометрии и других исследований слуха. Производится также исследование вестибулярного анализатора (вестибулометрии, электронистагмографии, стабилографии). Поскольку выявленная аномалия Киммерли может не являться причиной синдрома позвоночной артерии, неврологу необходимо исключить другие возможные причины вертебрально-базилярной недостаточности. Выявить тромбоз, артерио-венозную мальформацию или аневризму сосудов головного мозга, сдавление сосуда объемным образованием (опухоль, киста или абсцесс головного мозга) способна контрастная ангиография. Определить насколько клинически значима аномалия Киммерли, т. е. степень ее влияния на кровообращение в вертебрально-базилярном бассейне, позволяет применение целого ряда гемодинамических исследований: УЗДГ экстракраниальных сосудов, транскраниальной допплерографии, дуплексного сканирования и магнитно-резонансной ангиографии сосудов головного мозга. С их помощью при аномалии Кимерли возможно выявить локализацию сдавления позвоночной артерии и ее зависимость от положения головы и шеи. Лечение аномалии Киммерли Аномалия Киммерли требует лечения в случае наличия клинических и гемодинамических признаков нарушения кровообращения в вертебрально-базилярном бассейне, связанного именно с данной патологией. Пациенты, у которых имеется аномалия Киммерли, должны соблюдать некоторые меры предосторожности в рамках охранительного режима. При аномалии Киммерли следует избегать форсированных физических нагрузок, резких поворотов головой, стоек на голове, кувырков, спортивных занятий и игр, связанных с ударами головой (борьба, футбол, спортивная гимнастика и пр.). При прохождении массажа или мануальной терапии шейного отдела позвоночника пациенту необходимо предупреждать массажиста и мануального терапевта о том, что у него аномалия Киммерли. Ухудшение состояния пациента является поводом к незамедлительному обращению к врачу. В большинстве случаев аномалия Киммерли, приводящая к клиническим проявлениям сосудистой недостаточности, подлежит консервативному лечению.
С их помощью при аномалии Кимерли возможно выявить локализацию сдавления позвоночной артерии и ее зависимость от положения головы и шеи. Лечение аномалии Киммерли Аномалия Киммерли требует лечения в случае наличия клинических и гемодинамических признаков нарушения кровообращения в вертебрально-базилярном бассейне, связанного именно с данной патологией. Пациенты, у которых имеется аномалия Киммерли, должны соблюдать некоторые меры предосторожности в рамках охранительного режима. При аномалии Киммерли следует избегать форсированных физических нагрузок, резких поворотов головой, стоек на голове, кувырков, спортивных занятий и игр, связанных с ударами головой (борьба, футбол, спортивная гимнастика и пр.). При прохождении массажа или мануальной терапии шейного отдела позвоночника пациенту необходимо предупреждать массажиста и мануального терапевта о том, что у него аномалия Киммерли. Ухудшение состояния пациента является поводом к незамедлительному обращению к врачу. В большинстве случаев аномалия Киммерли, приводящая к клиническим проявлениям сосудистой недостаточности, подлежит консервативному лечению. Проводится сосудистая терапия направленная на улучшение мозгового кровотока. По показаниям под контролем коагулограммы при аномалии Кимерли применяются препараты, улучшающие реалогические свойства крови. В комплексную терапию включают также антиоксиданты, ноотропы, нейропротекторы и метаболические препараты. Аномалия Киммерли на сегодняшний день не является показанием для проведения хирургического лечения. Необходимость в оперативном лечении может возникнуть при декомпенсированном течении синдрома позвоночной артерии, приводящем к выраженной недостаточности кровообращения в вертебрально-базилярном бассейне при отсутствии достаточного коллатерального кровоснабжения. Операция при аномалии Киммерли заключается в резекции аномальной дуги и мобилизации позвоночной артерии. В послеоперационном периоде пациентам необходимо ношение воротника Шанца сроком от 2 до 4 недель.
Проводится сосудистая терапия направленная на улучшение мозгового кровотока. По показаниям под контролем коагулограммы при аномалии Кимерли применяются препараты, улучшающие реалогические свойства крови. В комплексную терапию включают также антиоксиданты, ноотропы, нейропротекторы и метаболические препараты. Аномалия Киммерли на сегодняшний день не является показанием для проведения хирургического лечения. Необходимость в оперативном лечении может возникнуть при декомпенсированном течении синдрома позвоночной артерии, приводящем к выраженной недостаточности кровообращения в вертебрально-базилярном бассейне при отсутствии достаточного коллатерального кровоснабжения. Операция при аномалии Киммерли заключается в резекции аномальной дуги и мобилизации позвоночной артерии. В послеоперационном периоде пациентам необходимо ношение воротника Шанца сроком от 2 до 4 недель.Лечение Киммерли
Аномалия Киммерле или костный мостик атланта приводит к ограничению подвижности позвоночной артерии при разгибании шейного отдела позвоночника, поворотах головы. Это может привести к сдавлению либо ирритации периартериального нервного сплетения с соответствующими клиническими проявлениями
Это может привести к сдавлению либо ирритации периартериального нервного сплетения с соответствующими клиническими проявлениями
– консервативно-терапевтическое лечение;
– хирургическое устранение костного мостика.
Выбор тактики лечения клинических проявлений АК базировался на патогенетическом принципе, потому что этиологическое лечение требует проведения оперативного вмешательства не только на самом костном образовании кольца атланта, но и проведения реконструктивной ангиопластики позвоночной артерии, что не всегда целесообразно на ранних стадиях заболевания, представляющих большинство клинических случаев. Поэтому предпочтение в выборе схемы лечения было отдано терапевтическим методам. Основная патогенетическая модель базировалась на принципах «порочного круга», в основе которого находится раздражение затылочного нерва, приводящее к возникновению болевого синдрома и защитного напряжения мышц шеи и скальпа. В свою очередь, формирующаяся миотония приводит к нарушению нормальных биомеханических соотношений, что вызывает еще большее раздражение затылочного нерва и соответствующую прогрессию боли с присоединением вегетативных нарушений из-за раздражения нерва Франка и сопровождающих позвоночную артерию сплетений, а также синдромов недостаточности кровоснабжения ВБС на более поздних этапах.
В свою очередь, формирующаяся миотония приводит к нарушению нормальных биомеханических соотношений, что вызывает еще большее раздражение затылочного нерва и соответствующую прогрессию боли с присоединением вегетативных нарушений из-за раздражения нерва Франка и сопровождающих позвоночную артерию сплетений, а также синдромов недостаточности кровоснабжения ВБС на более поздних этапах.
В основу терапевтического воздействия на данную патогенетическую модель были положены методы, позволяющие купировать болевой синдром, редуцировать миотонические симптомы и улучшить трофику сосудистых и нервных структур. В качестве базовых медикаментозных средств использовались нестероидные противовоспалительные препараты быстрого действия (лорноксикам), миорелаксанты периферического действия (толперизон), комплексные витамино-содержащие препараты трофического и анаболического действия. Дополнительно в курс лечения включались лечебная физкультура, массаж. Лорноксикам, назначаемый для купирования болевого синдрома, был эффективен у всех пациентов.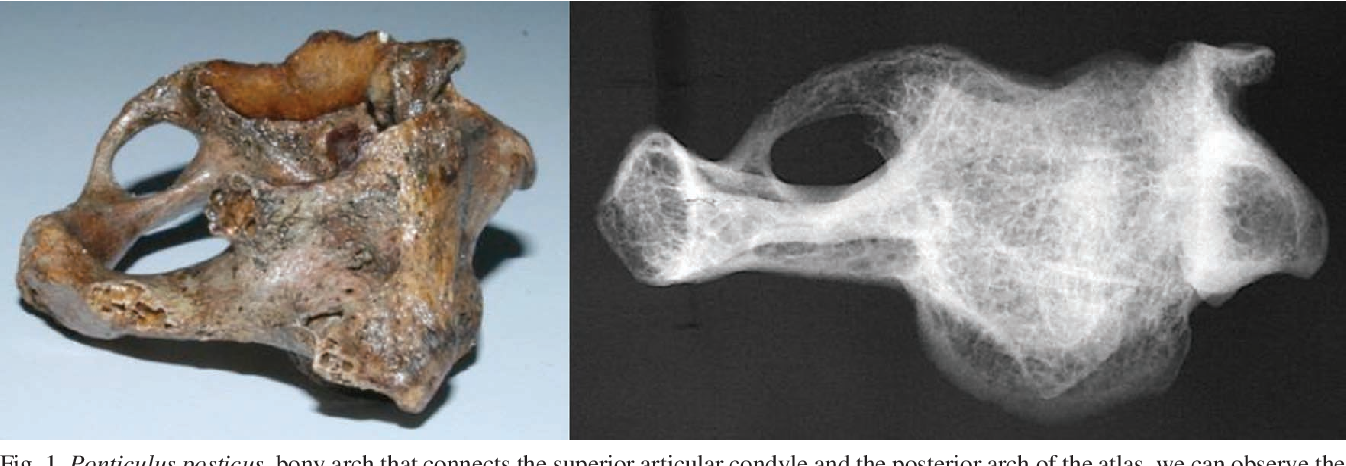 Кардиальные дисфункции, нарушения функций ЖКТ преобладали у пациентов старшей возрастной группы. Таким образом, исходя из полученных данных, НПВП лорноксикам показал себя как высокоэффективное обезболивающее средство у пациентов всех возрастных групп, однако из-за быстрого развития побочных эффектов препарат лучше назначать однократно для экстренного купирования болевого синдрома.
Кардиальные дисфункции, нарушения функций ЖКТ преобладали у пациентов старшей возрастной группы. Таким образом, исходя из полученных данных, НПВП лорноксикам показал себя как высокоэффективное обезболивающее средство у пациентов всех возрастных групп, однако из-за быстрого развития побочных эффектов препарат лучше назначать однократно для экстренного купирования болевого синдрома.
В большинстве случаев аномалия Кимерли, приводящая к клиническим проявлениям сосудистой недостаточности, подлежит консервативному лечению. Проводится сосудистая терапия направленная на улучшение мозгового кровотока (ницерголин, винпоцетин, винкамин, циннаризин). По показаниям под контролем коагулограммы при аномалии Киммерли применяются препараты, улучшающие реалогические свойства крови (пентоксифиллин). В комплексную терапию включают также антиоксиданты, ноотропы, нейропротекторы и метаболические препараты (пирацетам, никотиноил-гамма-аминобутировая кислота, мельдоний).
Пациенты, у которых имеется аномалия Кимерли, должны соблюдать некоторые меры предосторожности в рамках охранительного режима.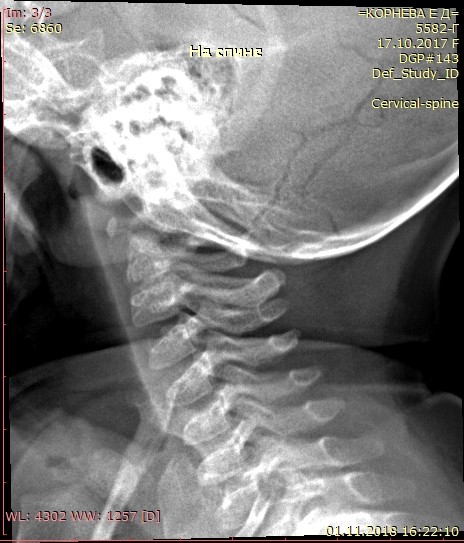 При аномалии Киммерли следует избегать форсированных физических нагрузок, резких околозапредельных поворотов головой, стоек на голове, кувырков, спортивных занятий и игр, связанных с ударами головой (борьба, футбол, спортивная гимнастика и пр.).
При аномалии Киммерли следует избегать форсированных физических нагрузок, резких околозапредельных поворотов головой, стоек на голове, кувырков, спортивных занятий и игр, связанных с ударами головой (борьба, футбол, спортивная гимнастика и пр.).
Обсуждение и выводы
Оссификация атлантоокципитальной связки представляет собой нередкий вариант аномалии строения КВО. Данная аномалия встречается практически во всех возрастных группах с максимальной представленностью в возрасте 25 лет и старше.
В клинической картине заболевания преобладают три основных синдрома:
– болевой синдром;
– синдром сосудистой недостаточности;
– синдром вегетативных дисфункций.
Тяжесть клинических проявлений соответствует трем степеням, отражающим разные типы течения, – легкой, среднетяжелой и тяжелой, характеризуется частотой обострений и зависит от выраженности анатомического дефекта. Тесное расположение различных элементов, а также сочетание разных патологических процессов, развивающихся в шейном отделе позвоночника, в большинстве случаев затрудняет активные хирургические вмешательства, что требует разработки консервативных методов лечения, направленных на купирование болевого синдрома, редуцирование миотонического напряжения мышц шеи и скальпа, а также активацию репаративных процессов в пораженной зоне. Использование обезболивающих препаратов группы оксикамов, в частности лорноксикама, высокоэффективно у пациентов с АК в качестве экстренной помощи при развитии болевого синдрома в однократном применении. При необходимости более длительного использования данного препарата необходимо проводить защитные меры по профилактике поражения структур ЖКТ. Также препарат следует назначать с осторожностью лицам старших возрастных групп из-за риска развития кардиальной патологии. Применение в схеме лечения препаратов миорелаксирующего и репаративного (витаминного) действия позволяет эффективно убрать основные клинические проявления АК и ввести заболевание в состояние ремиссии на период до 9 месяцев.
Тесное расположение различных элементов, а также сочетание разных патологических процессов, развивающихся в шейном отделе позвоночника, в большинстве случаев затрудняет активные хирургические вмешательства, что требует разработки консервативных методов лечения, направленных на купирование болевого синдрома, редуцирование миотонического напряжения мышц шеи и скальпа, а также активацию репаративных процессов в пораженной зоне. Использование обезболивающих препаратов группы оксикамов, в частности лорноксикама, высокоэффективно у пациентов с АК в качестве экстренной помощи при развитии болевого синдрома в однократном применении. При необходимости более длительного использования данного препарата необходимо проводить защитные меры по профилактике поражения структур ЖКТ. Также препарат следует назначать с осторожностью лицам старших возрастных групп из-за риска развития кардиальной патологии. Применение в схеме лечения препаратов миорелаксирующего и репаративного (витаминного) действия позволяет эффективно убрать основные клинические проявления АК и ввести заболевание в состояние ремиссии на период до 9 месяцев.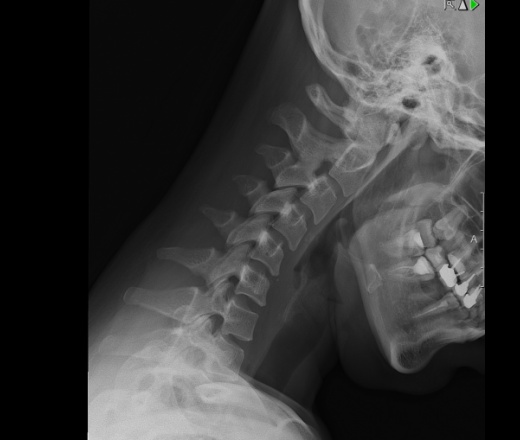
Как Вы поняли терапевтический метод дает пациенту временной облегчение и не устраняет саму причину.
Побочные эффекты, не стойкий клинический эффект, а также сложности курса консервативно-терапевтического лечения данной аномалии, побудили врачей нашей клиники разработать собственную методику по устранению костного мостика атланта (ponticulus posterior atlantis). Лечение состоит из нескольких курсов. В основе курса лежит физиотерапия на оборудовании компании BTL.
– первый курс направлен на снятие воспаления и остановку дегенеративных процессов КВО;
– второй курс направлен на размягчение костного мостика при помощи ударной волны и инъекций рассасывающих препаратов;
– третий курс направлен на закрепление результатов, в этом курсе мы увеличиваем дозировку физиотерапии и рассасывающих препаратов.
Физкультурно-лечебный комплекс от реабилитолога Казакевич В. В.
В.
Характеристика и лечение цефалгии у пациентов с аномалией Киммерле Текст научной статьи по специальности «Клиническая медицина»
Клиническая медицина УДК 009-7:616.711.1:616.832-001.35 ХАРАКТЕРИСТИКА И ЛЕЧЕНИЕ ЦЕФАЛГИИ У ПАЦИЕНТОВ С АНОМАЛИЕЙ КИММЕРЛЕ
© Комяхов А.В., Клочева Е.Г.
Кафедра неврологии, нейрохирургии и медицинской генетики Санкт-Петербургской государственной медицинской академии им. И.И. Мечникова,
Санкт-Петербург
E-mail: lavsky@list. ru
ru
Обследовано 150 пациентов с аномалией Киммерле в возрасте от 16 до 60 лет, средний возраст 33,1 ± 1,4 года, женщин – 83 (55,3%), мужчин – 67 (44,7%). Основной жалобой явилась головной боль, преимущественно сосудистого характера. Больным проводили комплексное лечение с использованием нестероидных противовоспалительных средств, вазоактивных препаратов и венотоников; применяли остеопатические методы. Использование комплексной терапии способствовало достоверному снижению интенсивности и купированию головной боли.
Ключевые слова: головная боль, аномалия Киммерле, остеопатическое лечение.
HEADACHE CHARACTERISTICS AND TREATMENT IN PATIENTS WITH KIMMERLE ANOMALY
Komyakhov A. V., Klocheva E. G.
Department of Neurology, Neurosurgery and Medical Genetics of Saint-Petersburg Medical State Academy
named after I. I. Mechnikov, Saint-Petersburg
I. Mechnikov, Saint-Petersburg
We examined 150 patients with Kimmerle anomaly, aged 16-60, mean age 33.1±1.4, women – 83 (55.3%), men – 67 (44.7%). The main complaint was headache, predominantly of vascular nature. Patients underwent the combined treatment with non-steroidal anti-inflammatory agents, vasoactive and phlebotropic drug; and osteopathic techniques. The use of combined therapy contributed to a significant decrease in the intensity and arresting headache.
Keywords: headache, Kimmerle anomaly, osteopathic treatment.
Аномалия Киммерле (АК) характеризуется изменениями в области задней дуги атланта, ос-сификацией косой атлантозатылочной связки, проходящей над позвоночной бороздой С1, при этом образуется костная перемычка, превращающая борозду позвоночной артерии в сводчатое отверстие. АК относят к аномалиям краниовер-тебральной области (КВО), подобные изменения достаточно разнообразны, что определяет неоднородность клинических проявлений, а как следствие, крайнюю сложность выделения специфических клинических синдромов. Разнообразие клинических проявлений, отсутствие специфических неврологических синдромов, сложность анализа рентгенограмм обусловливают некоторые трудности выявления этих аномалий и актуальность поиска оптимального пути ранней диагностики данной патологии [3].
Разнообразие клинических проявлений, отсутствие специфических неврологических синдромов, сложность анализа рентгенограмм обусловливают некоторые трудности выявления этих аномалий и актуальность поиска оптимального пути ранней диагностики данной патологии [3].
Клиническое значение АК связано с большой подвижностью в атлантоаксиальном сегменте и анатомо-физиологическим взаимоотношением с позвоночными артериями (ПА). При наличии аномального костного мостика над ПА создаются условия для ограничения ее подвижности, особенно при экстензии головы. При этом возможно развитие полной клинической картины синдрома позвоночной артерии с симптомами, обусловленными вегетативно-ирритативными периваскуляр-ными симпатическими и ишемическими меха-
низмами, вследствие меньшего поступления артериальной крови в артериальный круг большого мозга (АКБМ) и развития дефицита кровоснабжения головного мозга [7, 12].
Возможность применения методов мануальной терапии в лечении больных с АК остается дискутабельным вопросом. При наличии показаний к проведению мануальной терапии на шейном отделе позвоночника не следует расценивать АК как противопоказание. Однако проведенный анализ причин появления осложнений ударных приемов мануальной терапии на шейном отделе позвоночника говорит об обратном, поскольку у 81% пациентов была выявлена АК [9].
Целью настоящей работы явилось совершенствование методов лечения головной боли у больных с аномалией Киммерле.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Обследовано 150 пациентов с АК в возрасте от 16 до 60 лет, средний возраст 33,1 ± 1,4 года, женщин – 83 (55,3%), мужчин – 67 (44,7%).
Из исследования исключались пациенты с отягощенным неврологическим анамнезом (черепно-мозговые травмы, нейроинфекции), с признаками выраженного церебрального атеросклероза, ишемической болезни сердца, гипертониче-
7G
ской болезни, тяжелыми соматическими (почечная, печеночная недостаточность), онкологическими, психическими заболеваниями, сопутствующей интоксикацией (алкогольной, наркотической).
На каждого обследуемого заполнялась специальная учетная карта. Наряду с клиниконеврологическим обследованием, больные были осмотрены терапевтом и офтальмологом для исключения артериальной гипертензии; также проведено остеопатическое обследование, включающее оценку функционирования кранио-сакральной системы.
Разделение больных на возрастные группы соответствовало классификации Всемирной организации здравоохранения. Оценка интенсивности головной боли (ГБ) производилась по визуально аналоговой шкале (ВАШ). Результаты ВАШ соотносили с методом оптимальных вербальных определений. По данной методике пациенту предлагаются определения боли: “легкая”, “умеренная”, “терпимая”, “сильная”, “нестерпимая”; пациент должен выбрать и отметить вербальное определение. Также для оценки эффективности терапии использовали краткий опросник боли с оценкой показателей: общая активность, нормальная работа, отношения с другими людьми, настроение, сон и наслаждение жизнью.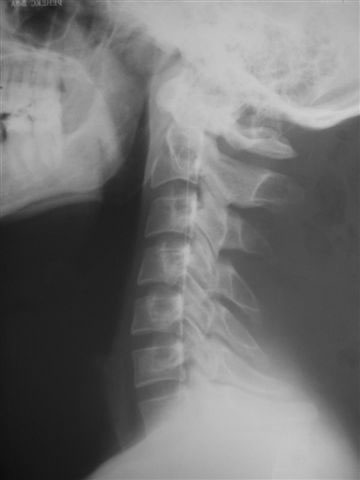
Комплексное обследование включало инструментальные методы исследования. Для верификации диагноза АК, а также изучения взаимоотношений костных структур на уровне кранио-вертебрального перехода производилось поэтапное рентгенографическое исследование черепа и шейного отдела позвоночника в двух стандартных проекциях, прицельное исследование КВО; при необходимости – компьютерная томография КВО с функциональными пробами [4]. Всем пациентам проведена магнитно-резонансная томография (МРТ) головного мозга на томографе “Signa EXCITE HD” с напряженностью магнитного поля 1,5 Тесла по стандартным методикам в сагиттальной, аксиальной и корональной плоскостях. Бесконтрастная магнитно-резонансная ангиография (МРА) в последовательности 3D TOF (время-пролетная ангиография) выполнена 98 пациентам с АК, 24 из них в сочетании с ультразвуковой транскраниальной допплерографией (ТКДГ). Магнитно-резонансная венография (МРВ) полости черепа проведена 80 пациентам с АК, программа – 2D TOF SPGR с последующей ротацией и MIP реформацией. Кроме того, выполнены электрокардиография, рутинные лабораторные исследования.
Кроме того, выполнены электрокардиография, рутинные лабораторные исследования.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
У всех пациентов с АК отмечена ГБ, причем у 146 (97,3%) больных цефалгия явилась основной жалобой при обращении к врачу.
Боль провоцировалась механическими факторами, предшествовали эпизоды перенапряжения: сон в неудобной позе, длительная физическая нагрузка, связанная с наклоном или переразгиба-нием головы, нефизиологические нагрузки; у 2 (1,3%) пациентов ГБ могла возникать и без видимой причины. Появление цефалгии после сна, а также ее усиление при физической нагрузке и кашле отмечали 92 (63,0%) пациента с АК. Метеозависимость цефалгий зарегистрирована в 55,3% наблюдений. У 112 (74,7%) опрошенных отмечена ежедневная хроническая ГБ. До обращения к неврологу большинство пациентов проводили симптоматическую терапию ГБ с применением нестероидных противовоспалительных средств (НПВС), анальгетиков и комбинированных антиалгических препаратов без достижения значимого терапевтического эффекта.
Интенсивность ГБ по ВАШ у больных с АК составила 5,4 ± 0,14 балла и была расценена как умеренная.
Для изучения зависимости интенсивности ГБ от локализации АК и возраста пациентов больные были разделены на две группы в зависимости от анатомической характеристики аномалии: 1 -ю
группу составили больные с односторонней АК (75 человек), 2-ю – с двусторонней (75 человек). Кроме того, каждая из групп была разделена на
3 возрастные подгруппы: первую подгруппу составили лица в возрасте 16-29 лет (молодого), вторую – 30-44 лет (зрелого), третью – 45-59 лет (среднего возраста). По результатам исследования выявлено, что у молодых пациентов интенсивность ГБ в 1-й и 2-й подгруппах значимо не различалась: 4,52 ± 0,35 балла в 1-й против
4,63 ± 0,34 балла – во 2-й; однако нарастание интенсивности цефалгии с возрастом наиболее выражено у пациентов с двусторонней АК. Коэффициент корреляции интенсивности ГБ с возрастом у пациентов с односторонней и двусторонней АК составил соответственно 0,82 и 0,88, что свидетельствовало о высокой степени зависимости показателей. У пациентов зрелого возраста с двусторонней АК интенсивность ГБ была достоверно выше; в группе среднего – интенсивность це-фалгии также выше при двусторонней АК (табл. 1).
Коэффициент корреляции интенсивности ГБ с возрастом у пациентов с односторонней и двусторонней АК составил соответственно 0,82 и 0,88, что свидетельствовало о высокой степени зависимости показателей. У пациентов зрелого возраста с двусторонней АК интенсивность ГБ была достоверно выше; в группе среднего – интенсивность це-фалгии также выше при двусторонней АК (табл. 1).
Проведен анализ факторов, которые, по мнению пациентов с АК, были причиной манифестации ГБ. Наиболее часто больные связывали возникновение цефалгии с перенесенными инфекци-
ями и легкой черепно-мозговой травмой (табл. 2).
Немаловажное значение имеет возрастной период манифестации цефалгии. Большинство пациентов отмечали появление хронической ГБ в зрелом возрасте (рис. 1).
Кроме ГБ, 62 (41,3%) больных с АК предъявляли жалобы на боль, локализующуюся в области шеи, у них определялось напряжение задней мышечной группы, чаще асимметрично. При пальпации у 38 (25,3%) пациентов отмечена умеренная болезненность верхне-шейных паравер-тебральных точек и в области скальпа.
При пальпации у 38 (25,3%) пациентов отмечена умеренная болезненность верхне-шейных паравер-тебральных точек и в области скальпа.
Больные также предъявляли жалобы на общую слабость; умеренное головокружение несистемного характера, сопровождавшегося тошнотой; утомляемость; нарушение сна.
У большинства пациентов в неврологическом статусе выявлены признаки мозжечкововестибулярной и пирамидной недостаточности (табл. 3).
При остеопатическом обследовании у пациентов определялись признаки соматической дисфункции на уровне краниовертебрального перехода в позвоночных двигательных сегментах С0-С1, С1-С11, СП-СШ. Отмечали асимметричные
Таблица 1
Оценка интенсивности головной боли по визуально-аналоговой шкале у пациентов с аномалией Киммерле в зависимости от локализации аномалии в различных возрастных подгруппах
Возрастные подгруппы пациентов (лет) Пациенты с односторонней АК (п = 75) Пациенты с двусторонней АК (п = 75)
Абс. число (%) Интенсивность по ВАШ (баллы) Абс. число (%) Интенсивность по ВАШ (баллы)
число (%) Интенсивность по ВАШ (баллы) Абс. число (%) Интенсивность по ВАШ (баллы)
16-29 12 (8,0) 4,52±0,35 15 (10,0) 4,63±0,34
30-44 45 (30,0) 5,21±0,17 47 (31,3) 5,88±0,16*
45-59 18 (12,0) 5,84±0,31 13 (8,7) 6,32±0,38
Примечание: * – различия значимы при сравнении с соответствующим показателем пациентов с односторонней АК (р<0,05).
Таблица 2
Факторы манифестации головной боли у больных с аномалией Киммерле
Фактор Больные с АК (п = 150) Абс. число (%)
Перенесенная инфекция 43 (28,6)
Закрытая черепно-мозговая травма 42 (28,0)
Физическое перенапряжение 33 (22,0)
Психо-эмоциональный стресс 27 (18,0)
Не определен 5 (3,4)
Таблица 3
Характеристика неврологической симптоматики у больных с аномалией Киммерле
Неврологические симптомы Пациенты с АК (п=150) Абс. число (%)
число (%)
Горизонтальный нистагм 115 (76,7)
Симптомы орального автоматизма 21 (14,0)
Анизорефлексия 112 (74,7)
Клоноиды стоп 62 (41,3)
Симптом Россолимо-Вендеровича 87 (58,0)
Патологические стопные знаки 59 (39,3)
Симптом Г орнера 66 (44,0)
3,3%
45-59 лет
72,7%
30-44 лет
0%
50%
100%
Возрастные периоды манифестации головной боли у пациентов с аномалией Киммерле.
Рис. 1.
дисфункции, со стойким блокированием движений в верхнешейных сегментах.
При рентгенологическом обследовании у пациентов с АК регистрировали различные варианты расположения заднего мостика атланта. Одно-и двустороннее расположение мостика определялось в равной степени, говоря о стороне локализации, справа в 3 раза чаще, чем слева. Анализ данных, характеризующих варианты строения костного канала у больных с АК, позволил констатировать высокую частоту встречаемости замкнутого костного канала – у 107 (71,3%) пациентов; незамкнутого – у 43 (28,7%) больных. У 61 (40,7%) больного на рентгенограммах шейного отдела позвоночника выявлены начальные признаки дегенеративно-дистрофических изменений. Кроме того, отмечены сочетания с другими аномалиями строения шейного отдела позвоночника: у 32 (21,3%) – большие поперечные отростки, у 8 (5,3%) – шейные ребра, у 3 (2,0%) пациентов -сочетание этих признаков.
При МРТ головного мозга у пациентов с АК выявлены диффузные и очаговые изменения. Нейровизуализационные признаки диффузных изменений головного мозга характеризовались наличием легкой или умеренной заместительной наружной гидроцефалией в виде расширения суб-арахноидальных пространств по конвекситальной поверхности преимущественно в лобно-теменных областях у 43 (28,7%) пациентов; заместительной внутренней гидроцефалией (умеренное расширение боковых желудочков, чаще ассиметрично) в сочетании с наружной гидроцефалией у 29 (19,3%) больных. Кроме того, у 21 (14,0%) пациента выявлены расширения периваскулярных пространств Вирхова-Робена субкортикальных отделов белого вещества, в проекции базальных ядер, а также по ходу лучистости мозолистого тела. Данный признак считается проявлением нестабильности гемодинамики. Также определялось умеренное расширение венозных выпускников по
конвекситальной поверхности головного мозга у 32 (21,3%) больных, что является косвенным признаком повышения внутричерепного давления.
Очаговые изменения характеризовались наличием дистрофических периваскулярных очагов у 35 (23,3%) пациентов, локализующиеся в субкортикальных отделах белого вещества мозга лобной и теменной областей (проекция перивас-кулярных пространств). Патологических изменений на МРТ головного мозга не обнаружено у 22 (14,7%) пациентов с АК.
По данным МРА, у 59 (60,2%) пациентов с АК визуализирован незамкнутый АКБМ различных типов. Наиболее часто определяли разобщение заднего отдела АКБМ в виде аплазии задней соединительной артерии у 53 (54,0%) больных, а также задней трифуркации внутренней сонной артерии (ВСА) у 17 (17,4%). Выявлены варианты сосудов с ассиметричным диаметром в виде гипоплазии ПА – у 57 (58,0%) больных с АК, причем при односторонней АК определялась ипсила-теральная гипоплазия ПА.
Следующий признак, характеризующий особенности строения магистральных артерий головы (МАГ) у больных с АК – выявление извитости сосудов преимущественно в вертебрально-базиллярном артериальном бассейне. У 35 (35,7%) пациентов отмечено сочетание извитости ПА различных типов (С-образная – у 23, Б-образная – у 12, образование перегибов – у 9). Извитость ВСА определена у 28 (28,6%) пациентов, в сочетании с извитостью ПА у 17, у 13 из них – с вариантами строения АКБМ. С-образная извитость основной артерии выявлена у 27 (27,6%) пациентов.
У 35 (35,7%) пациентов отмечено сочетание извитости ПА различных типов (С-образная – у 23, Б-образная – у 12, образование перегибов – у 9). Извитость ВСА определена у 28 (28,6%) пациентов, в сочетании с извитостью ПА у 17, у 13 из них – с вариантами строения АКБМ. С-образная извитость основной артерии выявлена у 27 (27,6%) пациентов.
Анализ результатов МРВ свидетельствовал о наличии структурных признаков нарушения венозного кровообращения головного мозга у 78 (97,5%) больных, только у 2 (2,5%) пациентов из 80 обследованных не отмечены признаки нарушения венозного оттока. Гипоплазия поперечных
синусов выявлена у 48 (60,0%) пациентов, в сочетании с одноименной гипоплазией сигмовидных синусов у 29 (36,2%). Асимметрия венозных синусов задней черепной ямки сочеталась с ипсила-теральной асимметрией внутренних яремных вен, формированием дополнительных анастомозов с венами мягких тканей шеи, расширением и извитостью вен подзатылочного сплетения, реже варикозным расширением затылочной вены.
Данные оценки артериальной и венозной гемодинамики при ТКДГ согласовывались с результатами МРА и МРВ.
Исследования последних десятилетий показали, что хроническая недостаточность мозгового кровообращения (ХНМК) омолаживается и встречается чаще у лиц 30-40-летнего возраста [2, 11]. Аномалии развития церебральных сосудов являются анатомо-физиологической предпосылкой ХНМК [5]. Для дисциркуляторной энцефалопатии I стадии (ДЭ I) наиболее характерно преобладание нарушений венозной гемодинамики над выраженностью нарушений артериального компонентах [6]. Учитывая особенности церебрального венозного и артериального кровообращения у пациентов с АК, а также манифестацию ГБ в зрелом возрасте, клиническая декомпенсация, вероятно, обусловлена воздействием ранее указанных факторов манифестации ГБ в сочетании с имеющимися начальными проявлениями ХНМК.
Больным проводилось комплексное лечение, в зависимости от преобладающего типа ГБ. При выборе терапии в первую очередь учитывали патогенетические основы возникновения крани-алгии, что позволило наиболее точно определить тактику лечения больных с АК.
При выборе терапии в первую очередь учитывали патогенетические основы возникновения крани-алгии, что позволило наиболее точно определить тактику лечения больных с АК.
Тип цефалгии определяли в соответствии с диагностическими критериями международной классификации ГБ (МКГБ, 2004). Краниалгия сжимающего, стягивающего, сдавливающего характера, как правило, без четкой локализации, умеренной интенсивности, сочетающаяся с напряжением задней шейной группы мышц выявлена у 11 (7,3%) пациентов, что соответствовало хронической головной боли напряжения с вовлечением перикраниальных мышц (ХГБН). Односторонняя цефалгия, умеренной интенсивности начинающаяся в шейно-затылочной области с распространением на висок и затылок, в сочетании с ограничением подвижности в верхнешейном отделе позвоночника диагностирована у
4 (2,7%) обследованных и была расценена как цервикогенная головная боль (ЦГБ). У 7 (4,7%) больных краниалгия по диагностическим критериям соответствовала ХГБН, однако некоторые клинические признаки ГБ (распирающего характера, с иррадиацией в периорбитальную область, возникающие ночью или под утро) могут быть
обусловлены нарушением интракраниального венозного оттока. Рубрики венозной головной в МКГБ нет, представлена «ГБ, связанная с тромбозом интракраниальных вен», однако появление ГБ не ограничивается острым тромбозом, поскольку цефалгия также является ведущим симптомом церебральной венозной недостаточности [1]. В МКБ-10 наиболее соответствующей является рубрика G44.1 «Сосудистая ГБ, не классифицированная в других рубриках». Анализ характера краниалгии позволил считать, что у 128 (85,3%) пациентов с АК выявлена цефалгия смешанного характера, включающая вышеперечисленные признаки, с преобладанием одного из указанных типов ГБ.
Рубрики венозной головной в МКГБ нет, представлена «ГБ, связанная с тромбозом интракраниальных вен», однако появление ГБ не ограничивается острым тромбозом, поскольку цефалгия также является ведущим симптомом церебральной венозной недостаточности [1]. В МКБ-10 наиболее соответствующей является рубрика G44.1 «Сосудистая ГБ, не классифицированная в других рубриках». Анализ характера краниалгии позволил считать, что у 128 (85,3%) пациентов с АК выявлена цефалгия смешанного характера, включающая вышеперечисленные признаки, с преобладанием одного из указанных типов ГБ.
Все пациенты получали базовую терапию. Для купирования головной боли использовали целекоксиб. Исходя из практического опыта, назначение нестероидных противовоспалительных средств предпочтительно в терапии ЦГБ и ХГБН [6,9]. Полученные результаты МРА и МРВ, свидетельствующие об особенностях строения АКБМ и МАГ, о нарушении интракраниального венозного оттока у пациентов с АК, обосновывали необходимость назначения в комплекс терапии вазоактивных препаратов, улучшающих микроциркуляцию и венотоников; назначали сухой стандартизованный экстракт гинкго билоба (та-накан), диосмин (детралекс) либо экстракт красных листьев винограда (антистакс).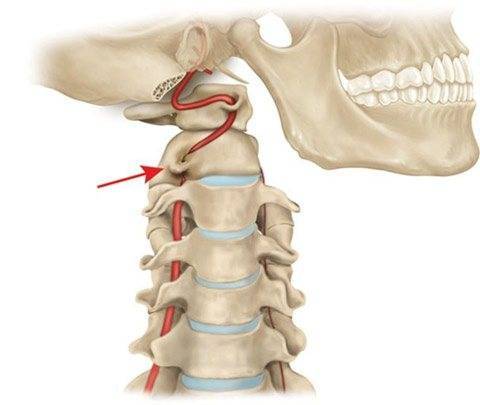 При наличии головокружения применяли препарат гистамина -бетагистин.
При наличии головокружения применяли препарат гистамина -бетагистин.
Для дифференцированного лечения цефалгии больные были разделены на группы в соответствии с доминирующим типом ГБ, не зависимо от возраста.
1-я группа включала 57 пациентов в возрасте от 16 до 52 лет, средний возраст 31,8 ± 1,1 лет, 26 мужчин, 31 женщина с преимущественным преобладанием ГБ сосудистого характера. Больные получали базовую терапию.
2-я группа – 24 больных в возрасте от 17 до 46 лет, средний возраст 30,9 ± 1,6 года, 11 мужчин, 13 женщин, с превалированием ЦГБ. Наряду с базовой терапией пациентам назначали миоре-лаксант центрального действия – толперизон.
3-я группа – 34 пациента в возрасте от 18 до 49 лет, средний возраст 35,4 ± 1,5 года, 18 мужчин, 16 женщин, с преобладанием ХГБН. Пациенты получали базовую терапию, миорелаксант центрального действия – толперизон, кроме того, в комплекс терапии включали немедикаментозные методы лечения – курсы остеопатической терапии с применением мягких техник, направленные на коррекцию биомеханических нарушений на уровне верхнешейного отдела позвоночника и краниовертебрального перехода.
Больные, у которых наряду с ГБ выявлены признаки ДЭ I по клиническим и нейровизуали-зационным данным (МРТ головного мозга), были определены в 4-ю группу: 35 человек –
12 мужчин, 23 женщины в возрасте от 36 до 59 лет, средний возраст 47,4 ± 1,2 года. Пациенты получали базовую терапию, также было обосновано применение комбинированного нейромета-болического препарата – цитофлавина.
Для анализа эффективности проводимой терапии в первой, второй и третьей группах применяли ВАШ. Использование ВАШ обусловлено тем, что общее самочувствие больных в этих группах в наибольшей степени зависело от интенсивности ГБ.
В отличие от предыдущих групп обследованных, 4-ю составили пациенты преимущественно среднего возраста, их жалобы носили разносторонний характер. Помимо ГБ у них наблюдалась слабость и как следствие снижение общей активности и работоспособности, также пациенты жаловались на нарушение сна. Для оценки эффективности терапии использовали краткий опросник боли.
Для оценки эффективности терапии использовали краткий опросник боли.
В результате проведенного лечения у больных во всех группах отмечена положительная динамика клинических проявлений. В первых трех группах все больные отмечали исчезновение ежедневной ГБ. В первой группе обследования до лечения интенсивность ГБ составляла 4,81 ± 0,14 балла, после лечения – 2,97±0,16 балла, у 34 (59,6%) пациентов отмечено снижение интенсивности ГБ, у 23 (40,4%) – исчезновение цефалгий. Во второй группе интенсивность ГБ до лечения была 6,21 ± 0,25 балла, после лечения -3,22 ± 0,21 балла, у 13 (54,2%) больных отмечено исчезновение цефалгии и у 11 (45,8%) – снижение
ее интенсивности. В 3-й группе наблюдалась наиболее выраженная положительная динамика клинических проявлений: интенсивность ГБ до лечения составляла 5,37 ± 0,20 балла, против 1,33 ± 0,20 балла после, краниалгия у 23 (67,6%) пациентов была купирована, у остальных 11 (32,4%) определялось снижение ее интенсивности.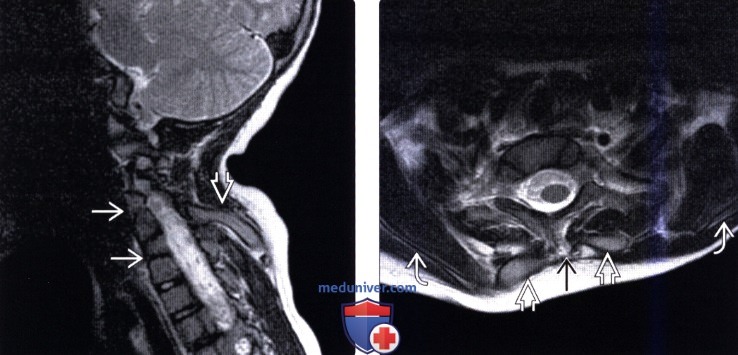 Наибольшая эффективность терапии в 3-й группе, вероятно, обусловлена включением в комплекс терапии остеопатических методик (рис. 2).
Наибольшая эффективность терапии в 3-й группе, вероятно, обусловлена включением в комплекс терапии остеопатических методик (рис. 2).
В 4-й группе все пациенты на фоне проводимой терапии отмечали уменьшение интенсивности ГБ. Кроме того, у них регистрировалась положительная динамика по всем основным клиническим симптомам: больные отмечали повышение работоспособности, снижение утомляемости, восстановление сна (рис. 3).
В дальнейшем после лечения всем пациентам с АК рекомендовали профилактические нефармакологические лечебно-профилактические мероприятия с использованием физических факторов (транскраниальная электростимуляция, магнито-терапия), лечебная физкультура, остеопатическое лечение.
Выявленные особенности церебральной артериальной и венозной гемодинамики у пациентов с аномалией Киммерле обусловливают целесообразность углубленного исследования мозгового кровообращения для обеспечения дифференцированной терапии головной боли.
В комплексе лечения цефалгии у пациентов с аномалией Киммерле, наряду с использованием антиалгических препаратов, показано назначение вазоактивных средств и венотоников. Пациентам среднего возраста (45-59 лет) следует дополнительно рекомендовать профилактические курсы
Рис. 2. Динамика изменения интенсивности головной боли (ВАШ) на фоне проводимой терапии у пациентов с аномалией Киммерле.
Примечание: Значимость различий показателей до и после лечения р>0,05.
Рис. 3. Динамика интенсивности головной боли и ее влияния на различные аспекты жизни (Краткий опросник боли) на фоне проводимой терапии у пациентов с аномалией Киммерле.
Примечание: Значимость различий показателей до и после лечения р>0,05.
нейрометаболических препаратов. При ГБ с вовлечением перикраниальной мускулатуры показаны дополнительные курсы остеопатического лечения с применением мягких техник.
ЛИТЕРАТУРА
1. Алексеев В.В. Головные боли при интракраниальной венозной дисфункции // Боль. – 2008. – Т. 20, № 3. – С. 15-21.
2. Батышева Т.Т. Хроническая недостаточность мозгового кровообращения и нейропротекция, новое в диагностике // Нейропротекция при острой и хронической недостаточности мозгового кровообращения: сб. науч. статей. – СПб., 2007. – С. 98-114.
3. Богородинский Д.К. Краниовертебральная патология. – М. : ГЭОТАР-Медиа, 2008. – 631 с.
4. Жулев Н.М. Диагностика краниовертебральных дисплазий: учебное пособие.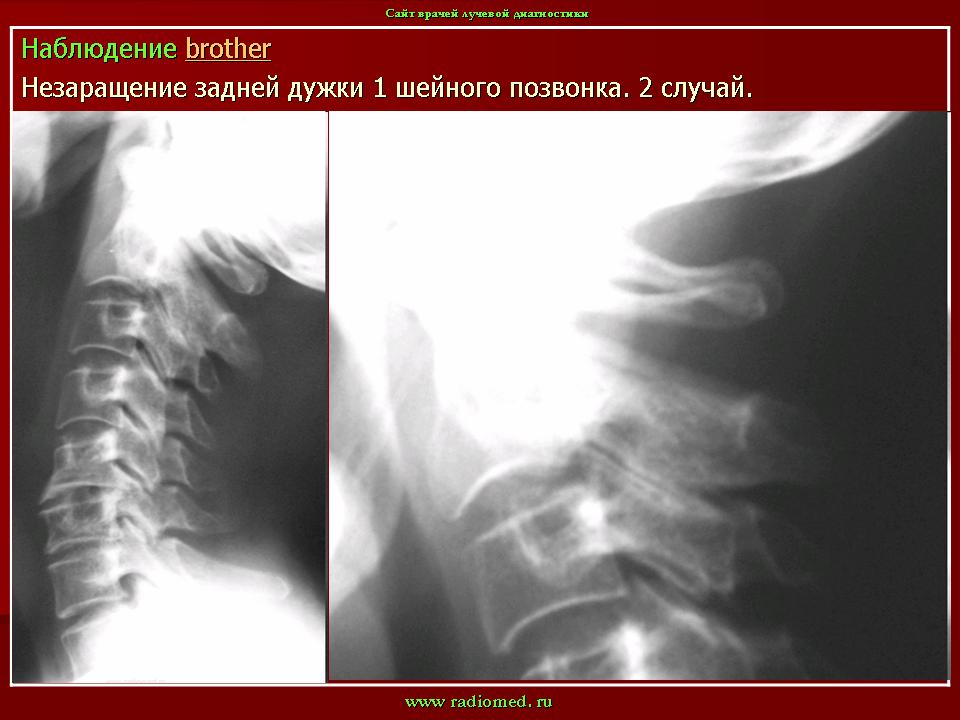 – СПб.: СПбМАПО, 2001. – 18 с.
– СПб.: СПбМАПО, 2001. – 18 с.
5. Куц Н.В. Венозная церебральная дисгемия при хронической ишемии // Вести Рос. Воен.-мед. акад. – 2007. – № 1. – С. 15-19.
6. Лавров А.Ю. Характеристика артериальной и венозной церебральной гемодинамики на разных стадиях дисциркуляторной энцефалопатии // Инсульт. – 2005. – № 15. – С. 4-11.
7. Лачкепиани А.Н. Дисциркуляторные нарушения в вертебрально-базилярной системе при наличии аномалии Киммерле // Журн. невропатологии и психиатрии. – 1990. – № 1. – С. 23-26.
8. Пешкова О.П. Комплексные методы лечения головной боли напряжения // Материалы науч.-практ. конф. «Головная боль 2007». – М., 2007. -С. 194-195.
9. Скоромец А.А. Осложнения мануальной терапии у больных со спондилогенными неврологическими синдромами // Мануальная медицина.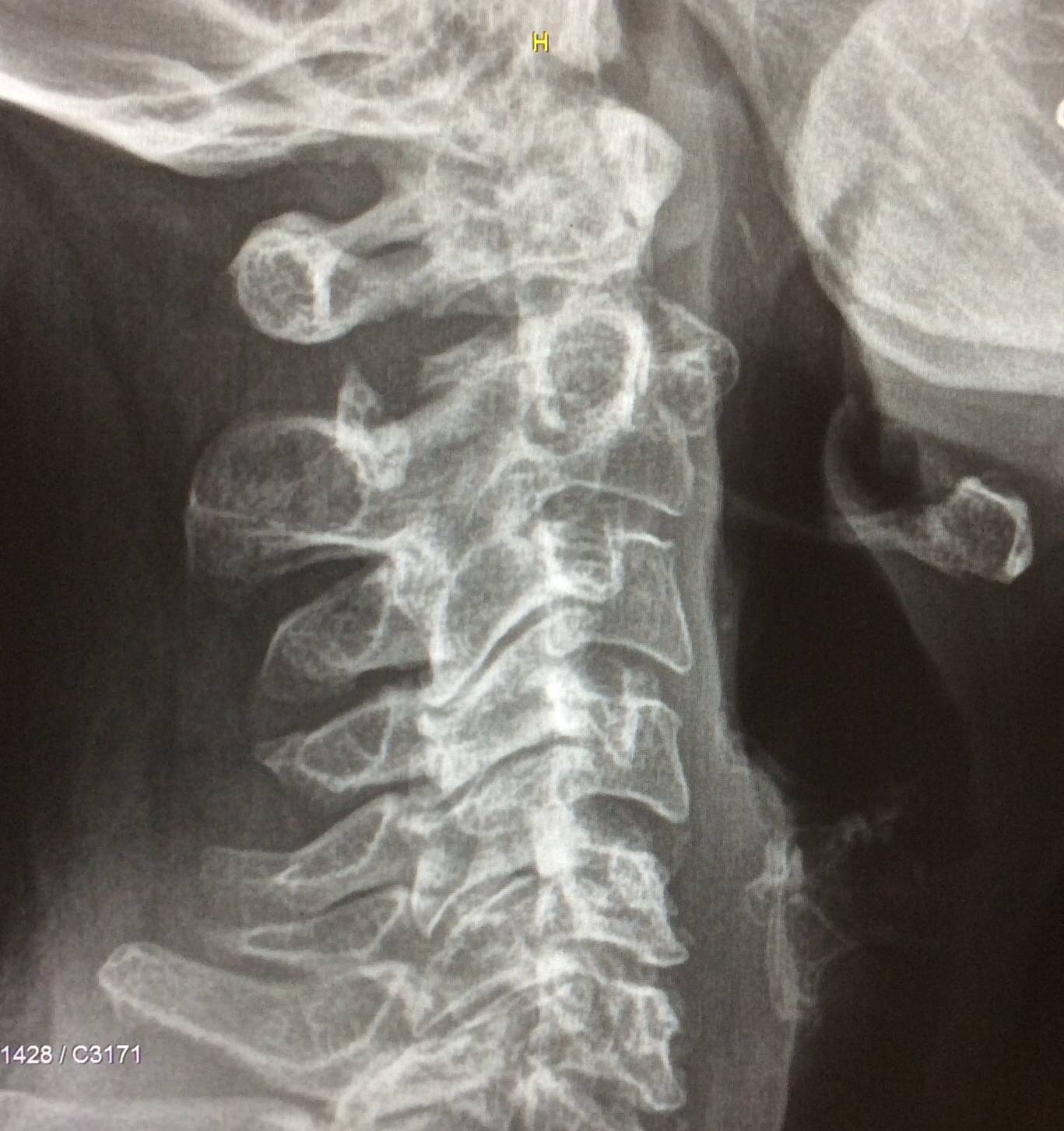 – 1991. -№ 1. – С. 24-30.
– 1991. -№ 1. – С. 24-30.
10. Табеева Г.Р. Цервикогенная головная боль: патофизиология, клиника, подходы к терапии // Неврология, нейропсихиатрия, психосоматика. – 2010. -№ 2. – С. 19-26.
11. Яхно Н.Н. Дисциркуляторная энцефалопатия. – М., 2000. – 32 с.
12. Split W. Nature of headaches in Kimmerle anomaly // NeurolNeurochir Pol. – 2004. – Vol. 38, N 5. -P. 389-394.
Аномалия Киммерле — 24Radiology.ru
Аномалия Кимерли — наличие в структуре первого шейного позвонка дополнительной костной дужки, ограничивающей движения позвоночной артерии и вызывающей синдром ее сдавления.
Эпидемиология
Частота аномалии или варианта Киммерле в популяции составляет около 8%.
История
A. Kimmerle (1930) при анализе рентгенограммы больного, страдающего гнойным лимфаденитом шеи, обратил внимание на строение задней дуги атланта. В литературе приводится ряд терминов, характеризующих данные изменения – foramen articulare atlantis, foramen retroarticulare superior, ponticulus posterior et ponticulus lateralis atlantis, canalis Bildunge; при неполном варианте строения – clinoid bridge. Термин аномалия Киммерле, как название данной патологии употребляется в зарубежной и отечественной литературе на протяжении последних 70 лет.
Kimmerle (1930) при анализе рентгенограммы больного, страдающего гнойным лимфаденитом шеи, обратил внимание на строение задней дуги атланта. В литературе приводится ряд терминов, характеризующих данные изменения – foramen articulare atlantis, foramen retroarticulare superior, ponticulus posterior et ponticulus lateralis atlantis, canalis Bildunge; при неполном варианте строения – clinoid bridge. Термин аномалия Киммерле, как название данной патологии употребляется в зарубежной и отечественной литературе на протяжении последних 70 лет.
Патология
В настоящее время в литературе обсуждаются два варианта патогенетической аномалии: первый – кольцо образуется за счет оссификации косой атлантоокципи- тальной связки, второй – кольцо представляет собой крайнюю степень дисплазии бороздки, сочетающейся с другими диспластическими нарушениями краниовертебрального перехода.
Аномалия является по отношению к позвоночной артерии экстравазальным фактором, который, помимо механического воздействия на сосуд, ограничивает и резервные возможности V3 сегмента ПА при движениях головой, поскольку существует препятствие в виде костного мостика.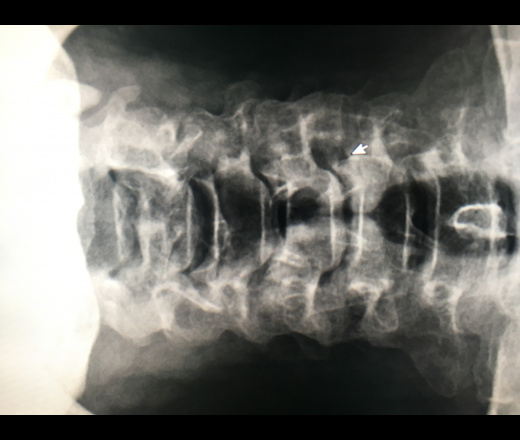
Ассоциация
Пороки анатомического развития головного мозга
- Арнольда–Киари
- Денди–Уокера
- Субарахноидальные кисты
- Агенезия мозолистого тела
- Микрогирия
Сосудистая аномалия
- гипоплазия задней соединительной артерии
- задняя трифуркация внутренней сонной артерии
- гипоплазия одной из позвоночных артерий
- патологическая извитость позвоночных артерий
Клиника
Клинические проявления типичные при аномалии Киммерле — это сочетание цефалгического синдрома, вегетативно‐вестибулярных нарушений и болевого (радикулярного) синдрома. Их выраженность варьировала в широких пределах, пароксизмы зависели от изменения позиции головы и тела и наличия физической и/или интеллектуальной нагрузки.
Головные боли имеют мигренозный характер и локализуются преимущественно в затылочной области с быстрой иррадиацией в передние отделы головы (лобно‐височную область).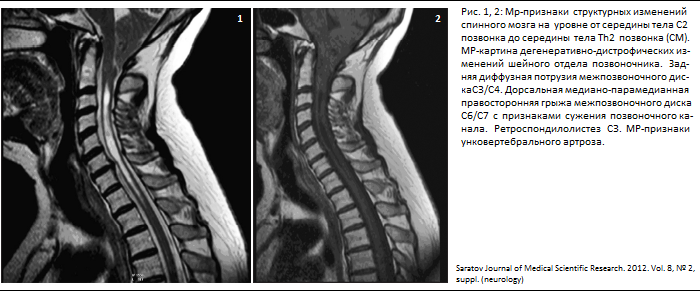
Радиологические находки
Рентгенография
Определяется наличие замкнутого костного канала для позвоночной артерии или очень редко незамкнутого. В старшей возрастной группе возможны сопутствующие дегенеративно‐дистрофические изменения шейного отдела позвоночника.
МРТ
На МР-снимках обычно визуализируется в структурах головного мозга изменения диффузного или очагового характера. Диффузные изменения характеризуются наличием расширения субарахноидальных пространств, расширением и асимметрией боковых желудочков. Очаговые изменения обусловленны ишемией и локализуются, преимущественно в затылочной области.
УЗИ
Допплерография позволяет выявить асимметрию кровотока в позвоночных артериях (в основном за счет снижения скоростных показателей в экстракраниальных сегментах V3 и V4).
Признаки венозной дисциркуляции (в основном в виде затруднения венозного оттока по прямому синусу и позвоночным сплетениям).
Петербургская школа магнитно-резонансной томографии
» Лучевая диагностика » ЛУЧЕВАЯ ДИАГНОСТИКА БОЛЕЗНЕЙ » Лучевая диагностика кранио-вертебральных аномалий
Аномалии кранио-вертебральной области встречаются у 1-2% людей. Часть из них сопровождается неврологической симптоматикой. Рентгенография и МРТ выявляют все виды аномалий.
МРТ головного мозга. Сагиттальная Т1-взвешенная МРТ. Аномалия Арнольда-Киари 1. Цветовая обработка изображения.
Аномалии развития кранио-вертебральной зоны могут быть костными и нервных структур. Часто оба вида сочетаются. Лучевая диагностика головного мозга и шейной области являются необходиыми элементами диагностики данных патологий.
Костные аномалиям развития краниовертебральной зоны
- Аномалии развития позвонков: незаращение задней дуги первого шейного позвонка – встречается примерно у 1% людей, конкресценция С2-С3 – наблюдается примерно у 2% популяции, полная ассимиляция С1 и затылочной кости – наблюдается примерно у 1-2% популяции, седловидная гиперплазия атланта, аномалии арки атланта (классификация Curriano: А-отсутствие слияния по задней линии, B – одностронний дефект; С – двухсторонний дефект, D – отсутствие задней арки при наличии заднего бугра, Е – полное отсутствие арки, включая бугор)
- Аномалии развития костей основания черепа: платибазия, базилярная импрессия, сегментация ската;
- Синдром Клиппеля – Фейля (Klippel-Feil) включает в себя 3 типа: тип 1 – слияние нескольких позвонков, тип 2 – слияние 2-3 позвонков, часто в сочетании с атлантоокципитальным слиянием (рис.
 96), и тип 3 – разнообразные аномалии грудных и поясничных позвонков (бабочковидные позвонки, задние или боковые полупозвонки, конкресценцию или неслияние отдельных его частей) в сочетании с типом 1 или 2. Частота аномалии меньше 1%. Синдром Клиппеля-Фейля часто сочетается с краниовертебральными аномалиями, сколиозом и деформацией Шпренгеля (Sprengel) – подъемом лопатки вверх. Синдром Клиппеля-Фейля часто сочетается с аномалиями почек. Сегодня известно, что синдром относится к аутосомно-доминантным заболеваниям (17 пара хромосом), формируется между 3 и 8 неделями эмбриогенеза;
96), и тип 3 – разнообразные аномалии грудных и поясничных позвонков (бабочковидные позвонки, задние или боковые полупозвонки, конкресценцию или неслияние отдельных его частей) в сочетании с типом 1 или 2. Частота аномалии меньше 1%. Синдром Клиппеля-Фейля часто сочетается с краниовертебральными аномалиями, сколиозом и деформацией Шпренгеля (Sprengel) – подъемом лопатки вверх. Синдром Клиппеля-Фейля часто сочетается с аномалиями почек. Сегодня известно, что синдром относится к аутосомно-доминантным заболеваниям (17 пара хромосом), формируется между 3 и 8 неделями эмбриогенеза;
Синдром Клиппеля-Фейля тип 2. Рентгенограмма в боковой проекции.
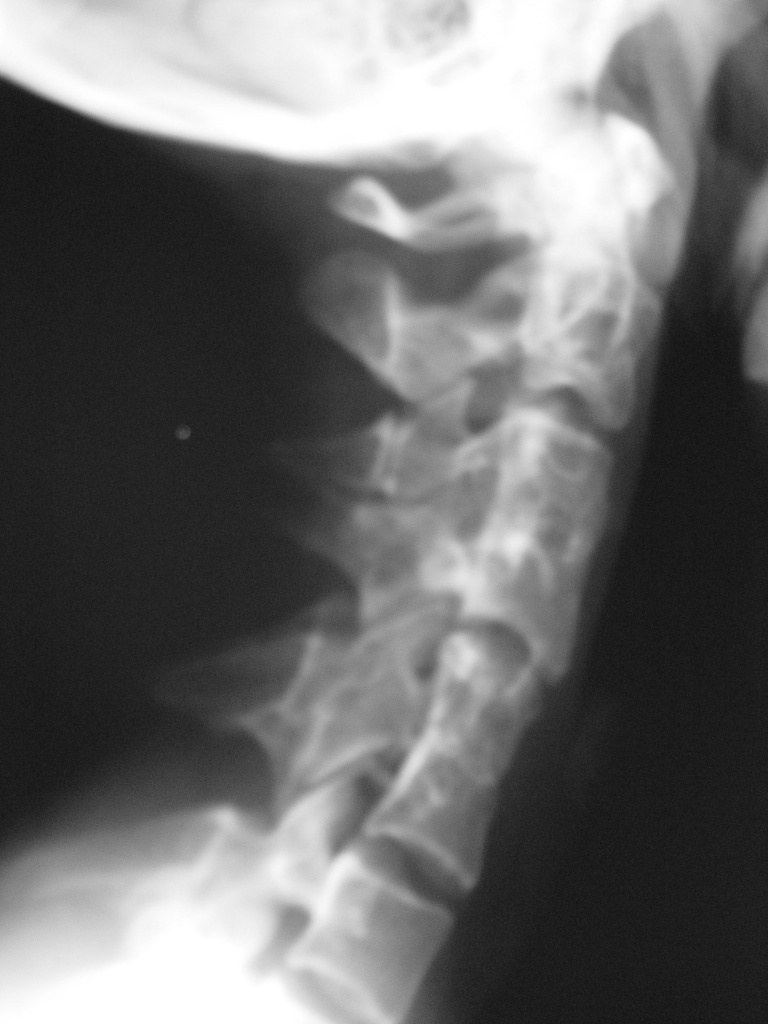
- Аномалия Киммерле (Kimmerle) или foramen arquatum отмечается примерно у 3% популяции. Она представляет собой превращение борозды позвоночной артерии, располагающейся на атланте, в канал вследствие образования костного мостика над этой бороздой. Медиальное положение костного мостика – связывает суставной отросток и заднюю дугу атланта.
 Латеральное положение – мостик перекидывается между суставом и реберно-поперечным отростком атланта, образуя аномальное кольцо латеральнее суставного отростка.
Латеральное положение – мостик перекидывается между суставом и реберно-поперечным отростком атланта, образуя аномальное кольцо латеральнее суставного отростка.
Аномалия Киммерле. Рентгенограмма в боковой проекции.
Кранио-вертебральные аномалии спинного и головного мозга относятся к группе спинальных дизрафий
Спинальные дизрафии – это общий термин включающий неоднородную группу врождённых патологий, возникающих вследствие неправильного закрытия нейральной трубки в первые 8 недель формирования плода. К аномалиям задней черепной ямки могут быть отнесены затылочные энцефалоцеле при которых грыжа содержит все или часть структур задней черепной ямки. Вариантом затылочного энцефалоцеле являются аномалии Арнольда – Киари, при которой в большое затылочное отверстие пролабирует грыжа, содержащая только часть структур задней черепной ямки. Обычно кранио-вертебральные аномалии сочетаются с гипоплазией полушарий той или иной степени (аномалия Денди-Уокера, синдром Жубера, ретроцеребеллярная арахноидальная киста) и сирингомиелией. МРТ головного мозга и позвоночника служат единственными точными методами диагностики и оценки тяжести перечисленных аномалий.
МРТ головного мозга и позвоночника служат единственными точными методами диагностики и оценки тяжести перечисленных аномалий.
МРТ головного мозга. Т1-взвешенная сагиттальная МРТ. Аномалия АК1. Гидроцефалия.
МРТ головного мозга. Т1-взвешенная сагиттальная МРТ. АК2.
МРТ шейного отдела позвоночника. Т1-взвешенная сагиттальная МРТ. Аномалия АК1. Сирингомиелия.
МРТ головного мозга. Т1-взвешенная сагиттальная МРТ. Гипоплазия полушарий и ретроцеребеллярная арахноидальная киста.
МРТ головного мозга. Сагиттальная Т1-взвешенная МРТ. Гипоплазия полушарий мозжечка и синдром Жубера.
При МРТ в СПб мы часто сталкиваемся с различными вариантами кранио-вертебральных аномалий и видим свою задачу в правильной их трактовке для выбора оптимального лечения. Мы также проводим точную МРТ морфометрию соотношения структур ЗЧЯ.
МРТ головного мозга адреса и цены
В частном центре ЦМРТ профессор Холин А. В. лично диагностирует на МРТ аппарате закрытого типа 1,5 Тл по понедельникам,средпм, субботам и и воскресеньям. Можно сделать МРТ головы дешево и по акциям.
В. лично диагностирует на МРТ аппарате закрытого типа 1,5 Тл по понедельникам,средпм, субботам и и воскресеньям. Можно сделать МРТ головы дешево и по акциям.
Спрашивайте МРТ цены у администратора.
Огромные МРТ учебные ресурсы на наших сайтах mrtspb.info и www.mri-kholin.ru по всем проблемам МРТ и ультразвуковой диагностики
Минимально инвазивное хирургическое лечение аномалии Киммерле
J Craniovertebr Junction Spine. 2017 октябрь-декабрь; 8 (4): 359–363.
Иван Львов
1 Отделение нейрохирургии, НИИ скорой помощи им. Склифосовского, Москва, Россия
Виктор Лукьянчиков
1 Отделение нейрохирургии, НИИ скорой помощи им. Склифосовского,
, Россия, Москва, Россия
1 Кафедра нейрохирургии, НИИ скорой помощи им. Склифосовского, Москва, Россия
2 Кафедра нейрохирургии, Московский государственный медико-стоматологический университет им. Евдокимова, Москва, Россия
Алексей Сытник Кафедра
кафедры нейрохирургии, НИИ скорой помощи им. Склифосовского, Москва, Россия
Склифосовского, Москва, Россия
2 Кафедра нейрохирургии, Московский государственный медико-стоматологический университет имени Евдокимова, Москва, Россия
Наталья Полунина
1 Отделение нейрохирургии НИИ нейрохирургии им. неотложной помощи, Пн scow, Россия
Владимир Крылов
1 Отделение нейрохирургии, НИИ скорой помощи им. Склифосовского, Москва, Россия
2 Отделение нейрохирургии, Московский государственный медико-стоматологический университет им. Евдокимова, Москва, Россия
1 Кафедра нейрохирургии НИИ скорой помощи им. Склифосовского, Москва, Россия
2 Кафедра нейрохирургии, Московский государственный медико-стоматологический университет им. Евдокимова, Москва, Россия
Адрес для корреспонденции: Dr.Иван Львов, отделение нейрохирургии НИИ скорой помощи им. Склифосовского, Б. Сухаревская пл. 3, Москва, 107045, Россия. Электронная почта: moc. liamg@goloeleps.rd Авторские права: © 2017 Journal of Craniovertebral Junction and Spine
liamg@goloeleps.rd Авторские права: © 2017 Journal of Craniovertebral Junction and SpineЭто статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution-NonCommercial-ShareAlike 3.0, которая позволяет другим делать ремиксы, настраивать , и основываться на работе в некоммерческих целях при условии, что автор указан и новые произведения лицензируются на идентичных условиях.
Abstract
Введение:
Аномалия Киммерле – это костный гребень между латеральной массой атласа и его задней дугой или поперечным отростком. Этот костный туннель может включать сегмент V3 позвоночной артерии, позвоночную вену, заднюю ветвь спинномозгового нерва C1 и симпатические нервы, что приводит к клиническим симптомам этого заболевания. Сообщения о хирургическом лечении аномалии Киммерле редки. Нет сообщений о малоинвазивном хирургическом лечении данной патологии.
Материалы и методы:
Шесть пациентов с аномалией Киммерле прошли курс лечения с 2015 по 2016 год. Трем пациентам были выполнены плановые операции по задней средней линии (группа доступа по задней средней линии [PMA]). Остальным трем пациентам была выполнена декомпрессия с использованием паравертебрального трансмышечного доступа (группа ПТМА). Время операции, интраоперационная кровопотеря, клинические симптомы до и после операции, а также интра- и послеоперационные осложнения сравнивались между группами PTMA и PMA.
Результаты:
Результаты хирургического лечения оценивали при выписке и через год. Кровопотеря, время операции и интенсивность боли в области послеоперационной раны были ниже в группе ПТМА. Послеоперационных осложнений не было. Отсроченные исходы хирургического лечения не зависели от метода декомпрессии артерии.
Выводы:
Хирургическое лечение компрессии позвоночной артерии у пациентов с аномалией Киммерле предпочтительнее в случаях, когда консервативное лечение неэффективно.Минимально инвазивный ПТМА является альтернативой стандартному срединно-заднему доступу, обеспечивая прямую визуализацию сжатого сегмента V3 позвоночной артерии и минимизируя послеоперационную боль.
Ключевые слова: Дугообразное отверстие, foramen retroarticulare, аномалия киммерле, паравертебральный трансмускулярный доступ, ponticuli posticus
ВВЕДЕНИЕ атланта и его задней дуги или поперечного отростка, который формируется из-за полного или неполного окостенения задней атланто-затылочной мембраны.Таким образом, сегмент V3 позвоночной артерии сдавлен в костном канале вместо того, чтобы оставаться свободным в sulcus arteriae vertebralis. Этот костный канал также может включать позвоночную вену, задний спинномозговой нерв C1, заднюю ветвь спинномозгового нерва C1 и симпатические нервы, что приводит к клиническим признакам этого заболевания. [1,2,3] по данным метаанализа, проведенного Elliott
и др. . [4] Патологоанатомические исследования выявили частоту 18.8%, компьютерная томография (КТ) показала частоту 17,2%, а рентгенографическое исследование показало частоту 16,6%. У большинства пациентов с аномалией Киммерле симптомы отсутствуют; Клинические признаки вертебробазилярной недостаточности развиваются только у 5,5% пациентов в случае удушения рубцовой связки, формирующейся в области этого аномального костного кольца [5].Сообщений, посвященных лечению компрессионного синдрома у пациентов с аномалией Киммерле, немного.В большинстве опубликованных статей обсуждаются методы консервативного лечения, [6,7] при этом авторы отмечают частые случаи рецидивов (у 50–60% пациентов), требующие повторных курсов лечения.
Хирургическое лечение аномалии Киммерле описывается лишь в нескольких статьях: задний доступ по средней линии для декомпрессии сегмента V3 позвоночной артерии. Регресс клинических признаков вертебробазилярного конфликта отмечен у 90% оперированных больных. [5,8,9,10] Нет статей о малоинвазивном хирургическом лечении данной патологии.
Целью данного исследования была оптимизация хирургического лечения компрессии позвоночной артерии у пациентов с аномалией Киммерле.
МАТЕРИАЛЫ И МЕТОДЫ
Мы проанализировали результаты хирургического лечения шести пациентов с аномалией Киммерле в период с 2015 по 2016 годы. У трех пациентов была выполнена декомпрессия позвоночной артерии с использованием минимально инвазивного заднего трансмышечного доступа (группа ПТМА), а у трех других пациентов – стандартный доступ по задней срединной линии (группа PMA).
Тяжесть заболевания оценивалась с использованием 3 баллов в зависимости от выраженности клинических симптомов [6], а также с учетом модифицированной шкалы Ренкина (mRs) и индекса мобильности Ривермида (Rmi):
Степень III: Серьезный; наличие большинства клинических симптомов; большую часть дня пациенты находятся в постельном режиме; острый приступ клинического проявления болезни при повороте головы; оценка mRs ≥3; Rmi ≤7
Степень II: Средняя степень тяжести; проявляются головной болью и вертебробазилярной недостаточностью несколько раз в год, которая усиливается после поворота головы в начале болезни; оценка mRs = 1; Rmi = 8–13
Степень I: легкая; появление жалоб при легких физических нагрузках; оценка mRs = 1; Rmi = 14–15.
Предоперационное обследование включало КТ краниовертебральной области, КТ или магнитно-резонансную ангиографию позвоночных артерий, ультразвуковое исследование сегментов V3 позвоночных артерий с функциональными пробами.
Результаты хирургического лечения оценивали с использованием модифицированной шкалы результатов Глазго (GOS), mRs, Rmi и визуальной аналоговой шкалы (VAS). Качество декомпрессии позвоночных артерий оценивали с помощью КТ-ангиографии.Срок наблюдения – 1 год после операции.
Время операции, интраоперационная кровопотеря, а также клинические симптомы до и после операции сравнивались между группами PTMA и PMA.
Хирургическая техника
Пациент был помещен в положение лежа с фиксацией головы в раме Mayfield или жилете Halo во время операции. Кожные разрезы выполнялись под контролем рентгенографии в боковой и трансоральной проекциях. Мягкие ткани (кожа, подкожно-жировая клетчатка и апоневроз) разрезали скальпелем.Следующие пучки трапециевидных, полуостистых и больших задних мышц головы были разделены без разрезания с использованием тупой арахисовой диссекции. У всех пациентов был тонкий слой жировой ткани, расположенный чуть ниже большой задней прямой мышцы головы, покрывающий аномальный костный гребень. Трубчатый ретрактор для ран устанавливали с помощью системы дилататоров после визуализации ponticulus posticus с помощью операционного микроскопа (× 4–6) [].
Интраоперационный снимок.Тубулярный ретрактор вводится через трансмышечный доступ непосредственно к костному гребню
В дальнейшем костный гребень был аккуратно скелетирован со всех сторон, так как его неполное рассечение может привести к сильному кровотечению из венозных коллекторов, расположенных вокруг позвоночной артерии. С помощью высокоскоростной дрели была произведена резекция наружного коркового и губчатого слоев ponticulus posticus от sulcus arteriae vertebralis позвонка С1 до краниального края костного гребня.Внутренний кортикальный край резецировали губками Керрисона с последующим удалением оставшегося костного гребня просверливанием до боковой массы атласа. Основные этапы работы представлены в.
Интраоперационные изображения основных этапов декомпрессии позвоночной артерии. (а и б) Костный гребень точно скелетонирован с обеих сторон; (в) удаление костной ткани до внутреннего кортикального слоя с помощью высокоскоростной дрели; (г) резекция внутреннего кортикального слоя губками Керрисона; (д) выполняется декомпрессия позвоночной артерии.PP, ponticulus posticus; С1 – задняя дуга атласа; VA, позвоночная артерия; LM, верхнезадняя часть латеральной массы atlas
Между краями неполного костного гребня располагалась полоса окостеневшей фиброзной ткани. После выявления типа аномалии Киммерле костные фрагменты были сначала удалены с помощью высокоскоростной дрели, а затем аккуратно рассечена и удалена фиброзная полоса с помощью губок Керрисона и микроножниц с тупым концом.
РЕЗУЛЬТАТЫ
В группу ПМА вошли 3 пациентки в возрасте 30–58 лет.В группу ПТМА вошли 2 мужчины и 1 женщина в возрасте 20–58 лет.
Клиническая картина заболевания была следующей в группе ПТМА: III степень у 1, II у 1, I у 1 пациента. Среднее время операции составило 178,3 мин при средней кровопотере 300 мл. Внутриоперационных и послеоперационных осложнений не было. Уровень боли в послеоперационной ране в первые 3 дня после операции был минимальным или отсутствовал (ВАШ = 1). При наблюдении через 1 год обследование тяжести заболевания показало, что снижение до I степени было достигнуто у пациентов, ранее имевших III и II степени (модифицированный GOS = 8, mRs = 11, Rmi = 15).Клинические признаки компрессии позвоночной артерии полностью регрессировали после операции у 1 пациента с I степени тяжести заболевания (модифицированный GOS = 8, mRs = 0, Rmi = 15).
Клиническая картина заболевания была следующей в группе PMA: степень III у 1 пациента и II степень у 2 пациентов. Среднее время операции составило 230 минут при средней кровопотере 600 мл. Интраоперационных осложнений не было. Маргинальный некроз верхнего угла операционной раны в послеоперационном периоде возник у 1 пациента.Уровень боли в послеоперационной ране в первые 3 дня после операции был умеренно выраженным (ВАШ = 5 у двух пациентов и 6 у одного пациента). Благоприятное течение заболевания было подтверждено через 1 год после операции, выявив снижение тяжести заболевания до II степени у 1 пациента (ранее III степени; модифицированный GOS = 7, mRs = 2, Rmi = 13) и до I степени у 2 пациентов. (ранее II степень; модифицированный ГОС = 8, mRs = 1, Rmi = 15).
Клинический случай
Мы представляем случай 20-летнего пациента мужского пола, который был спортсменом-любителем, который заболел за 6 месяцев до госпитализации.Пациент страдал головной болью и вертебробазилярной недостаточностью, которые возникли при легкой физической нагрузке (I степень, mRs = 1, Rmi = 15). Частота и интенсивность приступов постоянно увеличивались, несмотря на консервативное лечение. КТ шейного отдела позвоночника выявила аномалию Киммерле в виде неполного костного гребня с обеих сторон и сдавления левой позвоночной артерии []. При ультразвуковом исследовании сегментов V3 позвоночных артерий и функциональных пробах выявлено снижение линейной скорости кровотока при вращении головы на противоположной стороне.
Компьютерная томография краниовертебральной области пациента с аномалией Киммерле до (а) и после (б) операции. Красные стрелки указывают на неполный ponticuli posticus
Пациенту была выполнена малоинвазивная декомпрессия сегментов V3 обеих позвоночных артерий []. Полоса окостеневшей фиброзной ткани, сдавливающая позвоночную артерию, обнаружена интраоперационно с обеих сторон. В послеоперационный период осложнений и болевого синдрома не было.Данные контрольного послеоперационного обследования свидетельствуют об освобождении позвоночной артерии и отсутствии костного гребня []. Пациент был выписан через 7 дней после операции, а контрольное обследование через 1 год выявило полный регресс всех клинических симптомов (модифицированный GOS = 8, mRs = 0, Rmi = 15).
ОБСУЖДЕНИЕ
Основными патогенными факторами развития клинических симптомов у пациентов с аномалией Киммерле являются: экстравазальное сжатие позвоночной артерии, длительная травма адвентиции сосуда, а также раздражение паравазальных симпатических нервов и др. ветви затылочного нерва.[7,9] Клинические симптомы аномалии Киммерле разнообразны: головная боль, головокружение, шум в ушах, преходящие нарушения слуха и зрения, усталость, нарушения сна, неустойчивая походка, дроп-атаки, панические атаки, беспокойство или астма, онемение рук и судороги. . [7,9,11,12,13,14] Такие пациенты часто длительное время получают неэффективную симптоматическую терапию, если не проводится своевременная визуализация краниовертебральной области (с помощью КТ или МРТ). Все пациенты нашего исследования находились под наблюдением невролога.Трое пациентов получали консервативное лечение более 2 лет, 2 пациента – 1,5 года и 1 пациент – около 6 месяцев до поступления в нейрохирургическое отделение. Нехирургическое лечение и физиотерапия во всех случаях оказались неэффективными; кроме того, у пяти пациентов наблюдалось усиление вертебробазилярных симптомов.
Показаниями к хирургическому лечению в нашем исследовании были: Неэффективное консервативное лечение и изменение гемодинамики в позвоночных артериях при повороте головы по результатам ультразвукового исследования с функциональными пробами.
Имеется очень мало опубликованных статей, посвященных хирургическому лечению, направленному на удаление ponticuli posticus. [5,8,9,10] Авторы использовали стандартный доступ по средней линии с разрезом от затылочного выступа до остистого отростка C3 позвонка. с резекцией задней дуги атланта или заднего костного гребня атласа с обеих сторон. Высокоэффективная скорость регресса симптомов при хирургическом лечении составляет 90%.
В нашем исследовании мы применили описанный выше метод хирургического лечения у трех пациентов (группа ПМА) и достигли благоприятного исхода с уменьшением интенсивности и частоты приступов заболевания.Однако все пациенты страдали болями в области послеоперационной раны до 6 баллов по ВАШ из-за операционной травмы. Этот симптом боли сохранялся в течение 3 недель после операции. Длина кожного разреза не менее 12 см; кроме того, необходимо было выполнить широкое вскрытие затылочной кости (не менее 3 см от средней линии) и дуги С2 позвонка с полным рассечением фасеточного сустава для оптимальной визуализации аномальных костных гребней. Другой недостаток заднего доступа по средней линии – невозможность прямого доступа к костному гребню.Визуализация ponticuli posticus, несмотря на тип используемого ретрактора для ран, всегда выполнялась под углом к сагиттальной плоскости, что не способствовало полному исследованию латерального края костного гребня. Тяжелая кровопотеря из поврежденных венозных сосудов вокруг позвоночной артерии произошла в 2 случаях из-за неправильной визуализации posticus ponticuli.
У трех других пациентов (группа PTMA) мы использовали паравертебральный чрескожный доступ с расширительной системой и трубчатым ретрактором ран.Преимущества такого подхода – минимальная травма шейных мышц, небольшой участок скелетонизации и небольшой кожный разрез. У всех пациентов после малоинвазивной декомпрессии позвоночной артерии отмечен низкий балл боли в области операционной раны (среднее значение ВАШ = 1). Другими преимуществами чрескожного доступа являются прямая визуализация ponticuli posticus с возможностью полного наблюдения за его латеральными и медиальными краями, что позволило более точно рассечь и предотвратить повреждение паравазальных венозных бассейнов.
Таким образом, мы прооперировали шесть пациентов с компрессией позвоночной артерии из-за аномалии Киммерле. Кровопотеря, время операции и интенсивность боли были ниже в группе ПТМА. Отсроченные результаты хирургического лечения не зависели от хирургического метода декомпрессии артерии. Все пациенты имели благоприятное течение болезни с точки зрения регресса неврологического дефицита и уменьшения частоты приступов болезни.
ВЫВОДЫ
Хирургическое лечение компрессии позвоночной артерии у пациентов с аномалией Киммерле предпочтительнее в случаях, когда консервативное лечение неэффективно.Минимально инвазивный PTMA является альтернативой стандартному срединно-заднему доступу, который позволяет напрямую визуализировать сжатый сегмент V3 позвоночной артерии, уменьшить кровопотерю и время операции, а также минимизировать послеоперационную боль.
Заявление о согласии пациента
Авторы удостоверяют, что они получили все соответствующие формы согласия пациента. В той форме, в которой пациент (-и) дал / дал (-а) свое согласие на публикацию его / ее / их изображений и другой клинической информации в журнале.Пациенты понимают, что их имена и инициалы не будут опубликованы, и будут предприняты соответствующие усилия, чтобы скрыть их личность, но анонимность не может быть гарантирована.
Финансовая поддержка и спонсорство
Нет.
Конфликт интересов
Конфликта интересов нет.
Благодарности
Мы хотели бы поблагодарить Editage (www.editage.com) за редактирование на английском языке.
СПИСОК ЛИТЕРАТУРЫ
1. Сеноглу М., Гюмюшалан Ю., Юксель К.З., Узел М., Челик М., Озбаг Д. и др.Влияние заднего мостовидного протеза C-1 на хирургию краниовертебрального перехода. J Neurosurg Spine. 2006; 5: 50–2. [PubMed] [Google Scholar] 2. Ким MS. Анатомический вариант атласа: дугообразное отверстие, оккпитализация атласа, дефект задней дуги атласа. J Korean Neurosurg Soc. 2015; 58: 528–33. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Afsharpour S, Hoiriis KT, Fox RB, Demons S. Анатомическое исследование дугообразного отверстия и его клинические последствия: отчет о случае. Chiropr Man Therap. 2016; 24: 4.[Бесплатная статья PMC] [PubMed] [Google Scholar] 4. Эллиотт Р. Э., Танвир О. Распространенность ponticulus posticus (дугообразное отверстие) и его значение в процедуре Гель-Хармса: метаанализ и обзор литературы. World Neurosurg. 2014; 82: e335–43. [PubMed] [Google Scholar] 5. Луцик А.А., Пеганов А.И., Казанцев В.В., Раткин И.К. Вертебробазилярная недостаточность из-за костных аномалий краниовертебрального перехода. Hir Pozvonoc. 2016; 13: 49–55. [Google Scholar] 6. Гуляев С.А., Кулагин В.Н., Архипенко И.В., Гулаева С.Е.Клинические проявления и лечение аномалии Киммерле. RMJ. 2013; 16: 866–8. [Google Scholar] 7. Буна М., Коглан В., ДеГручи М., Уильямс Д., Змийвски О. Статьи атласа: обзор и клиническая перспектива. J Manipulative Physiol Ther. 1984; 7: 261–6. [PubMed] [Google Scholar] 8. Тедески Г. Хирургическое исследование нарушения позвоночного кровотока из-за аномалии Киммерле. J Neurosurg Sci. 1979; 23: 235–8. [PubMed] [Google Scholar] 9. Чертков А.К., Климов М.Е., Нестерова М.В. О хирургическом лечении пациентов с вертебробазилярной недостаточностью, ассоциированной с аномалией Киммерле.Hir Pozvonoc. 2005; 1: 69–73. [Google Scholar] 10. Лимузен CA. Foramen arcuale и синдром Барре-Лье. Его хирургическое лечение. Int Orthop. 1980; 4: 19–23. [PubMed] [Google Scholar] 11. Риос Л., Мата-Эсколано Ф., Бланко-Перес Э., Ллидо С., Бастир М., Санчис-Химено Я.А. и др. Острая головная боль, связанная с хлыстовой травмой в дугообразных и не дугообразных отверстиях. Eur Spine J. 2017; 26: 1262–5. [PubMed] [Google Scholar] 12. Тейлор В.Б., 3-й, Вандергриф С.Л., Опатовски М.Дж., Лейтон К.Ф. Синдром Боухантера диагностирован с помощью провокационной цифровой субтракционной церебральной ангиографии.Proc (Bayl Univ Med Cent) 2012; 25: 26–7. [Бесплатная статья PMC] [PubMed] [Google Scholar] 13. Сплит В., Саврасевич-Рыбак М. Клинические симптомы и признаки аномалии Киммерле. Виад Лек. 2002; 55: 416–22. [PubMed] [Google Scholar] 14. Mudit G, Srinivas K, Satheesha R. Ретроспективный анализ ponticulus posticus у индийских ортодонтических пациентов – латеральное цефалометрическое исследование. Эфиоп J Health Sci. 2014; 24: 285–90. [Бесплатная статья PMC] [PubMed] [Google Scholar]РАЗУМНО И ЭФФЕКТИВНО?
Хирургическое лечение аномалии Киммерле:
Насколько это разумно и эффективно?
А.Айрапетян, В. Лукьянчиков, И. Львов, А. Гринь, В. Крылов
НИИ скорой помощи им. Склифосовского, Москва, Россия
ВВЕДЕНИЕ
Аномалия Киммерле состоит из костного моста между суставным отростком C1 и его
задняя дуга или поперечный отросток атласа. Этот мост образует патологический канал
с сосудистыми и нервными структурами, такими как позвоночная артерия, позвоночная вена и, иногда,
, затылочный нерв.Компрессия этого сосудисто-нервного пучка приводит к
неврологическому дефициту. Сообщения о хирургическом лечении аномалии Киммерле
крайне редки.
ЦЕЛИ
Оценить отдаленные результаты хирургического лечения пациентов с аномалией Kimmerle
.
Рис. 1. КТ пациента с аномалией Kimmerle
. Позвоночная артерия в foramen arcuale =
ponticulus posticus (PP) или ponticulus lateralis
(PL).
VA
МЕТОДЫ
Тринадцать пациентов с аномалией Киммерле прошли курс лечения с 2015 по 2018 год. Средний возраст составил 42 года (диапазон 20–66). У
пациентов были головные боли с радиацией в глаза или наружный слуховой проход, симптомы вертебробазилярной недостаточности и / или
вегетативного синдрома в виде панических атак. У двух пациентов был синдром охотников с луком.
Клиническая эффективность оценивалась с использованием шкалы Рэнкина, индекса подвижности Ривермида, индекса инвалидности шеи и шкалы SF-36.Все
пациента прошли консервативную терапию без положительных эффектов в течение как минимум 6 месяцев до поступления. Четверо пациентов перенесли
рутинных операций с использованием заднего срединного доступа, в то время как другим 9 была выполнена декомпрессия сегмента V3 позвоночной артерии
через паравертебральный трансмышечный доступ с использованием тубулярного ретрактора. В 4 случаях использовалась нейронавигация.
Рисунок 2.
Фотография во время операции.
Задняя срединная линия
Доступ.
Затылочная кость (OC),
задняя дуга Атласа
(C1), ось (C2), диссектор
на латеральном крае костного гребня
(белый указатель
). Ограничения –
плохой осмотр бокового края
, травма шейных мышц
, расширенный кожный разрез
.
OC
C1
C2
Рисунок 3.Интраоперационное фото. Минимально инвазивная техника. Размещение трубчатого ретрактора.
Рисунок 4. Внутриоперационное фото. Минимально инвазивная техника. А – с помощью ультразвукового датчика (черная стрелка) для измерения кровотока в позвоночной артерии до и после входа
в аркуальное отверстие; Б – рассечение костного моста; В – удаление кости фрезой; D – удаление кости по Керрисону; Д – исследование кровотока позвоночной артерии после декомпрессии
.
РЕЗУЛЬТАТЫ
Результаты хирургического лечения оценивали при выписке и через 4-24 месяца после операции.Неврологический дефицит улучшился в
10 случаях. У 2 пациентов не было улучшения, а в 1 случае уменьшилась только С1-боль. Послеоперационных
осложнений не было.
ВЫВОДЫ
Хирургическое лечение компрессии позвоночной артерии у пациентов с аномалией Киммерле может быть предпочтительным в случаях, когда консервативное лечение
неэффективно. Минимально инвазивный паравертебральный трансмышечный доступ является альтернативой стандартному срединно-заднему доступу
.Для отбора пациентов для хирургического лечения необходимо сотрудничество с неврологами.
КОНТАКТНАЯ ИНФОРМАЦИЯ
Артем Айрапетян, e-mail: dr.airapetian.a.a@gmail.com Тел .: +720568; Иван Львов, e-mail: dr.speleolog@gmail.com Тел .: +79265760074;
Эндрю Грин, e-mail: aagreen@yandex.ru
VA
C1
A B C D E
(PDF) Минимально инвазивное хирургическое лечение аномалии Киммерле
Львов и др.: Аномалия Киммерле и малоинвазивная хирургия
362 Журнал краниовертебрального соединения и позвоночника / Том 8 / Выпуск 4 / октябрь-декабрь 2017 г.
ОБСУЖДЕНИЕ
Основными патогенными факторами развития клинических
симптомов у пациентов с аномалией Киммерле являются следующим образом:
экстравазальное сдавление позвоночной артерии, долговременная
травма адвентиции сосуда, а также раздражение паравазальных симпатических нервов
и ветвей затылочного нерва
.[7,9] Клинические симптомы аномалии Киммерле включают
переменных: головная боль, головокружение, шум в ушах, преходящий слух и
расстройства зрения, усталость, нарушения сна, неустойчивая походка,
приступов паники, панических атак, беспокойства или астмы, онемение
рук и судороги. [7,9,11‑14] Такие пациенты часто получают
неэффективной симптоматической терапии длительное время при своевременной
визуализации краниовертебральной области (с помощью КТ или МРТ)
. Не выполнена.Все пациенты в нашем исследовании находились под наблюдением невролога
. Три пациента получали консервативное лечение
более 2 лет, 2 пациента –
1,5 года и 1 пациент – около 6 месяцев до госпитализации
в отделение нейрохирургии. Нехирургическое лечение и физиотерапия
оказались неэффективными во всех случаях; кроме того, у пяти
пациентов отмечалось усиление вертебробазилярных симптомов.
Показаниями к хирургическому лечению в нашем исследовании были следующие
: Неэффективное консервативное лечение и изменения гемодинамики
в позвоночных артериях при повороте головы
по результатам ультразвукового исследования
с функциональными пробами.
Имеется очень мало опубликованных статей, касающихся хирургического лечения
, посвященного удалению ponticuli posticus. [5,8‑10]
Авторы использовали стандартный доступ по средней линии с разрезом
от затылочного выступа до остистого отростка
позвонка С3 с резекцией задней дуги атласа
или заднего костного гребня атласа с обеих сторон. Высокоэффективная скорость регресса симптомов
при хирургическом лечении
составляет 90%.
В нашем исследовании мы использовали вышеуказанный метод хирургического лечения у трех
пациентов (группа ПМА) и достигли благоприятного исхода
с уменьшением интенсивности и частоты
приступов заболевания. Однако все пациенты страдали болью в области
«послеоперационной» раны с оценкой по ВАШ
из-за оперативной травмы. Этот болевой симптом оставался
в течение 3 недель после операции. Длина кожного разреза
не менее 12 см; кроме того, необходимо было выполнить широкое отверстие
затылочной кости (не менее 3 см от средней линии)
и дуги С2 позвонка с полным рассечением
фасеточного сустава для оптимальной визуализации аномального
костные гребни.Другой недостаток метода доступа
по средней линии заднего отдела заключается в том, что невозможно выполнить прямой доступ
к «костному гребню». Визуализация «позвоночника»
posticus, несмотря на тип Ретрактор
всегда использовался под углом к сагиттальной плоскости, что не способствовало полному обследованию бокового края костного гребня
.
Тяжелая кровопотеря из поврежденных венозных сосудов вокруг позвоночной артерии
произошла в 2 случаях из-за несоответствующей
визуализации posticus ponticuli.
Мы использовали паравертебральный чрескожный доступ с расширительной системой
и трубчатым ретрактором раны у остальных
трех пациентов (группа PTMA). Преимуществами такого подхода
являются минимальная травма шейных мышц, небольшая зона скелетонизации
и небольшой разрез кожи. Низкий балл боли
в области операционной раны (в среднем
ВАШ = 1) «наблюдался» у всех пациентов после «минимально-инвазивной» декомпрессии позвоночной артерии
.Другими преимуществами трансмышечного доступа
являются прямая визуализация
ponticuli posticus с возможностью полного обзора
его латеральных и медиальных краев, что позволило провести более точное рассечение
и предотвратить повреждение паравазальных вен
бассейнов.
Таким образом, мы прооперировали 6 пациентов с компрессией позвоночной артерии
из-за аномалии Киммерле. Кровопотеря, время операции
и интенсивность боли были ниже в группе PTMA
.Отсроченные результаты хирургического лечения
не зависели от хирургического метода декомпрессии артерий. Все
больных имели благоприятное течение болезни с точки зрения регресса неврологического дефицита
и снижения частоты
приступов.
ВЫВОДЫ
Хирургическое лечение компрессии позвоночной артерии у
пациентов с аномалией Киммерле предпочтительнее в случаях, когда консервативное лечение
неэффективно.Минимально инвазивный метод
PTMA является альтернативой стандартному срединно-заднему доступу
, который позволяет напрямую визуализировать сжатый сегмент
V3 позвоночной артерии, уменьшение количества кровяных потерь и
время операции и сводит к минимуму послеоперационную боль.
Заявление о согласии пациента
Авторы удостоверяют, что они получили все соответствующие формы согласия пациента
. В форме
пациенты дали свое согласие на публикацию своих изображений и другой клинической информации
в журнале.Пациенты
понимают, что их имена и инициалы не будут опубликованы
и будут приложены все усилия, чтобы скрыть их личность, но анонимность
не может быть гарантирована.
Благодарности
Мы хотели бы поблагодарить Editage (www.editage.com) за редактирование на английском языке
.
Общие сведения о Ponticulus Posticus – Caring Medical Florida
Росс Хаузер, Мэриленд. Центр шеи Хаузера, Caring Medical Florida
Брайан Р.Хатчесон, округ Колумбия. Центр шеи Хаузера, Caring Medical Florida
Ваш врач рассказал вам о ponticulus posticus. Возможно, он сказал вам, что это довольно редкое заболевание, которое может быть или не быть причиной ваших проблем со здоровьем. Но вы хотели узнать больше, потому что это может быть причиной головной боли, мигрени, двоения в глазах, головокружения или орофациальной (рот и лицо) боли.
Что такое Ponticulus Posticus
При прогрессирующей нестабильности шейного отдела позвоночника и проблемах с шеей, и, казалось бы, без альтернативы, задняя атланто-затылочная связка трансформируется в костную структуру, «мост» через отверстие в последней попытке предотвратить компрессию позвоночной артерии и подзатылочного нерва.Последний шанс побороть нестабильность шейки матки.
На этом кадре из видеообъявления доктор Хаузер показывает развитие Ponticulus Posticus на цифровом рентгеновском снимке пациента. Доктор Хаузер объясняет, что, казалось бы, без альтернативы задняя атланто-затылочная связка превратилась в костную структуру, которая «перебросила мост» через отверстие в последней попытке предотвратить компрессию позвоночной артерии и подзатылочного нерва.
Задняя атланто-затылочная связка защищает борозду, в которой проходит позвоночная артерия в точке С1.«Ponticulus posticus» – это «маленький задний мостик», который пытается предотвратить компрессию позвоночной артерии и подзатылочного нерва –
Ponticulus posticus, также называемый дугообразным отверстием или аномалией Киммерла, – это латинское название, подразумевающее «Ponticulus posticus», «маленький задний мостик». Как вы развили эту аномалию костного маленького моста в задней части атлантического позвонка / С1 позвонка?
Проще говоря, костлявый мостик – это окаменевшая связка. Но вместо того, чтобы связка превратилась в камень, связка превратилась в кость.В частности, ponticulus posticus образовался в результате окостенения задней атланто-затылочной связки. Почему это случилось?
Задняя атланто-затылочная связка защищает борозду, в которой проходит позвоночная артерия в точке С1. При нестабильности верхнего отдела шейки матки, особенно в области C1 или Atlas , могут быть сдавлены позвоночная артерия и подзатылочный нерв , которые проходят через отверстие (отверстие) C1. Связка, которая недостаточно прочна, чтобы защитить это отверстие, если присутствует нестабильность, постоянно ослабевает и повреждается при попытке обеспечить эту защиту.По-видимому, без альтернативы связка трансформируется в костную структуру, которая «перекидывает мост» через отверстие в последней попытке предотвратить сжатие позвоночной артерии и подзатылочного нерва. Это, конечно, не оптимально для пациента. Связки служат для обеспечения сильного, естественного движения шейки матки, когда связка превращается в кость, она создает свое собственное сращение, например, с костными шпорами.
Возможно, вы узнали о posticulus posticus на случайной МРТ или компьютерной томографии – это могло быть проигнорировано или могло быть причиной ваших симптомов.
Многие люди, как, наверное, и вы, узнали о posticulus ponticulus во время случайной МРТ или компьютерной томографии. Это означает, что никто этого не искал, но маленький костлявый мостик обнаружился у вашего С1 на снимке.
На видео ниже Росс Хаузер, доктор медицины, объясняет: Краткая расшифровка стенограммы находится под видео:
- Ponticulus posticus можно не заметить на рентгеновских снимках и даже на цифровом движущемся рентгеновском аппарате (DMX), и часто от него просто отказываются как от своего рода нормального варианта.В нашем кабинете у некоторых пациентов мы видим ponticulus posticus. Для многих из них это не нормальный вариант, а причина многих проблемных симптомов. ( Головная боль, мигрень , двоение в глазах , головокружение или орофациальная (рот и лицо) боль.)
- В 0:40 видео структура ponticulus posticus идентифицирована на цифровом рентгеновском снимке движения пациента.
- Постикусный мостик окружен множеством жизненно важных структур, таких как позвоночная артерия и подзатылочный нерв.Эти структуры могут быть сдавлены или сдавлены ponticulus posticus, поэтому мы не рассматриваем это как нормальный вариант для многих людей.
- У этого конкретного пациента ponticulus posticus только с правой стороны. У некоторых людей ponticulus posticus развивается с обеих сторон шейного отдела позвоночника. У этого человека, находящегося на правом боку, развиваются симптомы, такие как лицевая боль справа, мигрень и т. Д.
- В 1:13 видео пациент начинает двигать шеей, чтобы мы могли увидеть его шейный отдел позвоночника в движении.
- В месте расположения на позвонке С1 или в верхнем сочленении с заднебоковой частью атласа (С1) вы можете увидеть, как движения шеи этого пациента постикусный мостик может соприкасаться с нервным корешком С1 с правой и с правой стороны. позвоночная артерия. Таким образом, когда этот пациент наклоняется вперед или назад, вы могли видеть, что ponticulus posticus приближается к затылку одним из движений и приближается к атласу одним из движений, что означает, что на той стороне, где он находится, есть суженное пространство и сдавление позвоночной артерии и нервного корешка С1.
- Особо следует отметить, что нерв C1 иннервирует твердую мозговую оболочку, которая покрывает мозг, поэтому, если у вас есть необъяснимая боль справа (как у этого пациента) или глубокая боль, странная боль, например, между бровями или в лице, или мигренозные головные боли с одной стороны могут быть связаны с Ponticulus posticus.
Позвоночная артерия проходит в поперечном отверстии шейных позвонков. Если шейные позвонки слишком сильно двигаются, вы можете сдавить артерию, которая снабжает кровью около 1/3 головного мозга.
Исследование: Ponticulus Posticus у симптомных и бессимптомных пациентов
Как упоминалось выше, возможно, вы узнали о ponticulus posticus на случайной МРТ или компьютерной томографии – это могло быть проигнорировано или могло быть причиной ваших симптомов. На изображении DMX, которое мы видели в приведенном выше видео, мы видели, как ponticulus posticus может воздействовать на нервный корешок C1 и позвоночную артерию. Это не всегда легко сделать. Понтикулус постикус
Цель этого исследования состояла в том, чтобы подтвердить, является ли ponticulus posticus возможной причиной хронических головных болей напряжения и мигрени.
В статье Journal of Clinical and Diagnostic Research , ( 1 ) исследователи исследовали распространенность и морфологические (взаимодействие между костями, нервами и структурами мягких тканей) особенности ponticulus posticus у симптомных и бессимптомных пациентов. Цель этого исследования состояла в том, чтобы подтвердить, является ли постикулярный мостик возможной причиной хронических головных болей напряжения и мигрени.
Это исследование относится к:
- Partial Ponticulus Posticus – односторонний односторонний
- Complete Ponticulus Posticus – двусторонний – с обеих сторон
Исследователи обследовали пятьсот пациентов на предмет наличия и типа ponticulus posticus. Все пациенты, у которых ponticulus posticus присутствовал в частичной или полной форме, были дополнительно изучены на предмет наличия таких симптомов, как хроническая головная боль напряжения, орофациальная боль или диагностированная мигрень.
- Среди выборки из 500 случаев частичный ponticulus posticus был обнаружен у 302 пациентов (60%) (мужчины 48% и женщины 52%).
- Полный вариант был обнаружен в 40 случаях (8%) (65% мужчин и 35% женщин, которые были в возрастной группе 16-45 лет),
- При частичном Ponticulus Posticus у 42 пациентов (14%) были обнаружены симптомы.В полной форме у 32 пациентов (78%) обнаружена симптоматика.
- Симптомы были в основном в виде мигрени или хронической головной боли.
Исследователи пришли к выводу: «Согласно нашему исследованию, частичная форма ponticulus posticus оказалась более распространенной по сравнению с полной формой в (исследуемой) популяции, а полная форма ponticulus posticus может рассматриваться как возможная причина хронического типа напряжения. головная боль, орофациальная боль и мигрень.
Хирургическое и безоперационное лечение
Существует не так много исследований о том, как лечить ponticulus posticus. Как отмечалось выше, для многих врачей это случайное открытие и не требует лечения. Это верно не для всех пациентов.
Вот исследование от декабря 2017 года, опубликованное в журнале Journal of Craniovertebral Junction and Spine . ( 2 ) Здесь хирурги обсуждают ponticulus posticus, описанный как аномалия Киммерла.
Очков обучения:
- Сообщения о хирургическом лечении аномалии Киммерле редки.
- Хирургическое лечение компрессии позвоночной артерии у пациентов с аномалией Киммерле предпочтительнее в случаях, когда консервативное лечение неэффективно. Минимально инвазивная процедура может быть альтернативой стандартной открытой хирургической операции.
Ponticulus lateralis и компрессия позвоночной артерии
Та же исследовательская группа опубликовала второе исследование в сентябре 2018 года. ( 3 ) В журнале World Neurosurgery хирурги сделали следующие наблюдения:
Пояснительное примечание: термин латеральный ponticulus относится к тому случаю, когда костный мост ponticulus posticus берет вертикальный шип вверх, чтобы непосредственно сжать позвоночную артерию.
- В некоторых случаях костный гребень может также образовываться на уровне позвоночной артерии, выходящей из поперечного отростка С1 позвонка (это латеральный мостик). Одновременное одностороннее образование ponticulus lateralis и ponticulus posticus очень редко. Данных о хирургическом лечении компрессии позвоночной артерии латеральным ponticulus нет.
В этом исследовании демонстрируется случай с 34-летней женщиной, у которой было сильное головокружение до потери сознания при повороте головы влево.Компьютерная томографическая ангиография шейного отдела позвоночника выявила аномалию С1 с образованием ponticulus lateralis и ponticulus posticus с остроугольным С-образным перегибом позвоночной артерии.
- У этой пациентки хирургическое вмешательство помогло избавиться от боли, сняв компрессию спинномозгового корешка С1 и облегчив синдром охотника за луком (потеря сознания), когда она повернула голову.
- Хирурги этого исследования предположили, что это был первый отчет о хирургическом лечении компрессии позвоночной артерии из-за латерального ponticulus и posticulus ponticulus.
Следует отметить, что хирургическое вмешательство, особенно в отношении латерального ponticulus lateralis и ponticulus posticus, требует мало исследований и редко проводится.
Синдром охотника с луком
У меня обширная статья: Лечение вертебробазилярной недостаточности – синдром охотника за луком. Каждый раз, когда я поворачиваю голову, у меня кружится голова. Иногда я почти теряю сознание. Здесь я обсуждаю сложность и проблемы лечения нестабильности шейки матки, которые полностью проявляются в спорах и недоразумениях, связанных с диагнозом вертебробазилярной недостаточности, также называемой недостаточностью вертебробазилярной артерии или синдромом Боу-Хантера.Как пациент, у которого диагностирован один из этих диагностических тегов, вы, вероятно, не понаслышке знаете, что ваш путь лечения прошел много поворотов. Некоторые верны, некоторые нет, но поскольку вы читаете эту статью, ваш путь исцеления, вероятно, далек от завершения.
Безоперационное лечение
Как обсуждалось в этой статье, между ponticulus posticus и вашими симптомами может существовать связь, которая может включать в себя обморок при повороте головы на бок, мигренозные головные боли, лицевые боли, нарушения зрения и другие проблемы.Так что для многих людей это открытие не является благоприятным, и оно может стать важным открытием в решении ваших конкретных проблем.
Определение притока крови к мозгу
В Центре шеи Hauser при Caring Medical Florida мы можем использовать транскраниальный допплер (TCD) и экстракраниальный допплер (ECD) ультразвуковое исследование для оценки надлежащего кровотока при изменении положения шеи.
На этом видео a, когда пациент находится в нейтральном положении, голова поднята и смотрит прямо вперед, можно увидеть и услышать кровоток по артериям.Когда пациента просят вытянуть голову назад и влево, можно услышать четкую и слышимую разницу в кровотоке. Это демонстрируется в начале видео.
Определение того, в каком положении головы происходит снижение кровотока, может помочь нам в выборе лечения вертебробазилярной недостаточности. В случае с этой статьей, давит ли ponticulus posticus на позвоночную артерию, если да, то в каком положении головы? На видео выше мы видели, как ponticulus posticus ударяется о затылок у основания черепа и C1.
Демонстрация нехирургического варианта лечения пролотерапией
Caring Medical опубликовала десятки статей о инъекциях пролотерапии как о лечении трудно поддающихся лечению заболеваний опорно-двигательного аппарата. В этой статье пролотерапия демонстрируется как лечение нестабильности верхних отделов шейки матки в случаях ponticulus posticus и без ponticulus posticus.
Пролотерапия называется регенеративной инъекционной техникой (RIT), потому что она основана на предпосылке, что процесс регенеративного / репаративного заживления может восстанавливать и восстанавливать поврежденные структуры мягких тканей.Это простая инъекционная процедура, которая решает очень сложные проблемы.
Это видео переходит к 1:05, где начинается собственно лечение.
У этого пациента лечится область C1-C2. Росс Хаузер, доктор медицины, делает уколы.
На видео ниже DMX отображает пролотерапию до и после процедур, решивших проблемы защемления нерва в шейном отделе позвоночника.
- В этом видео мы используем Digital Motion X-Ray (DMX), чтобы проиллюстрировать полное разрешение защемленного нерва на шее и сопутствующих симптомов шейной радикулопатии.
- A до цифрового рентгеновского снимка в 0:11
- В 0:18 DMX выявляет полностью закрытые нервные отверстия и частично закрытые нервные отверстия
- В 0:34 DXM через три месяца после того, как этот пациент получил две пролотерапии
- В 0:46 ранее полностью закрытые нервные отверстия теперь открываются больше, снижая давление на нерв
- В 1:00 еще один DMX два месяца спустя и после того, как этот пациент получил четыре пролотерапии
- В 1:14 ранее полностью закрытые нервные отверстия теперь нормально открываются во время движения
Если у вас есть вопросы и вы хотите обсудить проблемы с шейным отделом позвоночника с нашими сотрудниками
, вы можете получить помощь и информацию у нас . 1 Читрода П.К., Катти Г., Баба И.А., Наджмудин М., Гали С.Р., Калмат Б., Г. В. Ponticulus posticus на задней дуге атласа, анализ распространенности у пациентов с симптомами и бессимптомными из популяции гулбарга. J Clin Diagn Res. 2013 декабрь; 7 (12): 3044-7. DOI: 10.7860 / JCDR / 2013 / 6795.3847. Epub, 2013, 15 декабря. PMID: 24551723; PMCID: PMC3919343. [Google Scholar]
2 Львов И., Лукьянчиков В., Гринь А., Сытник А., Полунина Н., Крылов В. Минимально инвазивное хирургическое лечение аномалии Киммерле.J Craniovertebr Junction Spine. 2017 октябрь-декабрь; 8 (4): 359-363. DOI: 10.4103 / jcvjs.JCVJS_73_17. PMID: 29403250; PMCID: PMC5763595. [Google Scholar]
3 Лукьянчиков В., Львов И., Гринь А., Кордонский А., Полунина Н., Крылов В. Минимально инвазивное хирургическое лечение компрессии позвоночной артерии у пациента с односторонним Ponticulus Posticus и Ponticulus Lateralis. Мировая нейрохирургия. 2018 1 сентября; 117: 97-102. [Google Scholar]
2291
Возможность установки транспедикулярного винта C1 у пациентов с ponticulus posticus: ретроспективный анализ одиннадцати пациентов
Предпосылки
Ponticulus posticus – распространенная анатомическая вариация, которую можно принять за широкую заднюю дугу во время установки транспедикулярного винта C1.Когда винты для латеральных масс атласа вводятся через заднюю дугу, это может привести к повреждению позвоночной артерии. Насколько нам известно, существует несколько клинических исследований, в которых анализировалась возможность фиксации транспедикулярного винта С1 у пациентов с ponticulus posticus в клинической практике.
Цель
Оценить возможность установки транспедикулярного винта С1 у пациентов с ponticulus posticus.
Методы
В период с января 2008 г. по январь 2012 г. 11 последовательных пациентов с атлантоаксиальной нестабильностью и постикусным мостиком на уровне С1 перенесли операцию заднего спондилодеза в нашем учреждении.По данным предоперационной компьютерной томографии (КТ) реконструкции, полный ponticulus posticus был обнаружен односторонне у девяти пациентов и двусторонне – у двух. Послеоперационная КТ-реконструктивная визуализация была проведена для оценки успешности установки транспедикулярного винта С1. Пациенты наблюдались через регулярные промежутки времени и оценивались на предмет наличия симптомов синдрома ponticulus posticus.
Результаты
Тринадцать ножек C1 (канавка атласной позвоночной артерии), каждая с полным ponticulus posticus, были успешно вставлены с помощью тринадцати 3.Педикулярные винты диаметром 5 или 4,0 мм без резекции костной аномалии. Никаких интраоперационных осложнений (повреждение венозного сплетения, позвоночной артерии или спинного мозга) не произошло. Средний срок наблюдения составил 21 (от 14 до 30) месяц. Послеоперационные реконструктивные изображения КТ показали, что все 13 транспедикулярных винтов были вставлены в ножки С1 без разрушения кортикальной кости ножки атласа. В течение периода наблюдения ни у одного из пациентов не было клинических симптомов синдрома ponticulus posticus или развития костного сращения.
Заключение
Перед установкой транспедикулярного винта C1 у пациентов с ponticulus posticus следует рассмотреть возможность трехмерной компьютерной томографии, чтобы не ошибочно принять ponticulus posticus за расширенную дорсальную дугу атласа. Если до операции нет синдрома ponticulus posticus, можно успешно провести фиксацию транспедикулярного винта C1 без удаления костной аномалии.
Первый шейный позвонок – обзор
Региональные характеристики позвонков
Типичный шейный позвонок находится в середине сегмента, например, C3 – C6 (рис.7-6). C1 атлас, C2 ось и C7 нетипичны и будут рассмотрены отдельно.
Рисунок 7-6. Типичный шейный позвонок взрослого человека: (A) верхний; (B) задний; (C) передний; (D) боковой.
Типичный шейный позвонок имеет относительно небольшое тело, которое в поперечной плоскости шире, чем в переднезадней плоскости. Его верхняя поверхность вогнутая в поперечном направлении и слегка выпуклая в переднезаднем направлении. Боковые стороны верхней поверхности возвышаются до двух боковых губ или крючковидных отростков , которые являются участками мелких синовиальных суставов, унковертебральных суставов (по Luschka).Сообщается, что эти суставы отсутствуют при рождении, но развиваются примерно к 6 годам, что позволяет межпозвоночному диску поддерживать вращательную функцию в гармонии с межпозвоночными суставами (Boreadis and Gershon-Cohen, 1956; Penning, 1988). С возрастом в этих суставах часто наблюдается остеоартрит, и это может привести к сужению межпозвонкового отверстия с последующим раздражением корней шейных спинномозговых нервов (Cave et al., 1955).
Нижняя поверхность шейного отдела тела вогнутая переднезадняя и слегка выпуклая в поперечной плоскости.Тело неглубокое по высоте, передняя нижняя граница выступает вниз, так что при сочленении двух позвонков она сцепляется с телом нижнего позвонка.
Тела приподняты по средней линии кпереди для прикрепления передней продольной связки, а сбоку от нее имеются две мышечные впадины для прикрепления передних глубоких мышц шеи. Эта связочная область более узкая в верхних шейных позвонках и становится шире по мере опускания колонны, что указывает на то, что связка шире внизу и более похожа на шнур сверху.
Поперечный отросток содержит отверстий transversarium для прохождения позвоночной артерии и связанных с ней венозных и постганглионарных симпатических нервных сплетений. В некоторых случаях отверстие может быть разделено костной спикулой на более крупный передний отсек для позвоночной артерии и меньший задний отсек для венозного и симпатического нервных сплетений, что чаще всего встречается в C6 и C7 (Francis, 1955a; Sawhney and Бахл, 1989; Ванезис, 1989).Сообщается, что это свойство чаще встречается у человека, чем у других приматов (Rios et al., 2014). Поперечные отверстия увеличиваются в размере от C7 до C1 и обычно больше слева, чтобы приспособиться к большему размеру левой позвоночной артерии (Francis, 1955b; Taitz et al., 1978). Ножки образуют заднемедиальный предел отверстия, округлые и расположены примерно на середине высоты тела, так что верхняя и нижняя вырезки позвонков имеют почти одинаковую глубину.Столб костей, связанный с верхней суставной фасеткой, образует заднюю границу foramen transversarium, в то время как истинный поперечный отросток (задний стержень) образует заднебоковую границу и оканчивается задним бугорком . Реберный отросток типичного шейного позвонка представлен передней перемычкой foramen transversarium, которая заканчивается передним бугорком и соединяется с задним бугорком межбубчатой пластинки кости, образующей неглубокую невральную бороздку для прохода. передних (брюшных) корешков спинномозговых нервов.Следовательно, реберный элемент, который является гомологом грудного ребра, образует весь поперечный элемент, за исключением задней перемычки, которая представляет собой истинный поперечный отросток (рис. 7-7). Говорят, что передняя перемычка и передний бугорок гомологичны головке ребра, в то время как межбубчатая пластинка эквивалентна шейке ребра. Задний бугорок гомологичен бугорку ребра, а в шейной области нет эквивалента стержню ребра, если только не разовьется шейное ребро (Honeij, 1920; Cave, 1975).Сообщалось о дополнительных сочленениях, возникающих из передних бугорков, и это межреберное сочленение считается гомологичным паттерну слияния, наблюдаемому в латеральных массах крестца (Cave, 1934; Stewart, 1934b).
Рисунок 7-7. Истоки развития поперечного отростка типичного взрослого шейного позвонка.
Внутри каждой нервной борозды корешки спинномозгового нерва проходят позади позвоночной артерии, пересекая поперечное отверстие (рис.7-8). Только передняя ветвь каждого спинномозгового нерва пересекает бороздку, а задняя (дорсальная) ветвь проходит вокруг суставной стойки, чтобы получить доступ к мышцам и коже спины. Верхние и нижние суставные фасетки находятся на стыке ножек и пластинок. Они образуют цилиндрический столбик кости, нарезанный наискось, так что верхние грани обращены вверх и назад, а нижние грани обращены более или менее вперед с небольшим наклоном вниз.Угол наклона этих фасеток в шейном отделе незначительно изменяется (Francis, 1955a), но когда изменения действительно возникают, они часто могут приводить к аномальным нагрузкам и стрессам, которые могут вызывать боль и особенно головные боли (Morton, 1950; Овертон и Гросман, 1952).
Рисунок 7-8. Непосредственные взаимоотношения мягких тканей латеральной стороны четвертого шейного позвонка взрослого человека.
Пластинки плоские и длинные, увеличиваются в глубину от C3 вниз и заканчиваются раздвоенным остистым отростком, который может быть единичным в C6.Pal и Routal (1996) сообщили, что пластинки C2 и C7 несут нагрузку, в то время как промежуточные пластинки нет, и минимальная нагрузка обнаружена в C5. Поэтому они предостерегли от хирургической ламинэктомии С2 или С7, чтобы минимизировать нестабильность и последующую деформацию шеи.
Позвоночный канал имеет несколько треугольную форму в поперечном сечении и увеличивается в размерах от С2 до С5. Это соответствует самой толстой части шейного расширения спинного мозга, которая обеспечивает иннервацию грудной диафрагмы (спинномозговые нервы C3 – C5) и верхней конечности через плечевое сплетение (спинномозговые нервы C5 – T1).Относительный размер позвоночного канала уменьшается ниже уровня C5 (Yousefzadeh et al., 1982).
Помимо общего увеличения размеров тела по сравнению с увеличением передачи веса по мере опускания колонны (Murone, 1974; Gilad and Nissan, 1985), есть некоторые незначительные морфологические изменения в типичных шейных позвонках, которые могут помочь в идентификации. отдельных членов (Фрейзер, 1948). Верхние суставные грани C3 и C4 имеют довольно округлую форму, тогда как верхние грани C5 – C7 более эллиптические.Реберный отросток C3 лежит на более высоком уровне, чем истинный поперечный отросток этого позвонка, образуя наклонную латеральную массу, которая спереди выше, чем сзади. Межбубчатая пластинка C3 очень узкая, а нервная борозда неглубокая, при этом передний бугорок часто плохо определяется. Кроме того, часто можно увидеть слабую бороздку вокруг латеральной стороны суставной опоры, которая образована прохождением задней ветви третьего шейного спинномозгового нерва. В C4 реберные и поперечные элементы расположены на одном уровне, а нервная борозда глубже, чем у C3 выше.Передний бугорок в С4 расположен выше заднего бугорка. В С5 межбубная пластинка практически горизонтальна, а бороздка шире и глубже, что соответствует сравнительно большему размеру корешков спинномозгового нерва С5. В C6 бороздка широкая и имеет большой передний бугорок, бугорок сонной артерии (Chassaignac’s), против которого может быть сдавлена общая сонная артерия. Herrera и Puchades-Orts (1998) сообщили о нескольких характеристиках, которые, по их мнению, ограничиваются C6.Они включали наличие острой вырезки на пластинке, расположенной между верхней и нижней суставными фасетками (по сообщениям, вызванной прохождением дорсальной ветви шестого шейного нерва). Кроме того, они сообщили о наличии мышечного бугорка, расположенного в дорсокаудальной области межсуставного отдела, которого нет у детей (Sato and Nakazawa, 1982).
Атлас (первый шейный позвонок) нетипичен как по функции, так и по морфологии. 2 Его легко идентифицировать, поскольку это, по сути, костное кольцо, не имеющее тела. Таким образом, вес головы передается через затылочные мыщелки на верхние суставные фасетки атласа, а затем через его нижние суставные фасеты на нижнюю ось (Hinck et al., 1962). Атлас имеет прочные передних и задних дуг , которые объединены толстыми боковыми массами , несущими верхнюю и нижнюю суставные фасетки (рис.7-9).
Рисунок 7-9. Верхняя поверхность атласа для взрослых.
Передняя дуга короче задней дуги, а ее вентральная поверхность имеет выступающий бугорок, обращенный вниз и являющийся местом прикрепления передней продольной связки. На задней поверхности передней дуги имеется гладкая круглая суставная фасетка для синовиального сочленения с зубчатым отростком (зубчатым отростком) оси.
Задняя дуга длиннее передней дуги и имеет небольшой бугорок на задней поверхности, который гомологичен остистому отростку и является местом прикрепления выйной связки.На верхней поверхности задней дуги имеется бороздка прохода позвоночной артерии, когда она проходит от поперечного отверстия к затылочному отверстию. В этом положении ему сопутствует первый шейный (подзатылочный) спинномозговой нерв (рис. 7-10). Оссификация в косой задней атланто-затылочной связке может привести к образованию небольшой костной спикулы, которая проходит от края верхней суставной фасетки над позвоночной артерией до заднемедиальной области позвоночной борозды.Этот костный мост хорошо описан в литературе и чаще всего известен как задний мост, хотя его также называют задним мостом, ponticulus posticus, аномалией Киммерла, ретросуставным каналом, спикулумом или задним суставным отростком. Это превращает позвоночную борозду в отверстие, которое называется либо аркуальным отверстием, либо верхним ретроартикулярным отверстием (Ossenfort, 1926; Selby et al., 1955; Pyo and Lowman, 1959; Saunders and Popovich, 1978). Частота возникновения этой аномалии варьируется в разных популяциях, но, как сообщается, составляет от 9% до 16% (Pyo and Lowman, 1959; Taitz, Nathan, 1986; Mitchell, 1998).Об этом сообщалось у детей в возрасте 6 лет, и поэтому это не обязательно связано с возрастом (Kendrick and Biggs, 1963). От этого заднего моста отличается боковой мост (ponticulus lateralis), который проходит от латеральной массы к заднему корню поперечного отростка. Боковое мостовидное соединение встречается реже, чем заднее, и не так хорошо задокументировано (Taitz and Nathan, 1986). Ясно, что эти костные перемычки могут нарушить кровоток в позвоночной артерии и могут привести к цереброваскулярной недостаточности с потенциальными последующими неврологическими осложнениями (Bradshaw and McQuaid, 1963; Parkin et al., 1978). Однако в настоящее время существуют некоторые разногласия по поводу того, действительно ли механическая обструкция кровотока позвоночной артерии вносит значительный вклад в вертебробазилярную недостаточность. Ретро-поперечное отверстие (canaliculus venosus или заднебоковое отверстие) является третьей аномалией в этой области и характеризуется небольшим отверстием, обнаруживаемым в дорсальной части поперечного отростка. В жизни по нему проходит анастомотическая вена, соединяющая атланто-затылочный и атланто-аксиальный венозные синусы (Le Minor, 1997).Интересно, что эта характеристика присуща только человеку и не встречается у других приматов (аутапоморфная черта). Это происходит примерно у 14% людей и чаще встречается с левой стороны. Ле Минор (1997) предположил, что его присутствие связано с развитием вертикальной осанки и движения и является результатом региональных изменений венозного кровообращения.
Рисунок 7-10. Непосредственные отношения мягких тканей латеральной стороны атласа взрослого человека.
В отсутствие тела опорную функцию атласа несут большие боковые образования с их верхней и нижней суставными фасетками (Marino, 1995).Верхние фасетки имеют форму почки, хотя эти суставные поверхности могут иметь довольно значительные различия по форме (Pate, 1936; Singh, 1965; Barnes, 1994). В целом, однако, они глубоко вогнуты и повторяют форму выпуклых затылочных мыщелков черепа выше (см. Главу 5). Форма этого синовиального сустава позволяет наклонять голову вперед и назад, а также в значительной степени сгибать ее в стороны. Вариация формы атлантических суставных фасеток (например,грамм. если двойной) может оказаться чрезвычайно полезным при попытке связать позвоночный столб с конкретным черепом. Вращение головы по отношению к шее происходит в атланто-осевом сочленении между фасеткой на задней поверхности передней дуги и передней поверхностью логова. Нижний суставной отросток латеральной массы более округлый по форме и плоский для сочленения с верхней гранью оси. Этот сустав не дает четкого указания на ассоциацию, поскольку суставные поверхности заметно различаются по своей морфологии.По этой причине часто легче связать череп с его атласом, чем правильно сопоставить атлас с осью того же человека. Нижняя суставная грань атласа практически круглой формы, уплощенная или слегка вогнутая, обращена медиально и немного назад.
Боковые образования выступают в позвоночный канал, образуя два пространства неравного размера. Передний отдел меньше по размеру и занят логовом, удерживаемым поперечным компонентом крестообразной связки, который прикрепляется к небольшим бугоркам на внутренней поверхности латеральных масс.В большем заднем отделе позвоночного канала, позади поперечной связки, находится переходная зона между нижними пределами продолговатого мозга и первым шейным сегментом спинного мозга (Doherty and Heggeness, 1994).
Поперечные отростки атласа особенно длинные и являются местами прикрепления мышц, участвующих в вращении головы. Вершина поперечного отростка гомологична задним бугоркам других шейных позвонков и может пальпироваться в живом промежутке между сосцевидным отростком и углом нижней челюсти.Остальная часть поперечного отростка С1 является эквивалентом только заднего корня и межбубчатой пластинки, при этом остальная часть реберного отростка практически отсутствует, хотя небольшой бугорок может быть найден на передней поверхности передней дуги, латеральнее передний бугорок.
Ось (второй шейный позвонок) – это стержень или ось, вокруг которой вращается атлас, но не голова. Ось может называться «эпистрофей», что происходит от греческого слова, означающего «повернуться». 3
Ось легко идентифицируется благодаря выступающему зубчатому отростку (зубчатый отросток) (рис. 7-11), который несет на передней поверхности суставную фасетку для сочленения с задней поверхностью передней дуги атласа. . Две кости также соединяются через верхнюю и нижнюю грани. C2 соединяется с C3 посредством вторичного хрящевого сочленения тел и синовиальных суставов на нижних суставных фасетках. Таким образом, по нижней поверхности оси устанавливается типичный рисунок межпозвонкового сочленения.
Рисунок 7-11. Верхняя поверхность оси взрослого человека: (А) верхняя; (B) боковой.
Считается, что истинное тело оси лежит ниже уровня логова, который обычно считается смещенным телом атласа. Вершина логова прикрепляется к затылочной кости апикальными связками, а слегка уплощенные заднебоковые поверхности являются местом прикрепления крыловых связок, которые также проходят выше затылочной кости (Dvorak and Panjabi, 1987).Логово сужается снизу за счет прохождения поперечного компонента крестообразной связки, что помогает надежно удерживать его на месте. Быстрая смерть в результате повешения наступает, когда поперечная связка разрывается и логова раздавливает нижний продолговатый мозг и прилегающий спинной мозг. Однако в большинстве случаев судебного повешения травмы поперечной связки или зубовидного отростка встречаются редко. Классический «перелом палача» проходит через нервную дугу C2 кпереди от положения нижней суставной фасетки и может фактически пересекать поперечное отверстие (Marshall, 1888; Robertson, 1935; Duff, 1954; Elliot et al., 1972).
Передняя часть истинного тела оси выдолблена латерально для прикрепления мышц longus colli, в то время как нижняя граница обычно тянется вниз и сочленяется с вогнутой верхней поверхностью тела C3. В отличие от остальных шейных позвонков, верхняя и нижняя суставные фасетки оси не образуют вертикального суставного столба. Верхние грани большие, практически горизонтальные, слегка выпуклые и яйцевидные по форме для сочленения с атласом, в то время как нижние грани намного меньше, более наклонены по вертикали и смещены более назад.Верхняя суставная фасетка морфологически не отражает форму и ориентацию нижней атлантальной фасетки, поскольку вогнутость последней пересекает выпуклость первой. Цветоножки толстые, с глубокими выемками на нижних позвонках. Пластинки особенно прочные, они сливаются в мощный разветвленный остистый отросток для прикрепления мышц, которые расширяют, втягивают и вращают голову. Поперечные отростки небольшие, с одним бугорком, который гомологичен заднему бугорку, хотя передний бугорок может быть обнаружен на стыке корня поперечного отростка с телом.Каждое поперечное отверстие направлено суперолатерально, так как позвоночная артерия отклоняется латерально (примерно на 45 градусов) в этой точке, чтобы занять правильное положение для прохождения через соответствующее отверстие в атланте. Следовательно, в отличие от других шейных позвонков, поперечное отверстие оси не является простым коротким отверстием, а фактически представляет собой канал с изогнутым углом, одно отверстие которого обращено вниз, а другое – латерально. На крыше этого канала могут быть признаки эрозии из-за выраженной извилистости артерии.Считается, что эти эрозии вызываются так называемыми резервными петлями позвоночной артерии, которые необходимы для того, чтобы артерия могла следовать движениям головы и шеи без чрезмерного растяжения (Hadley, 1958; Krayenbuhl and Yasargil, 1968; Lindsey et al. , 1985; Taitz, Arensburg, 1989). Передняя ветвь второго шейного спинномозгового нерва проходит латеральнее позвоночной артерии, поэтому чрезмерная извилистость может привести к компрессии нерва (рис. 7-12).
Рисунок 7-12. Непосредственные отношения мягких тканей латеральной стороны взрослой оси.
prominens позвонка (седьмой шейный позвонок) характерен из-за его особенно длинного остистого отростка, который виден под кожей, хотя в действительности остистый отросток T1 может оказаться более выраженным. C7 – это переходный позвонок, который сочетает в себе характеристики как типичных шейных позвонков вверху, так и грудного отдела внизу. Как и шейка матки, он обычно имеет поперечное отверстие в латеральной массе, хотя позвоночная артерия не проходит через него, так как артерия сначала входит через отверстие C6.Таким образом, поперечное отверстие C7 обычно меньше, чем в других шейных позвонках, и может быть двудольным или вообще отсутствовать. Риос и др. (2014) обнаружили, что наличие этого отверстия является характеристикой человека и очень редко встречается у других приматов. В некоторых случаях реберный элемент C7 может отделяться от поперечного отростка и таким образом образовывать шейное ребро (рис. 7-13). Обычно они протекают бессимптомно, но могут привести как к неврологическим, так и к нарушению кровообращения в верхней конечности (Black and Scheuer, 1997).Исследования показали, что распространенность шейных ребер составляет от 0,05% до 3%, в зависимости от пола и происхождения исследуемой популяции (Brewin et al., 2009). Остистый отросток C7, как правило, не раздвоен, а заканчивается одним бугорком.
Рисунок 7-13. На верхней поверхности седьмого шейного позвонка взрослого человека видно шейное ребро справа.
Как и в шейном отделе, типичные грудные позвонки расположены в среднем сегменте (T2 – T9), а атипичные члены расположены на концах области (T1 и T10 – T12).
Типичные грудные позвонки характеризуются наличием суставных фасеток на телах и поперечных отростков для сочленения с головками и бугорками ребер соответственно. Описание типичного позвонка, приведенное выше, близко применимо к большинству грудных позвонков. Говорят, что при взгляде сверху тела имеют несколько сердцевидную форму и имеют большой реберный демифацет на боковой стороне тела на уровне верхней границы и меньший реберный демифацет в том же латеральном месте, но на нижней границе (рис. .7-14). Верхний демифацет – это место синовиального сочленения с нижней фасеткой на головке ребра соответствующего номера, например второе ребро сочленяется с верхним демифасетом на Т2. Нижний демифацет, как правило, меньше и сочленяется с верхней гранью на головке ребра, которое на одну цифру ниже в ряду, например нижний демифацет Т2 сочленяется с верхней частью головки третьего ребра.
Рисунок 7-14. Вид сбоку грудных позвонков взрослого, чтобы показать положение реберных фасеток на T1 и T9 – T12.
Вырезки нижних позвонков глубокие, а выемки верхних более мелкие, так что межпозвонковое отверстие преимущественно образовано нижними границами вышележащего позвонка. Поперечные отростки направлены назад и сбоку, каждый несет реберную фасетку на брюшной стороне для сочленения с бугорком ребра того же номера. Реберные отростки, которые были довольно рудиментарными в шейном отделе, особенно хорошо развиты в грудном отделе, таком как грудные ребра (см. Главу 8).
Верхние и нижние межпозвонковые суставные фасетки расположены в положении, описанном ранее для типичных позвонков, и образуют прочный продольный суставной столб кости. Остистые отростки обычно длинные, тонкие, направлены вниз и заканчиваются одним бугорком, хотя нижние позвонки имеют более поясничную морфологию. Позвоночный канал имеет несколько округлую форму и мал по сравнению с шейным отделом, так как он больше не несет нервную ткань спинного мозга, которая связана с иннервацией к верхним конечностям.
Помимо атипичных грудных позвонков, часто бывает довольно сложно идентифицировать отдельные члены грудных позвонков, но есть некоторые характеристики, которые предлагают достаточно информации, чтобы каждый позвонок мог быть помещен по крайней мере в один или два позвонка относительно его истинной анатомической формы. должность.
Форма тел грудных позвонков изменяется по мере опускания колонны, и часто это наиболее четкое указание на расположение одного позвонка в грудном сегменте.Тела T1–3 шире в поперечной, чем в переднезадней плоскости, имитируя типичную шейную форму тела. Это наиболее очевидно в T1 и в меньшей степени в T3, который, как говорят, имеет самое маленькое тело в грудном сегменте. К моменту Т4 переднезадний диаметр тела превышает поперечный диаметр, тем самым формируя так называемую типичную грудную форму тела. Начиная с Т4 и ниже, тела увеличиваются во всех размерах.
Тела средних грудных позвонков могут непосредственно контактировать с нисходящей грудной аортой.Это может оставить приплюснутый отпечаток на левой стороне тела T5 – T7, что приведет к слегка асимметричному контуру. Аневризмы нисходящей аорты, обычно в результате атеросклероза, могут разрушать кортикальную поверхность ряда тел позвонков в этом месте. Когда это происходит, это проявляется в виде глубоко зубчатых дефектов резорбции на нескольких соседних телах позвонков с относительно интактными концевыми пластинами позвонков (Kelley, 1979a; Ortner and Putschar, 1985).
Также обнаруживается различие в размере, форме и направлении суставных фасеток на поперечных отростках, в зависимости от того, сочленяется ли позвонок с позвоночно-грудным или позвоночно-хрящевым ребром (см. Главу 8).В T1 – T7 (позвоночно-грудной) суставные фасетки на поперечных отростках хорошо обозначены, большие, вогнутые и расположены на вентральной поверхности поперечного отростка в более вертикальной ориентации. В T8 – T10 (вертеброхондральные) фасетки меньше, более плоские и, как правило, лежат на верхней части отростка и обращены более высоко. От Т10 до Т12 поперечные отростки заметно уменьшаются в размерах.
Первый грудной позвонок по своей морфологии сходен с С7. Его тело больше похоже на шейный позвонок, причем его верхняя поверхность несколько вогнута из стороны в сторону и шире в поперечном направлении, чем в переднезаднем направлении.Позвоночный канал по форме больше шейный, чем грудной, так как он содержит заключительные стадии шейного расширения спинного мозга. В отличие от шейных позвонков в поперечном отростке нет поперечного отверстия. Верхняя реберная фасетка на теле для сочленения с первым ребром завершена, а на нижней границе верхней грани головки второго ребра имеется небольшой демифацет. T1 также имеет обращенную вверх суставную полку на пластинке в сочетании с верхней суставной фасеткой.Эта полка выступает назад и находится практически под прямым углом к нижнему краю верхней суставной фасетки, действуя как ограничитель, ограничивающий смещение вниз нижней суставной поверхности C7. Сообщается, что эти так называемые стыковые фасетки позволяют более равномерно передавать вниз силы, возникающие от мышц, прикрепленных к шейным поперечным отросткам, и во время чрезмерного вертикального сжатия их соударение явно поддерживает некоторые из сжимающих сил и, таким образом, дает облегчение телам позвонков ( Дэвис и Роуленд, 1965; Китс и Джонстон, 1982).Эта полка в меньшей степени видна на Т2.
Девятый грудной позвонок может иметь реберный полушарий только в верхней части тела и не иметь одного нижнего, хотя всегда имеется соответствующая суставная фасетка на поперечном отростке бугорка девятого ребра. десятый грудной позвонок имеет целую реберную суставную фасетку вверху, но не имеет нижней. Небольшая суставная фасетка может присутствовать на поперечном отростке десятого ребра.Одиннадцатый и двенадцатый грудных позвонков по существу имеют переходную форму между грудным и поясничным отделами (Shinohara, 1997). Они более прочные, и оба имеют одну грань на корпусе для сочленения с ребром соответствующего номера. Положение этой фасетки смещается назад по бокам тела, занимая положение на ножках. Изменение морфологии верхних и нижних суставных фасеток с преимущественно грудной на более поясничную форму имеет тенденцию происходить на уровне одиннадцатого позвонка.В позвонке, занимающем это переходное положение, верхние фасетки могут быть обращены заднебоковой стороной (как для типичных грудных позвонков), в то время как нижние фасетки принимают поясничную форму, будучи выпуклыми в поперечной плоскости и обращенными переднебоковыми сторонами. Считается, что это разграничение отмечает место перехода от по существу вращательной функции к невращающейся (Davis, 1955). Поперечные отростки уменьшены в длине и больше не сочленяются с ребрами (Cave, 1936). Остистые отростки также уменьшены в размерах и расположены более горизонтально.Позвоночный канал снова начинает расширяться в нижней части грудного отдела, чтобы приспособиться к увеличению поясничного отдела позвоночника для иннервации нижних конечностей.
Поясничные позвонки отличаются своими размерами и отсутствием как поперечных отверстий, так и реберных суставных фасеток. Тела большие и имеют форму почки, а ножки короткие и толстые (Zindrick et al., 1987; Amonoo-Kuofi, 1995), что указывает на важность переноса веса как функции в этой области колонны (рис.7-15).
Рисунок 7-15. Типичный поясничный позвонок взрослого человека: (А) верхний; (B) задний; (C) передний; (D) боковой.
Поперечные отростки тонкие, а небольшие вспомогательные отростки и мамиллярные отростки , расположенные позади них, считаются истинными поперечными отростками. Однако есть некоторые споры об истинном происхождении поясничного поперечного отростка, и это будет рассмотрено в разделе, посвященном окостенению этой области.
Суставные отростки ориентированы вертикально и изогнуты в поперечном направлении, так что нижняя пара выпуклая и смотрит вперед и вбок, и расположена ближе друг к другу, чем верхняя пара, которые вогнуты, шире друг от друга и изогнуты, чтобы смотреть медиально и назад.Такое вертикальное расположение суставных фасеток характерно для человека и не наблюдается ни у одного четвероногого животного (Cotteril et al., 1986). Фактически, его нет даже у новорожденного человека, но сообщается, что он развивается, когда ребенок начинает ходить (Lanz and Wachsmut, 1982), и поэтому такая ориентация суставов вполне может быть признаком адаптации к двуногому движению (Haher et al. др., 1994).
Пластинки глубокие и короткие, остистые отростки толстые и квадратные. Позвоночный канал имеет треугольную форму и ниже уровня L2 несет только конский хвост и концевую нить с соответствующими мозговыми оболочками, кровеносными сосудами, соединительной тканью и спинномозговой жидкостью (Schatzker and Pennal, 1968).
Только последний поясничный позвонок имеет достаточно индивидуальные характеристики, чтобы его можно было легко идентифицировать, когда он представлен изолированно; однако есть тонкие различия в других позвонках этого сегмента. Тела увеличиваются в ширину сверху вниз, как и ножки. Высота по вертикали передней части тела короче задней высоты в двух верхних позвонках, но больше в трех нижних костях этого сегмента. Поперечные отростки увеличиваются в длине от L1 до L3, а затем уменьшаются по направлению к L5.Фосетт (1932) отметил, что при осмотре поясничных позвонков сзади можно построить четырехстороннюю фигуру, если считать, что суставные фасетки представляют углы геометрической формы. В L1 и L2 форма позвонка имеет трапециевидную форму, причем верхний край длиннее нижнего края, так что боковые стороны проходят наклонно вниз и медиально. L3 по сути представляет собой параллелограмм с длинными вертикальными сторонами и верхним и нижним краями равной длины.L4 имеет практически квадратную форму, а L5 представляет собой вытянутый параллелограмм с короткими вертикальными сторонами. Однако L5 можно идентифицировать изолированно и другими способами, поскольку его общая морфология достаточно отличается от других позвонков в этом сегменте. Нижние суставные фасетки L5 сочленяются с верхними крестцовыми фасетками, которые широко разделены (Brown, 1937). Таким образом, в последнем поясничном позвонке расстояние между двумя верхними суставными фасетками и расстояние между двумя нижними суставными фасетками примерно одинаково, что приводит к расширению нижней части этого позвонка (Fawcett, 1932).Кроме того, передняя вертикальная высота тела обычно больше, чем ее эквивалентная задняя высота, так что тело этого позвонка имеет несколько клиновидную форму. Пятый поясничный позвонок может войти в крестец и таким образом стать сакрализованным, или же первый крестцовый сегмент может остаться отдельным от остальной части крестца и стать поясничным. Таким образом, последний поясничный и первый крестцовый позвонки являются переходными по своей природе (Willis, 1923b; Shore, 1930; Mitchell, 1938; Young and Ince, 1940; Wigh and Anthony, 1981; Castellvi et al., 1984; Эльстер, 1989; Барнс, 1994; Брон и др., 2007). Пояснично-крестцовая область колонны является местом анатомических вариантов и патологических состояний, некоторые из которых могут привести к боли в пояснице. (Willis, 1923b, 1929, 1941; Brailsford, 1929; Badgley, 1941; Stewart, 1956; Nathan, 1959; Reilly et al., 1978; Wigh, 1982; Merbs, 1989; Barnes, 1994).
Считается, что термин крестец происходит от латинского «sacer», означающего святой или священный, но его отношение к названию кости неясно. 4 У взрослого человека пять (а иногда и шесть) позвонков ниже поясничного сегмента сливаются, образуя крестец, который является центральной осью тазового пояса (рис. 7-16). Эта костная масса сочленяется сверху с последним поясничным позвонком в пояснично-крестцовом углу, латерально с безымянными в крестцово-подвздошных суставах и снизу с первым копчиковым сегментом (Brown, 1937). Боковые образования, которые проходят наружу от области мыса к крестцово-подвздошному сочленению, называются крыльями (крыльями) крестца. 5
Рисунок 7-16. Крестец и копчик взрослого человека: (A) передний; (B) задний; (C) боковой; (D) высшее.
Крестец представляет собой клиновидную кость, более широкую вверху у основания и более узкую внизу на вершине. Более широкие области, то есть S1 – S2, участвуют в переносе веса, но ниже этого уровня влияние веса тела уменьшается, и поэтому позвонки уменьшаются в размерах (Pal, 1989). Крестец вогнутый спереди и выпуклый сзади как сверху вниз, так и из стороны в сторону.Сообщается, что частота плоской вентральной поверхности у женщин достигает 20%, и это может привести к продолжительным родам, требующим оперативных родов из-за остановки родов в среднем тазе (Posner et al., 1955). Что касается вентральной стороны, очевидно, что центральная часть образуется в результате слияния тел крестцовых позвонков, а четыре поперечные линии слияния обычно сохраняются даже в пожилом возрасте. Латерально расположены четыре передних крестцовых отверстия , которые являются остатками передних границ межпозвонковых отверстий для прохождения передних ветвей крестцовых спинномозговых нервов.Эти отверстия представляют собой не просто отдельные каналы, но фактически представляют собой сложную сеть взаимосвязанных Y-образных каналов, которые проходят под углом примерно 45 градусов к корональной плоскости (Jackson and Burke, 1984). Считается, что округлые костные перемычки между соседними отверстиями являются остатками головок и шейок ребер и, следовательно, могут быть реберными по своему происхождению. Латеральнее от отверстий расположены боковые образования , которые отмечены нервными бороздками, ведущими от отверстий и также считаются реберными по происхождению, хотя есть некоторые споры по поводу истинности этого утверждения – см. Ниже (O’Rahilly et al. ., 1990а). Боковые поверхности двух (или трех) верхних боковых масс сочленяются с ушной поверхностью безымянного сустава, образуя синовиальный крестцово-подвздошный сустав (Flander and Corruccini, 1980). Несмотря на положение сустава по отношению к переносу веса тела, он не несет активной нагрузки, поскольку все силы передаются через связанные связки (Last, 1973), и это подтверждается отсутствием полового диморфизма, проявляемого этим суставом. (Али и Маклафлин, 1991). Помимо крестцово-подвздошного сочленения, между крестцом и подвздошной костью может образовываться ряд мелких дополнительных сочленений (Derry, 1910; Trotter, 1937, 1940; Stewart, 1938; Hadley, 1952), причем наиболее часто они встречаются. находится на уровне заднего второго крестцового отверстия.Обычно они протекают бессимптомно, чаще встречаются у мужчин, положительно коррелируют с возрастом, возможно, местом инициации синостоза, но в остальном их функция и этиология неизвестны.
Bellamy et al. (1983) предположили, что чем больше веса и сил передается через нижние конечности, тем больше сегментов крестцового столба будет участвовать в крестцово-подвздошном сочленении. Иногда и чаще у мужчин третий крестцовый сегмент может быть включен в крестцово-подвздошный сустав (Brothwell, 1981; Ali and MacLaughlin, 1991).
Выпуклая задняя поверхность крестца представляет собой сросшиеся нервные дуги отдельных позвонков, при этом средний крестцовый гребень по средней линии и остистые бугорки представляют собой сросшиеся остистые отростки. Латеральнее от него находится промежуточный ( суставной ) гребень , который образован в результате слияния синовиального суставного столба. Латеральнее от него расположены четыре задних крестцовых отверстия , которые являются остатками задних границ межпозвонковых отверстий для прохождения задних ветвей крестцовых спинномозговых нервов.Латеральнее от них находится боковой крестцовый гребень , образованный слиянием поперечных отростков.
В нижней части крестца пластинки не сливаются и не сливаются по средней линии, в результате остается крестцовый перерыв , ограниченный рогом крестца. Крестцовый канал в поперечном сечении имеет треугольную форму и проходит через конский хвост, а мозговые оболочки заканчиваются на уровне второго крестцового сегмента. Таким образом, нижние области крестцового позвоночного канала содержат только корешки спинномозговых нервов, проходящие к соответствующим крестцовым отверстиям и концевой нити, которая прикрепляется к копчику.
Термин копчик происходит от греческого «kokkyx», означающего «кукушка», предположительно из-за его сходства с клювом кукушки (Holden, 1882). 6 Эта небольшая область столба включает сросшиеся последние четыре или пять копчиковых позвонков, составляющих рудиментарный хвост. Первый сегмент обычно несет остатки поперечных отростков и верхних суставных фасеток (рогов), которые связками прикрепляются к соответствующим крестцовым рогам (рис. 7-16). Верхняя поверхность верхнего копчикового сегмента сочленяется с вершиной крестца, и с возрастом этот сустав может синостозировать.Крестцово-копчиковое сращение чаще встречается у мужчин, и хотя обычно считается, что это указывает на пожилой возраст, его можно обнаружить у лиц в возрасте до 30 лет (Oldale, 1990). Копчик – это место прикрепления мышц дна таза и ягодичной области. Передняя поверхность копчика находится в области тазового дна, а задняя поверхность находится в ягодице под кожей натальной щели.
Переломы копчика не редкость и обычно возникают в результате падения на ягодичную область.Вероятно, это один из самых болезненных переломов из-за большого количества нервных волокон в этом регионе. Вывих копчика в крестцово-копчиковом соединении встречается редко, и он также имеет тенденцию возникать после падения или поскользнуться (Bergkamp and Verhaar, 1995).
Чрезвычайно редкие «шевронные» кости были зарегистрированы в отношении, в частности, первого копчикового сегмента (Harrison, 1901; Schultz, 1941a). Они описываются как костные дуги, которые сочленяются или могут синостозировать с вентральной поверхностью тела верхних копчиковых сегментов.Сообщается, что они окостенели из двух отдельных центров окостенения, которые в конечном итоге могут слиться в средней линии. Считается, что они представляют собой зачатки механизма, предназначенного для увеличения площади прикрепления мышц у животных с большим хвостом. Также считается, что они играют вспомогательную роль в защите каудальных сосудов, которые проходят в костных каналах, образованных серией этих дуг – отсюда их другое название «гемальные дуги».
Нейроанатомия, вертебробазилярная система Артикул
[1]
Цибис А., Митрусиас В., Галанакис Н., Чалампалаки Н., Арванитис Д., Карантанас А., Вариации поперечных отверстий шейных позвонков: что происходит с позвоночной артерией? Европейский журнал позвоночника: официальное издание Европейского общества позвоночника, Европейского общества деформации позвоночника и Европейского отделения Общества исследования шейного отдела позвоночника.2018 июн; [PubMed PMID: 29455293]
[2]
Юань С.М., Аберрантное происхождение позвоночной артерии и его клиническое значение. Бразильский журнал сердечно-сосудистой хирургии. 2016 фев; [PubMed PMID: 27074275]
[3]
Meila D, Tysiac M, Petersen M, Theisen O, Wetter A, Mangold A, Schlunz-Hendann M, Papke K, Brassel F, Berenstein A, Происхождение и курс экстракраниальной позвоночной артерии: результаты КТА и эмбриологические соображения.Клиническая нейрорадиология. 2012 Dec; [PubMed PMID: 22941252]
[4]
Меншави К., Мор Дж. П., Гутьеррес Дж. Функциональная перспектива эмбриологии и анатомии церебрального кровоснабжения. Журнал инсульта. 2015 Май; [PubMed PMID: 26060802]
[5]
Комияма М., Морикава Т., Накадзима Х., Нисикава М., Ясуи Т., Высокая частота расслоения артерий, связанного с левой позвоночной артерией аортального происхождения.Neurologia medico-chirurgica. 2001 Jan; [PubMed PMID: 11218642]
[6]
Габриелли Р., Розати М.С., Атаксия и головокружение из-за аномального происхождения левой позвоночной артерии. Журнал сосудистой хирургии. 2013 сен; [PubMed PMID: 23972248]
[7]
Lacout A, Khalil A, Figl A, Liloku R, Marcy PY, Lusoria позвоночной артерии: опасное для жизни состояние при хирургии пищевода.Хирургическая и радиологическая анатомия: SRA. 2012 May; [PubMed PMID: 21
5][8]
Гандехари К., Гандехари К., Интересная основа вертебробазилярной артериальной территории. Иранский журнал неврологии. 2012; [PubMed PMID: 24250875]
[9]
Исаджи Т., Ясуда М., Кавагути Р., Аояма М., Нива А., Накура Т., Мацуо Н., Такаясу М., Задняя нижняя мозжечковая артерия экстрадурального происхождения из сегмента V {sub} 3 {/ sub}: более высокая частота недоминантная позвоночная артерия.Журнал нейрохирургии. Позвоночник. 2018 Фев; [PubMed PMID: 29192876]
[10]
Zhou R, Liu D, Yu K, Chen Y, Li L, Xu J, Zhou H, Вариации сонных и позвоночных артерий при болезни Альцгеймера. Текущее исследование болезни Альцгеймера. 2015; [PubMed PMID: 25817257]
[11]
Park JH, Kim JM, Roh JK, Гипоплазия позвоночной артерии: частота и связи с территорией ишемического инсульта.Журнал неврологии, нейрохирургии и психиатрии. 2007 сен; [PubMed PMID: 17098838]
[13]
Эскандер М.С., Дрю Дж. М., Обин М. Е., Марвин Дж., Франклин П. Д., Эк Дж. К., Патель Н., Бойл К., Коннолли П. Дж., Анатомия позвоночной артерии: обзор двухсот пятидесяти снимков магнитно-резонансной томографии. Позвоночник. 1 ноября 2010 г .; [PubMed PMID: 20938397]
[14]
Cakmak O, Gurdal E, Ekinci G, Yildiz E, Cavdar S, Дугообразное отверстие и его клиническое значение.Саудовский медицинский журнал. 2005 Sep; [PubMed PMID: 16155658]
[15]
Кушинг К.Э., Рамеш В., Гарднер-Медвин Д., Тодд Н.В., Голкар А., Бакстер П., Гриффитс П.Д., Фиксация позвоночной артерии в врожденном дугообразном отверстии атлантического позвонка: возможная причина расслоения позвоночной артерии у детей. Медицина развития и детская неврология. 2001 Jul; [PubMed PMID: 11463182]
[16]
Кутсураки Э., Авделиди Э., Мичмизос Д., Капсали С. Е., Коста В., Балояннис С. Аномалия Киммерле как возможный причинный фактор хронических головных болей напряжения и нейросенсорной потери слуха: отчет о болезни и обзор литературы.Международный журнал нейробиологии. 2010 Март; [PubMed PMID: 20374094]
[17]
Zibis AH, Mitrousias V, Baxevanidou K, Hantes M, Karachalios T., Arvanitis D, Анатомические вариации поперечного отверстия шейных позвонков: результаты, обзор литературы и клиническое значение во время хирургии шейного отдела позвоночника. Европейский журнал позвоночника: официальное издание Европейского общества позвоночника, Европейского общества деформации позвоночника и Европейского отделения Общества исследования шейного отдела позвоночника.2016 Dec; [PubMed PMID: 27554348]
[18]
Мурлиманджу Б.В., Прабху Л.В., Шилпа К., Рай Р., Дхананджая К.В., Джиджи П.Дж., Дополнительные поперечные отверстия в шейном отделе позвоночника: частота возникновения, эмбриологическая основа, морфология и хирургическое значение. Турецкая нейрохирургия. 2011; [PubMed PMID: 21845576]
[20]
Neo M, Fujibayashi S, Miyata M, Takemoto M, Nakamura T., Повреждение позвоночной артерии при хирургии шейного отдела позвоночника: обзор более 5600 операций.Позвоночник. 1 апреля 2008 г .; [PubMed PMID: 18379405]
[21]
Лунардини Д. Д., Эскандер М. С., Эвен Д. Л., Данлэп Д. Т., Чен А. Ф., Ли Д. Ю., Уорд Т. В., Кан Д. Д., Дональдсон В. Ф., Повреждения позвоночных артерий в хирургии шейного отдела позвоночника. Журнал позвоночника: официальный журнал Североамериканского общества позвоночника. 2014 1 августа; [PubMed PMID: 24411832]
[22]
Смит, М. Д., Эмери С. Е., Дадли А., Мюррей К. Дж., Левенталь М., Повреждение позвоночной артерии во время передней декомпрессии шейного отдела позвоночника.Ретроспективный обзор десяти пациентов. Журнал костной и суставной хирургии. Британский том. 1993 May; [PubMed PMID: 8496209]
[23]
Marks MP, Wojak JC, Al-Ali F, Jayaraman M, Marcellus ML, Connors JJ, Do HM, Ангиопластика при симптоматическом внутричерепном стенозе: клинический результат. Инсульт. 2006 Apr; [PubMed PMID: 16497979]
[24]
Mohammadian R, Sharifipour E, Mansourizadeh R, Sohrabi B, Nayebi AR, Haririan S, Farhoudi M, Charsouei S, Najmi S. Ангиопластика и стентирование симптоматического стеноза позвоночной артерии.Клиническое и ангиографическое наблюдение за 206 случаями из Северо-Западного Ирана. Журнал нейрорадиологии. 2013 Aug; [PubMed PMID: 24007733]
[25]
Zhou Y, Wang L, Zhang JR, Zhou K, Shuai J, Gong ZL, Liu Y, Wei F, Han YF, Shen L, Yang QW, Ангиопластика и стентирование при тяжелом симптоматическом атеросклеротическом стенозе внутричерепной вертебробазилярной артерии. Журнал клинической нейробиологии: официальный журнал Нейрохирургического общества Австралии.2019 5 марта; [PubMed PMID: 30850180]
[26]
Дженкинс Дж. С., Субраманиан Р. Ангиопластика позвоночных и внутричерепных артерий. Журнал Охзнера. 2003 Winter; [PubMed PMID: 22470254]
[29]
Брандт Т., Морчер М., Хауссер И., Ассоциация расслоения шейной артерии с аномалиями соединительной ткани в коже и артериях.Границы неврологии и нейробиологии. 2005; [PubMed PMID: 172
]
[30]
Klingelhöfer J, Conrad B, Benecke R, Frank B, Транскраниальная допплеровская ультрасонография каротидно-базилярного коллатерального кровообращения при подключичном обкрадывании. Инсульт. 1988 Aug; [PubMed PMID: 3041649]
[32]
Provenzale JM, Sarikaya B, Сравнение тестовых характеристик МРТ, МР-ангиографии и КТ-ангиографии в диагностике расслоения сонных и позвоночных артерий: обзор медицинской литературы.AJR. Американский журнал рентгенологии. 2009 окт; [PubMed PMID: 19770343]
[33]
Villablanca JP, Nael K, Habibi R, Nael A, Laub G, Finn JP, 3 T контрастная магнитно-резонансная ангиография для оценки внутричерепных артерий: сравнение с времяпролетной магнитно-резонансной ангиографией и мультиспиральной компьютерной томографической ангиографией. Следственная радиология. 2006 ноя; [PubMed PMID: 17035870]
[34]
Алмейда Дж. П., Медина Р., Тамарго Р. Дж., Лечение артериовенозных мальформаций задней черепной ямки.Международная хирургическая неврология. 2015 [PubMed PMID: 25745586]
[35]
Machado MC, Kodaira S, Musolino NR, Персистенция интраселлярной артерии тройничного нерва и одновременная аденома гипофиза: описание двух случаев и их значение для дифференциальной диагностики турецких поражений. Arquivos brasileiros de endocrinologia e Metabologia. 2014 август [PubMed PMID: 25211451]
[36]
Ламберт С.Л., Уильямс Ф.Дж., Оганисян З.З., Бранч Л.А., Мадер ЕС-младший, Варианты фетального типа задней мозговой артерии и сопутствующий инфаркт на территориях крупных артерий полушария головного мозга.



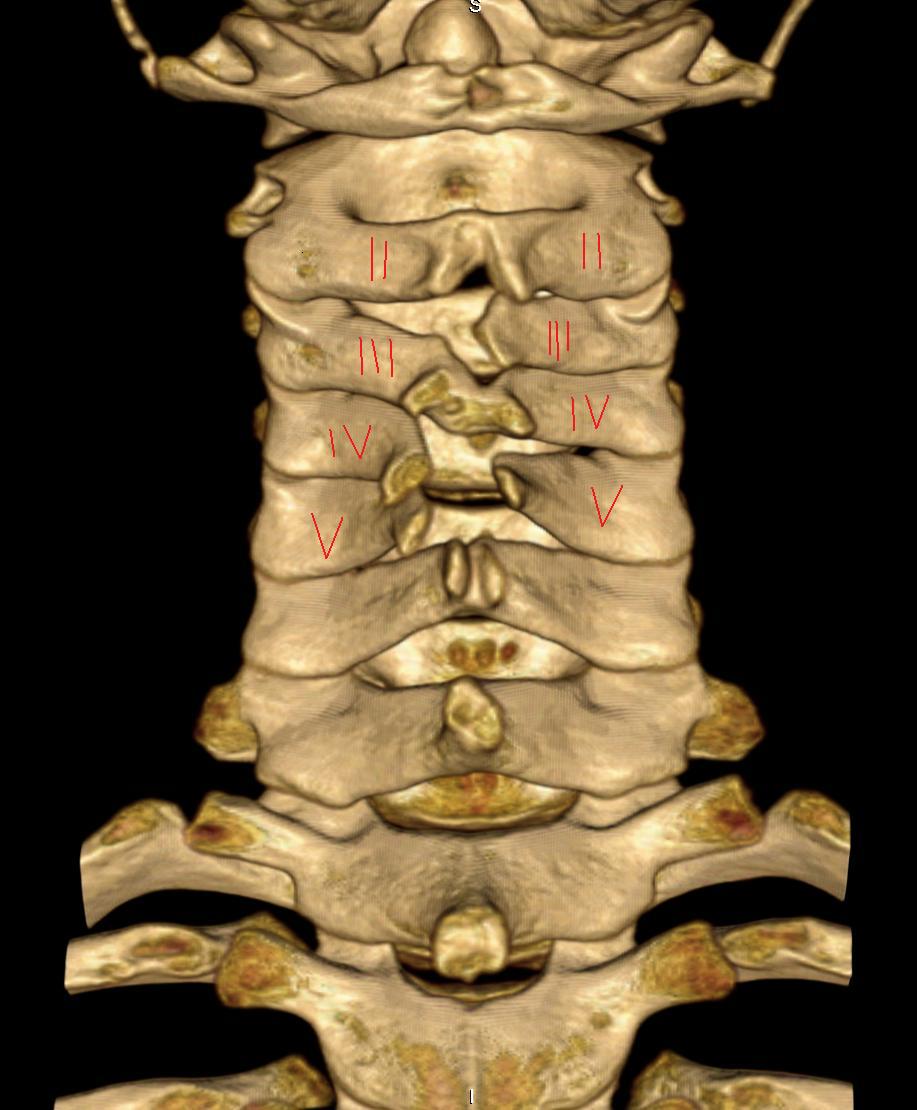 96), и тип 3 – разнообразные аномалии грудных и поясничных позвонков (бабочковидные позвонки, задние или боковые полупозвонки, конкресценцию или неслияние отдельных его частей) в сочетании с типом 1 или 2. Частота аномалии меньше 1%. Синдром Клиппеля-Фейля часто сочетается с краниовертебральными аномалиями, сколиозом и деформацией Шпренгеля (Sprengel) – подъемом лопатки вверх. Синдром Клиппеля-Фейля часто сочетается с аномалиями почек. Сегодня известно, что синдром относится к аутосомно-доминантным заболеваниям (17 пара хромосом), формируется между 3 и 8 неделями эмбриогенеза;
96), и тип 3 – разнообразные аномалии грудных и поясничных позвонков (бабочковидные позвонки, задние или боковые полупозвонки, конкресценцию или неслияние отдельных его частей) в сочетании с типом 1 или 2. Частота аномалии меньше 1%. Синдром Клиппеля-Фейля часто сочетается с краниовертебральными аномалиями, сколиозом и деформацией Шпренгеля (Sprengel) – подъемом лопатки вверх. Синдром Клиппеля-Фейля часто сочетается с аномалиями почек. Сегодня известно, что синдром относится к аутосомно-доминантным заболеваниям (17 пара хромосом), формируется между 3 и 8 неделями эмбриогенеза;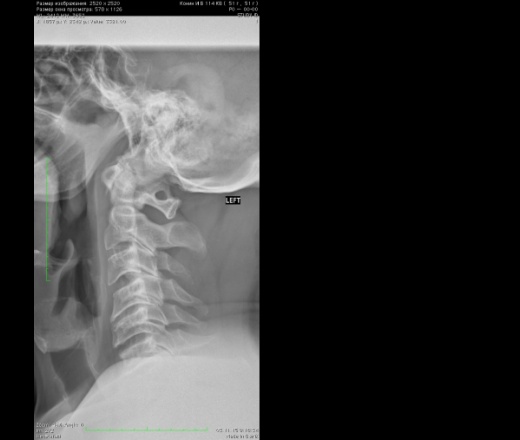 Латеральное положение – мостик перекидывается между суставом и реберно-поперечным отростком атланта, образуя аномальное кольцо латеральнее суставного отростка.
Латеральное положение – мостик перекидывается между суставом и реберно-поперечным отростком атланта, образуя аномальное кольцо латеральнее суставного отростка.