Недифференцированное заболевание соединительной ткани: Смешанное заболевание соединительной ткани, недифференцированное заболевание соединительной ткани и перекрестные синдромы | Алекперов
Смешанное заболевание соединительной ткани, недифференцированное заболевание соединительной ткани и перекрестные синдромы | Алекперов
1. Sharp GC, Irvin WS, Tan EM, Gould RG, Holman HR. Mixed connective tissue disease – an apparently distinct rheumatic disease syndrome associated with a specific antibody to an extractable nuclear antigen (ENA). Am J Med. 1972;52(2): 148–59. doi: 10.1016/0002-9343(72)90064-2.
2. Martínez-Barrio J, Valor L, López-Longo FJ. Facts and controversies in mixed connective tissue disease. Med Clin (Barc). 2018;150(1): 26–32. doi: 10.1016/j.medcli.2017.06.066.
3. Cappelli S, Bellando Randone S, Martinović D, Tamas MM, Pasalić K, Allanore Y, Mosca M, Talarico R, Opris D, Kiss CG, Tausche AK, Cardarelli S, Riccieri V, Koneva O, Cuomo G, Becker MO, Sulli A, Guiducci S, Radić M, Bombardieri S, Aringer M, Cozzi F, Valesini G, Ananyeva L, Valentini G, Riemekasten G, Cutolo M, Ionescu R, Czirják L, Damjanov N, Rednic S, Matucci Cerinic M.
4. Flåm ST, Gunnarsson R, Garen T; Norwegian MCTD Study Group, Lie BA, Molberg Ø. The HLA profiles of mixed connective tissue disease differ distinctly from the profiles of clinically related connective tissue diseases. Rheumatology (Oxford). 2015;54(3): 528–35. doi: 10.1093/rheumatology/keu310.
5. Ungprasert P, Crowson CS, Chowdhary VR, Ernste FC, Moder KG, Matteson EL. Epidemiology of mixed connective tissue disease, 1985–2014: A population-based study. Arthritis Care Res (Hoboken). 2016;68(12): 1843–8. doi: 10.1002/acr.22872.
6. Nakae K, Furusawa F, Kasukawa R, Tojo T, Homma M, Aoki K.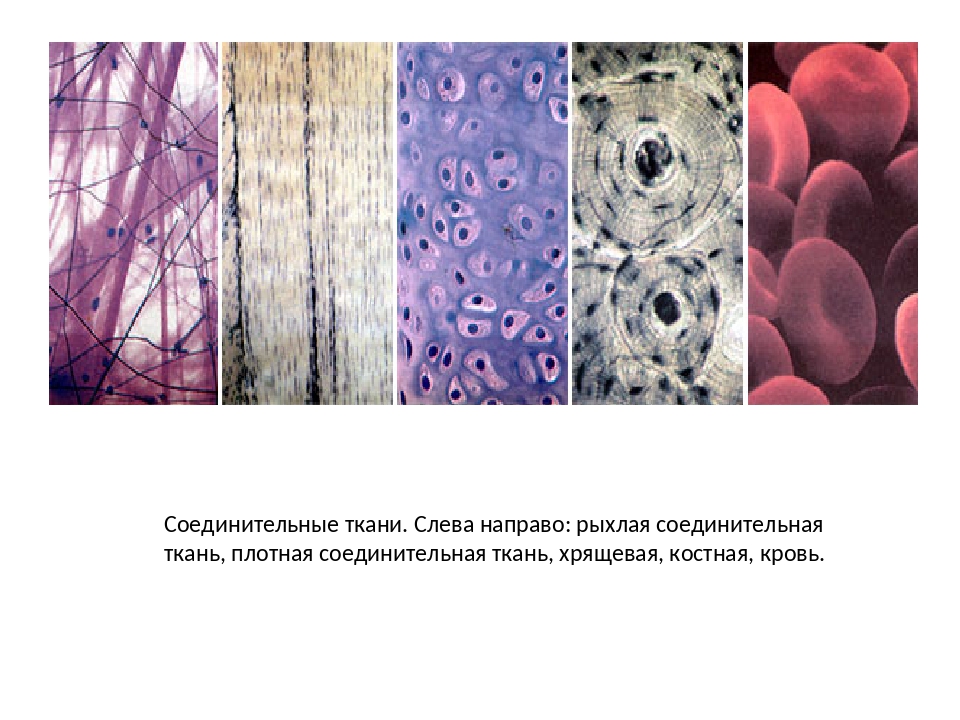 A nationwide epidemiological survey on diffuse collagen disease: Estimation of prevalence rate in Japan. In: Kasukawa R, Sharp GC, editors. Mixed connective tissue disease and antinuclear antibodies. Amsterdam: Elsevier; 1987. p. 9–20.
A nationwide epidemiological survey on diffuse collagen disease: Estimation of prevalence rate in Japan. In: Kasukawa R, Sharp GC, editors. Mixed connective tissue disease and antinuclear antibodies. Amsterdam: Elsevier; 1987. p. 9–20.
7. Gunnarsson R, Molberg O, Gilboe IM, Gran JT; PAHNOR1 Study Group. The prevalence and incidence of mixed connective tissue disease: a national multicentre survey of Norwegian patients. Ann Rheum Dis. 2011;70(6): 1047–51. doi: 10.1136/ard.2010.143792.
8. Farhey Y, Hess EV. Mixed connective tissue disease. Arthritis Care Res. 1997;10(5): 333–42.
9. Alarcón-Segovia D, Villareal M. Classification and diagnostic criteria for classification of mixed connective tissue disease. In: Kasukawa R, Sharp GC, editors. Mixed connective tissue diseases and antinuclear antibodies. Amsterdam: Elsevier; 1987. p. 33–40.
Amsterdam: Elsevier; 1987. p. 33–40.
10. Kasukawa R, Tojo T, Miyawaki S, Yoshida H, Tanimoto K, Nobunaga M, Suzuki T, Takasaki Y, Tamura T. Preliminary diagnostic criteria for classification of mixed connective tissue disease. In: Kasukawa R, Sharp GC, editors. Mixed connective tissue diseases and antinuclear antibodies. Amsterdam: Elsevier; 1987. p. 41–7.
11. Kahn MF, Bourgeois P, Aeschlimann A, de Truchis P. Mixed connective tissue disease after exposure to polyvinyl chloride. J Rheumatol. 1989;16(4): 533–5.
12. Amigues JM, Cantagrel A, Abbal M, Mazieres B. Comparative study of 4 diagnosis criteria sets for mixed connective tissue disease in patients with anti-RNP antibodies. Autoimmunity Group of the Hospitals of Toulouse. J Rheumatol. 1996;23(12): 2055–62.
13. Nicoll D, Lu CM, Pignone M, McPhee SJ. Pocket Guide to Diagnostic Tests. 5th edition. McGraw-Hill Medical / Jaypee Brothers Medical Publishers; 2007.
14. Williamson MA, Snyder LM, Wallach JB. Wallach’s Interpretation of Diagnostic Tests. Philadelphia: Wolters Kluwer / Lippincott Williams & Wilkins; 2011. 1035 p.
15. Dima A, Jurcut C, Baicus C. The impact of anti-U1-RNP positivity: systemic lupus erythematosus versus mixed connective tissue disease. Rheumatol Int. 2018;38(7): 1169–78. doi: 10.1007/s00296-018-4059-4.
16. LeRoy EC, Maricq HR, Kahaleh MB. Undifferentiated connective tissue syndromes. Arthritis Rheum. 1980;23(3): 341–3. doi: 10.1002/art.1780230312.
17. Mosca M, Neri R, Bombardieri S. Undifferentiated connective tissue diseases (UCTD): a review of the literature and a proposal for preliminary classification criteria. Clin Exp Rheumatol. 1999;17(5): 615–20.
Mosca M, Neri R, Bombardieri S. Undifferentiated connective tissue diseases (UCTD): a review of the literature and a proposal for preliminary classification criteria. Clin Exp Rheumatol. 1999;17(5): 615–20.
18. Danieli MG, Fraticelli P, Franceschini F, Cattaneo R, Farsi A, Passaleva A, Pietrogrande M, Invernizzi F, Vanoli M, Scorza R, Sabbadini MG, Gerli R, Corvetta A, Farina G, Salsano F, Priori R, Valesini G, Danieli G. Five-year follow-up of 165 Italian patients with undifferentiated connective tissue diseases. Clin Exp Rheumatol. 1999;17(5): 585–91.
19. Greer JM, Panush RS. Incomplete lupus erythematosus. Arch Intern Med. 1989;149(11): 2473–6. doi: 10.1001/archinte.1989.00390110061013.
20. Ganczarczyk L, Urowitz MB, Gladman DD. “Latent lupus”. J Rheumatol. 1989;16(4): 475–8.
1989;16(4): 475–8.
21. Swaak AJ, van de Brink H, Smeenk RJ, Manger K, Kalden JR, Tosi S, Marchesoni A, Domljan Z, Rozman B, Logar D, Pokorny G, Kovacs L, Kovacs A, Vlachoyiannopoulos PG, Moutsopoulos HM, Chwalinska-Sadowska H, Dratwianka B, Kiss E, Cikes N, Anic B, Schneider M, Fischer R, Bombardieri S, Mosca M, Graninger W, Smolen JS; Study group on incomplete SLE and SLE with disease duration longer than 10 years. Incomplete lupus erythematosus: results of a multicentre study under the supervision of the EULAR Standing Committee on International Clinical Studies Including Therapeutic Trials (ESCISIT). Rheumatology (Oxford). 2001;40(1): 89–94. doi: 10.1093/rheumatology/40.1.89.
22. Vaz CC, Couto M, Medeiros D, Miranda L, Costa J, Nero P, Barros R, Santos MJ, Sousa E, Barcelos A, Inês L. Undifferentiated connective tissue disease: a seven-center cross-sectional study of 184 patients.
23. Mosca M, Tani C, Bombardieri S. A case of undifferentiated connective tissue disease: is it a distinct clinical entity? Nat Clin Pract Rheumatol. 2008;4(6): 328–32. doi: 10.1038/ncprheum0799.
24. Doria A, Mosca M, Gambari PF, Bombardieri S. Defining unclassifiable connective tissue diseases: incomplete, undifferentiated, or both? J Rheumatol. 2005;32(2): 213–5.
25. Conti V, Esposito A, Cagliuso M, Fantauzzi A, Pastori D, Mezzaroma I, Aiuti F. Undifferentiated connective tissue disease – an unsolved problem: revision of literature and case studies. Int J Immunopathol Pharmacol. 2010;23(1): 271–8. doi: 10.1177/039463201002300125.
 Szodoray P, Nakken B, Barath S, Gaal J, Aleksza M, Zeher M, Sipka S, Szilagyi A, Zold E, Szegedi G, Bodolay E. Progressive divergent shifts in natural and induced T-regulatory cells signify the transition from undifferentiated to definitive connective tissue disease. Int Immunol. 2008;20(8): 971–9. doi: 10.1093/intimm/dxn056.
Szodoray P, Nakken B, Barath S, Gaal J, Aleksza M, Zeher M, Sipka S, Szilagyi A, Zold E, Szegedi G, Bodolay E. Progressive divergent shifts in natural and induced T-regulatory cells signify the transition from undifferentiated to definitive connective tissue disease. Int Immunol. 2008;20(8): 971–9. doi: 10.1093/intimm/dxn056.27. Bodolay E, Csiki Z, Szekanecz Z, Ben T, Kiss E, Zeher M, Szücs G, Dankó K, Szegedi G. Five-year follow-up of 665 Hungarian patients with undifferentiated connective tissue disease (UCTD). Clin Exp Rheumatol. 2003;21(3): 313–20.
28. Williams HJ, Alarcon GS, Joks R, Steen VD, Bulpitt K, Clegg DO, Ziminski CM, Luggen ME, St Clair EW, Willkens RF, Yarboro C, Morgan JG, Egger MJ, Ward JR. Early undifferentiated connective tissue disease (CTD). VI. An inception cohort after 10 years: disease remissions and changes in diagnoses in well established and undifferentiated CTD.
29. Pepmueller PH. Undifferentiated Connective Tissue Disease, Mixed Connective Tissue Disease, and Overlap Syndromes in Rheumatology. Mo Med. 2016;113(2): 136–40.
30. Mosca M, Tani C, Bombardieri S. Defining undifferentiated connective tissue diseases: a challenge for rheumatologists. Lupus. 2008;17(4): 278–80. doi: 10.1177/0961203307088004.
31. Mosca M, Neri R, Bencivelli W, Tavoni A, Bombardieri S. Undifferentiated connective tissue disease: analysis of 83 patients with a minimum followup of 5 years. J Rheumatol. 2002;29(11): 2345–9.
32. Gupta D, Roppelt H, Bowers B, Kunz D, Natarajan M, Gruber B. Successful remission of thrombotic thrombocytopenic purpura with rituximab in a patient with undifferentiated connective tissue disorder. J Clin Rheumatol. 2008;14(2): 94–6. doi: 10.1097/RHU.0b013e31816b4ab1.
J Clin Rheumatol. 2008;14(2): 94–6. doi: 10.1097/RHU.0b013e31816b4ab1.
33. Martorell EA, Hong C, Rust DW, Salomon RN, Krishnamani R, Patel AR, Kalish RA. A 32-yearold woman with arthralgias and severe hypotension. Arthritis Rheum. 2008;59(11): 1670–5. doi: 10.1002/art.24195.
34. Kelly BT, Moua T. Overlap of interstitial pneumonia with autoimmune features with undifferentiated connective tissue disease and contribution of UIP to mortality. Respirology. 2018;23(6): 600–5. doi: 10.1111/resp.13254.
35. Deng XL, Liu XY. Comparative study of 181 cases of diffuse connective tissue disease complicated by cardiovascular disease. Int J Rheum Dis. 2008;11(Suppl 1):A462.
36. Oh CW, Lee SH, Heo EP. A case suggesting lymphocytic vasculitis as a presenting sign of early undifferentiated connective tissue disease. Am J Dermatopathol. 2003;25(5): 423–7.
A case suggesting lymphocytic vasculitis as a presenting sign of early undifferentiated connective tissue disease. Am J Dermatopathol. 2003;25(5): 423–7.
37. Oishi Y, Arai M, Kiraku J, Doi H, Uchiyama T, Hasegawa A, Kurabayashi M, Nagai R. Unclassified connective tissue disease presenting as cardiac tamponade: a case report. Jpn Circ J. 2000;64(8): 619–22. doi: 10.1253/jcj.64.619.
38. Zhang Y, Zhang FK, Wu XN, Wang TL, Jia JD, Wang BE. Undifferentiated connective tissue diseases-related hepatic injury. World J Gastroenterol. 2008;14(17): 2780–2. doi: 10.3748/wjg.14.2780.
39. Alarcón GS, Williams GV, Singer JZ, Steen VD, Clegg DO, Paulus HE, Billingsley LM, Luggen ME, Polisson RP, Willkens RF. Early undifferentiated connective tissue disease. I. Early clinical manifestation in a large cohort of patients with undifferentiated connective tissue diseases compared with cohorts of well established connective tissue disease. J Rheumatol. 1991;18(9): 1332–9.
J Rheumatol. 1991;18(9): 1332–9.
40. Danieli MG, Fraticelli P, Salvi A, Gabrielli A, Danieli G. Undifferentiated connective tissue disease: natural history and evolution into definite CTD assessed in 84 patients initially diagnosed as early UCTD. Clin Rheumatol. 1998;17(3): 195–201.
41. Calvo-Alen J, Alarcon GS, Burgard SL, Burst N, Bartolucci AA, Williams HJ. Systemic lupus erythematosus: predictors of its occurrence among a cohort of patients with early undifferentiated connective tissue disease: multivariate analyses and identification of risk factors. J Rheumatol. 1996;23(3): 469–75.
42. Heinlen LD, McClain MT, Merrill J, Akbarali YW, Edgerton CC, Harley JB, James JA. Clinical criteria for systemic lupus erythematosus precede diagnosis, and associated autoantibodies are present before clinical symptoms. Arthritis Rheum. 2007;56(7): 2344–51. doi: 10.1002/art.22665.
Arthritis Rheum. 2007;56(7): 2344–51. doi: 10.1002/art.22665.
43. Mosca M, Baldini C, Bombardieri S. Undifferentiated connective tissue diseases in 2004. Clin Exp Rheumatol. 2004;22(3 Suppl 33):S14–8.
44. Iaccarino L, Gatto M, Bettio S, Caso F, Rampudda M, Zen M, Ghirardello A, Punzi L, Doria A. Overlap connective tissue disease syndromes. Autoimmun Rev. 2013;12(3): 363–73. doi: 10.1016/j.autrev.2012.06.004.
45. Jury EC, D’Cruz D, Morrow WJ. Autoantibodies and overlap syndromes in autoimmune rheumatic disease. J Clin Pathol. 2001;54(5): 340–7. doi: 10.1136/jcp.54.5.340.
46. Rodríguez-Reyna TS, Alarcón-Segovia D. Overlap syndromes in the context of shared autoimmunity. Autoimmunity. 2005;38(3): 219–23. doi: 10.1080/08916930500050145.
2005;38(3): 219–23. doi: 10.1080/08916930500050145.
47. Elhai M, Avouac J, Kahan A, Allanore Y. Systemic sclerosis at the crossroad of polyautoimmunity. Autoimmun Rev. 2013;12(11): 1052–7. doi: 10.1016/j.autrev.2013.05.002.
48. Koumakis E, Dieudé P, Avouac J, Kahan A, Allanore Y; Association des Sclérodermiques de France. Familial autoimmunity in systemic sclerosis – results of a French-based case-control family study. J Rheumatol. 2012;39(3): 532–8. doi: 10.3899/jrheum.111104.
49. Wielosz E, Majdan M, Dryglewska M, Targońska-Stępniak B. Overlap syndromes in systemic sclerosis. Postepy Dermatol Alergol. 2018;35(3): 246–50. doi: 10.5114/ada.2018.72662.
50. Aguila LA, Lopes MR, Pretti FZ, Sampaio-Barros PD, Carlos de Souza FH, Borba EF, Shinjo SK. Clinical and laboratory features of overlap syndromes of idiopathic inflammatory myopathies associated with systemic lupus erythematosus, systemic sclerosis, or rheumatoid arthritis. Clin Rheumatol. 2014;33(8): 1093–8. doi: 10.1007/s10067-014-2730-z.
51. Troyanov Y, Targoff IN, Tremblay JL, Goulet JR, Raymond Y, Senécal JL. Novel classification of idiopathic inflammatory myopathies based on overlap syndrome features and autoantibodies: analysis of 100 French Canadian patients. Medicine (Baltimore). 2005;84(4): 231–49. doi: 10.1097/01.md.0000173991.74008.b0.
52. Allanore Y, Vignaux O, Arnaud L, Puéchal X, Pavy S, Duboc D, Legmann P, Kahan A. Effects of corticosteroids and immunosuppressors on idiopathic inflammatory myopathy related myocarditis evaluated by magnetic resonance imaging. Ann Rheum Dis. 2006;65(2): 249–52. doi: 10.1136/ard.2005.038679.
53. Mahler M, Raijmakers R. Novel aspects of autoantibodies to the PM/Scl complex: clinical, genetic and diagnostic insights. Autoimmun Rev. 2007;6(7): 432–7. doi: 10.1016/j.autrev.2007.01.013.
54. Balbir-Gurman A, Braun-Moscovici Y. Scleroderma overlap syndrome. Isr Med Assoc J. 2011;13(1): 14–20.
55. Avouac J, Sordet C, Depinay C, Ardizonne M, Vacher-Lavenu MC, Sibilia J, Kahan A, Allanore Y. Systemic sclerosis-associated Sjögren’s syndrome and relationship to the limited cutaneous subtype: results of a prospective study of sicca syndrome in 133 consecutive patients. Arthritis Rheum. 2006;54(7): 2243–9. doi: 10.1002/art.21922.
56. Marrone M, Chialà A, Tampoia M, Iannone F, Raho L, Covelli M, Grattagliano V, Pansini N, Lapadula G. Prevalence of anti-CCP antibodies in systemic sclerosis. Reumatismo. 2007;59(1): 20–4. doi: 10.4081/reumatismo.2007.20.
57. Horimoto AM, da Costa IP. Overlap between systemic sclerosis and rheumatoid arthritis: a distinct clinical entity? Rev Bras Reumatol Engl Ed. 2016;56(4): 287–98. doi: 10.1016/j.rbre.2014.12.011.
58. Arslan Tas D, Erken E, Sakalli H, Yucel AE. Evaluating hand in systemic sclerosis. Rheumatol Int. 2012;32(11): 3581–6. doi: 10.1007/s00296-011-2205-3.
59. Chung L, Lin J, Furst DE, Fiorentino D. Systemic and localized scleroderma. Clin Dermatol. 2006;24(5): 374–92. doi: 10.1016/j.clindermatol.2006.07.004.
60. Ingegnoli F, Galbiati V, Zeni S, Meani L, Zahalkova L, Lubatti C, Soldi A, Paresce E, Murgo A, Crapanzano C, Fantini F. Use of antibodies recognizing cyclic citrullinated peptide in the differential diagnosis of joint involvement in systemic sclerosis. Clin Rheumatol. 2007;26(4): 510–4. doi: 10.1007/s10067-006-0313-3.
61. Polimeni M, Feniman D, Skare TS, Nisihara RM. Anti-cyclic citrullinated peptide antibodies in scleroderma patients. Clin Rheumatol. 2012;31(5): 877–80. doi: 10.1007/s10067-011-1930-z.
62. Payet J, Goulvestre C, Bialé L, Avouac J, Wipff J, Job-Deslandre C, Batteux F, Dougados M, Kahan A, Allanore Y. Anticyclic citrullinated peptide antibodies in rheumatoid and nonrheumatoid rheumatic disorders: experience with 1162 patients. J Rheumatol. 2014;41(12): 2395–402. doi: 10.3899/jrheum.131375.
63. Morita Y, Muro Y, Sugiura K, Tomita Y. Anti-cyclic citrullinated peptide antibody in systemic sclerosis. Clin Exp Rheumatol. 2008;26(4): 542–7.
64. Ueda-Hayakawa I, Hasegawa M, Kumada S, Tanaka C, Komura K, Hamaguchi Y, Takehara K, Fujimoto M. Usefulness of anti-cyclic citrullinated peptide antibody and rheumatoid factor to detect rheumatoid arthritis in patients with systemic sclerosis. Rheumatology (Oxford). 2010;49(11): 2135–9. doi: 10.1093/rheumatology/keq205.
65. Allali F, Tahiri L, Senjari A, Abouqal R, Hajjaj-Hassouni N. Erosive arthropathy in systemic sclerosis. BMC Public Health. 2007;7:260. doi: 10.1186/1471-2458-7-260.
66. Avouac J, Clements PJ, Khanna D, Furst DE, Allanore Y. Articular involvement in systemic sclerosis. Rheumatology (Oxford). 2012;51(8): 1347–56. doi: 10.1093/rheumatology/kes041.
67. Alharbi S, Ahmad Z, Bookman AA, Touma Z, Sanchez-Guerrero J, Mitsakakis N, Johnson SR. Epidemiology and survival of systemic sclerosis-systemic lupus erythematosus overlap syndrome. J Rheumatol. 2018;45(10): 1406–10. doi: 10.3899/jrheum.170953.
68. Horn HC, Ottosen P, Junker P. Renal crisis in asclerodermic scleroderma – lupus overlap syndrome. Lupus. 2001;10(12): 886–8. doi: 10.1191/096120301701548382.
трудности диагностики » Библиотека врача
ФГБОУ ВО «Российский национальный исследовательский университет им. Н.И. Пирогова» Минздрава России, кафедра госпитальной терапии № 1 лечебного факультета, г. Москва
В практике современного врача встречается огромное количество схожих и перекрестных симптомов и синдромов, составляющих клиническую картину заболевания, которые требуют тщательного дифференциально-диагностического подхода на пути верификации диагноза. В связи с этим особое место занимают диффузные заболевания соединительной ткани (ДЗСТ). Синдром Шарпа представляет собой смешанное заболевание соединительной ткани аутоиммунного генеза, характеризующееся наличием отдельных признаков системной красной волчанки (СКВ), ревматоидного артрита (РА), системной склеродермии (ССД) и дерматомиозита/полиомиозита в сочетании с высоким титром антител к ядерному рибонуклеопротеину U1-RNP. Прогноз «синдром Шарпа», как правило, благоприятный, и возможна полная клиническая ремиссия. Но ухудшению прогноза заболевания способствует наличие легочной гипертензии, поражения почек и тяжелого синдрома Рейно, что описано в нижепредставленном клиническом случае.
В практике современного врача встречается огромное количество схожих и перекрестных симптомов и синдромов, составляющих клиническую картину заболевания, которые требуют тщательного дифференциально-диагностического подхода на пути верификации диагноза. В связи с этим особое место занимают диффузные заболевания соединительной ткани (ДЗСТ). Но даже среди этой группы встречается заболевание, отличающееся разнообразием клинической картины, свойственной нескольким ревматологическим диагнозам.
Синдром Шарпа [синонимы: смешанное заболевание соединительной ткани (СЗСТ), недифференцированное заболевание соединительной ткани] представляет собой смешанное заболевание соединительной ткани аутоиммунного генеза, характеризующееся наличием отдельных признаков системной красной волчанки (СКВ), ревматоидного артрита (РА), системной склеродермии (ССД) и дерматомиозита/полиомиозита в сочетании с высоким титром антител к ядерному рибонуклеопротеину U1-RNP. Как самостоятельная нозологическая форма выделен Г. Шарпом и соавт. в 1972 г. Частота встречаемости составляет всего 2 на 100 000 человек. Преимущественно болеют люди старше 30 лет; соотношение случаев заболевания у женщин и мужчин от 9:1 до 16:1 [1].
ЭТИОЛОГИЯ, ДИАГНОСТИКА, ПРОГНОЗ
Сегодня основными этиологическими факторами возникновения синдрома Шарпа являются генетические механизмы, так как описаны случаи заболевания у близких родственников с одним HLA-фенотипом. Так, у 66% пациентов повышенный титр АТ RNP ассоциируется с HLA-DR4-фенотипом. Существуют предположения, что имеется мимикрия между 33 полипептидом U1-RNP и аналогичным компонентом в ретровирусах животных организмов. В основе патогенеза заболевания лежат иммунные нарушения, которые проявляются высоким титром U1-RNP (антинуклеарных антител, относящихся к IgG, крапчатого вида свечения при непрямой иммунофлюоресценции), снижение супрессорной функции Т-лимфоцитов за счет пенетрации U1-RNP-антител Th II типа посредством Fc-рецепторов, образование циркулирующих иммунных комплексов (ЦИК) и снижение уровня компонентов комплемента [2].
Для синдрома Шарпа характерна полиморфная клиническая картина, включающая синдром Рейно, поражение кожи, суставов, мышц, легких, ЖКТ и реже поражения сердца, почек и ЦНС (табл. 1).
Необходимо отметить, что суставной синдром встречается в 3/4 случаев и проявляется артритом (проксимальных межфаланговых, пястно-фаланговых и лучезапястных суставов), сходным с ревматоидным, но без прогрессирующего поражения суставного хряща и эпифизов. Иногда наблюдаются аваскулярные некрозы головок бедренных костей вследствие поражения сосудистой стенки, остеолиз ногтевых фаланг, а также синдром Тибержа–Вейсенбаха (отложение в мягких тканях конечностей глыбок кальция). У 2/3 больных определяется кожный синдром, характеризующийся отечностью рук («сосискообразные пальцы») без индурации и атрофии в отличие от ССД. Очень редко наблюдаются изъявления и в своем исходе гангрена кончиков пальцев. Высыпания в области скул имеют вид эритематозной сыпи, как при СКВ, но без дальнейшего рубцевания. Зачастую у больных с синдромом Шарпа можно наблюдать одни из основных симптомов дерматомиозита – «лиловые очки» (периорбитальный отек с фиолетовым оттенком) и эритематозные пятна над суставами рук. У 70% пациентов диагностируется поражение пищевода в виде дисфункций, редко вызывающих жалоб. В основном это снижение амплитуды перистальтики и давления сфинктера, что приводит к рефлюкс-эзофагиту со всеми своими отдаленными последствиями. Крайне редко в патологический процесс вовлекаются другие отделы ЖКТ. Одним из самых грозных, но редких осложнений СЗСТ является поражение легких в виде интерстициального пневмонита, экссудативного . Наблюдаемая инфильтрация пораженных тканей лимфоцитами и плазматическими клетками, осуществляемая в среднем и внутреннем слоях крупных сосудов, приводит к местным пролиферативным реакциям и развитию одного из самых тяжелых осложнений данного заболевания – легочной гипертензии [2, 3]. Данные осложнения приводят к значительному снижению показателей функции внешнего дыхания (ФВД) и качества жизни. Поражение сердца – еще более редкое проявление синдрома Шарпа, чем поражение легких. Проявляется экссудативным перикардитом, миокардитом, пролапсом митрального клапана и аортальной недостаточностью. Клиническая картина поражения почек при синдроме Шарпа обусловлена тем, что депозиты комплемента и IgG и IgM обнаруживаются в дермоэпителиальном стыке, в стенках сосудов мышц и …
А.Г. Варданян, В.Н. Соболева, Н.А. Волов, Ю.М. Машукова, Е.О. Бездольнова, В.П. Рымберг, Э.С. Рамазанова, А.Х. Назарян, И.Г. Гордеев
Смешанное заболевание соединительной ткани | Шаяхметова
1. Ceribelli A, Isailovic N, De Santis M, et al. Clinical significance of rare serum autoantibodies in rheumatic diseases: a systematic literature review. JLab Precis Med. 2018;3. pii: 89.
2. Pepmueller PH. Undifferentiated Connective Tissue Disease, Mixed Connective Tissue Disease, and Overlap Syndromes in Rheumatology. Mo Med. 2016 Mar-Apr;113(2):136-40.
3. Sharp GC, Irvin WS, Tan EM, et al. Mixed connective tissue disease: an apparently distinct rheumatic disease syndrome associated with a specific antibody to an extractable nuclear antigen. Am J Med. 1972 Feb;52(2): 148-59.
4. Tani C, Carli L, Vagnani S, et al. The diagnosis and classification of mixed connective tissue disease. JAutoimmun. 2014 Feb-Mar; 48-49:46-9. doi: 10.1016/j.jaut.2014.01.008. Epub 2014 Jan 22.
5. Gunnarsson R, Hetlevik SO, Lilleby V, et al. Mixed connective tissue disease. Best Pract Res Clin Rheumatol. 2016 Feb;30(1):95-111. doi: 10.1016/j.berh.2016.03.002. Epub 2016 Apr 12.
6. Насонов ЕЛ, Александрова ЕН. Современные технологии и перспективы лабораторной диагностики ревматических заболеваний. Терапевтический архив. 2010; (5):5-9. [Nasonov EL, Aleksandrova EN. Modern technologies and prospects of laboratory diagnostics of rheumatic diseases. Terapevticheskiiarkhiv. 2010;(5):5-9. (In Russ.)].
7. Ананьева ЛП, Александрова ЕН. Аутоантитела при системной склеродермии: спектр, клинические ассоциации и прогностическое значение. Научно-практическая ревматология. 2016;54(1):86-99. doi: 10.14412/1995-4484-2016-86-99
8. Jog NR, James JA. Biomarkers in connective tissue diseases. J Allergy Clin Immunol. 2017 Dec;140(6):1473-1483. doi: 10.1016/j.jaci.2017.10.003.
9. Mosca M, Tani C, Bombardieri S, et al. Undifferentiated connective tissue diseases (UCTD): Simplified systemic autoimmune diseases. Autoimmun Rev. 2011 Mar;10(5): 256-8. doi: 10.1016/j.autrev.2010.09.013. Epub 2010 Sep 21.
10. Ungprasert P, Crowson CS, Chowdhary VR, et al. Epidemiology of mixed connective tissue disease, 1985—2014: a population-based study. Arthritis Care Res (Hoboken). 2016 Dec; 68(12):1843-1848. doi: 10.1002/acr.22872. Epub 2016 Oct 1.
11. Tarvin SE, O’Neil KM. Systemic Lupus Erythematosus, Sjogren Syndrome, and Mixed Connective Tissue Disease in Children and Adolescents. Pediatr Clin North Am. 2018 Aug;65(4):711-737. doi: 10.1016/j.pcl.2018.04.001.
12. Burdt MA, Hoffman RW, Deutscher SL, et al. Long-term outcome in mixed connective tissue disease. Arthritis Rheum. 1999 May; 42(5):899-909.
13. Mathai SC, Danoff SK. Management of interstitial lung disease associated with connective tissue disease. BMJ. 2016 Feb 24; 352:h6819. doi: 10.1136/bmj.h6819.
14. Arroyo-Avila M, Vila LM. Cardiac tamponade in a patient with mixed connective tissue disease. J Clin Rheumatol. 2015 Jan; 21(1):42-5. doi: 10.1097/RHU.0000000000000209.
15. Ungprasert P, Wannarong T, Panichsillapakit T. Cardiac involvement in mixed connective tissue disease: a systematic review. Int J Cardiol. 2014 Feb 15;171(3): 326-30. doi: 10.1016/j.ijcard.2013.12.079. Epub 2013 Dec 29.
16. Nica AE, Alexa LM, Ionescu AO, et al. Esophageal disorders in mixed connective tissue diseases. J Med Life. 2016 Apr-Jun;9(2): 141-3.
17. Nascimento IS, Bonfa E, Carvalho JF, et al. Clues for previously undiagnosed connective tissue disease in patients with trigeminal neuralgia. J Clin Rheumatol. 2010 Aug;16(5):205-8. doi: 10.1097/RHU.0b013e3181e928e6.
18. Vij M, Agrawal V, Jain M. Scleroderma renal crisis in a case of mixed connective tissue disease. Saudi J Kidney Dis Transpl. 2014 Jul;25(4):844-8.
19. Sobanski V, Giovannelli J, Lynch BM, et al. Characteristics and Survival of Anti-U1 RNP Antibody-Positive Patients With Connective Tissue Disease-Associated Pulmonary Arterial Hypertension. Arthritis Rheumatol. 2016 Feb;68(2):484-93. doi: 10.1002/art.39432.
20. Takahashi K, Taniguchi H, Ando M, et al. Mean pulmonary arterial pressure as a prognostic indicator in connective tissue disease associated with interstitial lung disease: a retrospective cohort study. BMC Pulm Med. 2016 Apr 19;16(1):55. doi: 10.1186/s12890-016-0207-3.
21. Иванова СМ, Иванова ММ, Сперанский АИ. Антитела к экстрагируемым ядерным антигенам при ревматических заболеваниях. Терапевтический архив.1980;(6):59-62.
22. Aringer M, Steiner G, Smolen JS. Does mixed connective tissue disease exist? Yes. Rheum Dis Clin North Am. 2005 Aug;31(3): 411-20, v.
23. Swanton J, Isenberg D. Mixed connective tissue disease: still crazy after all these years. Rheum Dis Clin North Am. 2005 Aug;31(3): 421-36, v.
24. Ciang NC, Pereira N, Isenberg DA. Mixed connective tissue disease — enigma variations? Rheumatology (Oxford). 2017 Mar 1; 56(3):326-333. doi: 10.1093/rheumatology/kew265.
25. Hajas A, Szodoray P, Nakken B, et al. Clinical course, prognosis, and causes of death in mixed connective tissue disease. J Rheumatol. 2013 Jul;40(7):1134-42. doi: 10.3899/jrheum.121272. Epub 2013 May 1.
26. Cappelli S, Bellando RS, Martinovic D, et al. “To Be or Not To Be,” Ten Years After: Evidence for Mixed Connective Tissue Disease as a Distinct Entity. Semin Arthritis Rheum. 2012 Feb;41(4):589-98. doi: 10.1016/j.semarthrit.2011.07.010. Epub 2011 Sep 29.
27. Benjamin C, Carlo Alberto S, Rosaria T, et al. Mixed connective tissue disease: state of the art on clinical practice guidelines. RMD Open. 2018 Oct 18;4(Suppl 1):e000783. doi: 10.1136/rmdopen-2018-000783.eCollection2018.
28. Sharp GC. Diagnostic criteria for classification of of MCTD. In: Kasukawa R, Sharp GC, editors. Mixed connective tissue diseases and antinuclear antibodies. Amsterdam: Elsevier; 1987. P. 23-32.
29. Alarcon-Segovia D, Villareal M. Classification and diagnostic criteria for mixed connective tissue disease. In: Kasukawa R, Sharp GC, editors. Mixed connective tissue disease and antinuclear antibodies. Amsterdam: Elsevier; 1987. P. 33-40.
30. Kahn MF, Appelboom T. Syndrom de Sharp. In: Kahn MF, Peltier AP, Meyer O, Piette JC, editors. Les maladies systemiques. 3rd Ed. Paris: Flammarion; 1991. P. 545-56.
31. Kasukawa R, Tojo T, Miyawaki S. Preliminary diagnostic criteria for classification of mixed connective tissue disease. In: Kasukawa R, Sharp G, editors. Mixed connective tissue disease and antinuclear antibodies. Amsterdam: Elsevier; 1987. P. 41-7.
32. Chung L, Liu J, Parsons L, et al. Characterization of connective tissue disease-associated pulmonary arterial hypertension from REVEAL: identifying systemic sclerosis as a unique phenotype. Chest. 2010 Dec; 138(6):1383-94. doi: 10.1378/chest.10-0260. Epub 2010 May 27.
33. Reiseter S, Gunnarsson R, Corander J, et al. Disease evolution in mixed connective tissue disease: results from a long-term nationwide prospective cohort study. Arthritis Res Ther. 2017 Dec 21;19(1):284. doi: 10.1186/s13075-017-1494-7.
34. Narula N, Narula T, Mira-Avendano I, et al. Interstitial lung disease in patients with mixed connective tissue disease: pilot study on predictors of lung involvement. Clin Exp Rheumatol. 2018 Jul-Aug;36(4):648-651. Epub 2018 May 8.
35. Niklas K, Niklas A, Mularek-Kubzdela T, Puszczewicz M. Prevalence of pulmonary hypertension in patients with systemic sclerosis and mixed connective tissue disease. Medicine (Baltimore). 2018 Jul;97(28):e11437. doi: 10.1097/MD.0000000000011437.
36. Vlachoyiannopoulos PG, Guials A, Tzioufas G, Moutsopoulos HM. Predominance of IgM anti-U1RNP antibodies in patients with systemic lupus erythematosus. Br J Rheumatol. 1996 Jun;35(6):534-41.
37. Komatireddy GR, Wang GS, Sharp GC, Hoffman RW. Antiphospholipid antibodies among anti-U1-70 kDa autoantibody positive patients with mixed connective tissue disease. J Rheumatol. 1997 Feb;24(2):319-22.
38. Szodoray P, Hajas A, Kardos L, et al. Distinct phenotypes in MCTD: subgroups and survival. Lupus. 2012 Nov;21(13): 1412-22. doi: 10.1177/0961203312456751. Epub 2012 Aug 3.
39. Ortega-Hernandez OD, Shoenfeld Y. Mixed connective tissue disease: An overview of clinical manifestation, diagnosis and treatment. Best Pract Res Clin Rheumatol. 2012 Feb; 26(1):61-72. doi: 10.1016/j.berh.2012.01.009.
40. Sen S, Sinhamahapatra P, Choudhury S, et al. Cutaneous manifestations of mixed connective tissue disease: study from a tertiary care hospital in eastern India. Indian J Dermatol. 2014 Jan;59(1):35-40. doi: 10.4103/0019-5154.123491.
41. Chojnowski MM, Felis-Giemza A, Olesinska M. Capillaroscopy – a role in modern rheumatology. Reumatologia. 2016;54(2): 67-72. doi: 10.5114/reum.2016.60215. Epub 2016 Jun 3.
42. Carpintero MF, Martinez L, Fernandez I, et al. Diagnosis and risk stratification in patients with anti-RNP autoimmunity. Lupus. 2015 Sep;24(10):1057-1066. doi: 10.1177/0961203315575586
43. Tubery A, Fortenfant F, Combe B, et al. Clinical association of mixed connective tissue disease and granulomatosis with polyangiitis: a case report and systematic screening of anti-U1RNP and anti-PR3 auto-antibody double positivity in ten European hospitals. Immunol Res. 2016 Dec;64(5-6):1243-1246.
44. Kawano-Dourado L, Baldi B, Kay F, et al. Pulmonary involvement in long-term mixed connective tissue disease: functional trends and imaging findings after 10 years. Clin Exp Rheumatol. 2015 Mar-Apr;33(2):234-40. Epub 2015 Apr 10.
45. Yang X, Mardekian J, Sanders KN, et al. Prevalence of pulmonary arterial hypertension in patients with connective tissue diseases: a systematic review of the literature. Clin Rheumatol. 2013 Oct;32(10):1519-31. doi: 10.1007/s10067-013-2307-2. Epub 2013 Jun 20.
46. Gunnarsson R, Andreassen AK, Molberg O, et al. Prevalence of pulmonary hypertension in an unselected, mixed connective tissue disease cohort: results of a nationwide, Norwegian cross-sectional multicentre study and review of current literature. Rheumatology (Oxford). 2013 Jul;52(7):1208-13. doi: 10.1093/rheumatology/kes430. Epub 2013 Feb 12.
47. Sato T, Fujii T, Yokoyama T, et al. Anti-U1 RNP antibodies in cerebrospinal fluid are associated with central neuropsychiatric manifestations in systemic lupus erythematosus and mixed connective tissue disease. Arthritis Rheum. 2010 Dec;62(12):3730-40. doi: 10.1002/art.27700.
48. Kato A, Suzuki Y, Fujigaki Y, et al. Thrombotic thrombocytopenic purpura associated with mixed connective tissue disease. RheumatolInt. 2002 Jul;22(3):122-5. Epub 2002 Jun 6.
49. Sharp GC, Irvin WS, May CM, et al. Association of antibodies to ribonucleopro-tein and Sm antigens with mixed connective tissue disease, systemic lupus erythematosus and other rheumatic diseases. N Engl J Med. 1976 Nov 18;295(21):1149-54.
50. Richez C, Blanco P, Dumoulin C, et al. Lupus erythematosus manifestations exacerbated by etanercept therapy in a patient with mixed connective tissue disease. Clin Exp Rheumatol. 2005 Mar-Apr;23(2):273.
51. Christopher-Stine L, Wigley F. Tumor necrosis factor-alpha antagonists induce lupus-like syndrome in patients with scleroderma overlap/mixed connective tissue disease. J Rheumatol. 2003 Dec;30(12):2725-7.
52. Fanto M, Salemi S, Socciarelli F, et al. A case of subcutaneous lupus erythematosus in a patient with mixed connective tissue disease: successful treatment with plasmapheresis and rituximab. Case Rep Rheumatol. 2013;2013:857694. doi: 10.1155/2013/857694. Epub 2013 Jul 28.
53. Lepri G, Avouac J, Airo P, et al. Effects of rituximab in connective tissue disorders related interstitial lung disease. Clin Exp Rheumatol. 2016 Sep-Oct;34 Suppl 100(5):181-185. Epub 2016 Oct 14.
54. Cabrera N, Duquesne A, Desjonqueres M, et al. Tocilizumab in the treatment of mixed connective tissue disease and overlap syndrom in children. RMD Open. 2016 Sep 15;2(2):e000271. eCollection 2016.
Клинические исследование Недифференцированное заболевание соединительной ткани: Наблюдение – Реестр клинических исследований
| Подробное описание | Целью этого реестра исследований является сбор информации о клинических симптомах и результаты лабораторных исследований у пациентов с недифференцированным заболеванием соединительной ткани (НДСТ). Анализ этой информации может помочь лучше предсказать прогноз для пациентов с этим форма аутоиммунного заболевания и может выявить факторы риска прогрессирования до более конкретных заболевания соединительной ткани, например системная волчанка. Это делается путем сбора информации из ваших медицинских записей, включая историю болезни, физический осмотр и лабораторные анализы результаты, и задавая вам вопросы о конкретных симптомах, которые могут у вас возникнуть, например, о боли в суставах, сыпь и другие общие симптомы НДСТ. Эта информация будет храниться в базе данных, и использовался в более позднее время для научных исследований. Все будущие исследования с использованием информации в этот реестр будет находиться под надзором Институционального наблюдательного совета УСЗ (который отвечает за надзор за исследованиями в HSS с участием людей). Все пациенты, которые ищут или получить медицинскую помощь в HSS по поводу недифференцированного заболевания соединительной ткани. участвовать в этом реестре. В большинстве будущих исследований с участием этого реестра будет использоваться только информация из этого реестра. реестра, и поэтому не потребует дальнейшего участия или дополнительной информации согласие участников реестра. Но информация в этом реестре также может быть используется для выявления пациентов, которые могут иметь право участвовать в определенных будущих исследованиях исследования, проводимые HSS, которые касаются их конкретного заболевания, состояния или лечения, и для чего нужна информация, которой нет в реестре. Если вы идентифицированы (на основании информация о вас в реестре) как потенциально подходящие для будущего исследования исследование, которое касается вашего конкретного заболевания, состояния или лечения, с вами могут связаться чтобы узнать, заинтересованы ли вы в участии в исследовании. Если ты интересно, исследование будет полностью объяснено вам, и вы должны будете дать ваше информированное согласие, прежде чем вы сможете участвовать. Если вы участвуете в этом реестре, вы от вас не потребуют участия в каких-либо будущих исследованиях, о которых HSS свяжется с вами. Участвуя в этом реестре, вас не попросят делать что-либо, что не обычно проводится в рамках обычного ухода в HSS, включая клиническую оценку, лабораторные исследования и радиологические процедуры. Во время ваших обычных посещений мы будем записывать вся информация о вас, которая относится к вашему заболеванию, состоянию или лечению, и включит эту информацию в реестр. Ваше участие будет включать минимум один раз в год во время посещения вашего ревматолога. Большинство учебных визитов рассчитано на 10-15 минут. |
|---|
Иммунология, Ревматология, Аллергология И Редкие Заболевания
ОСНОВНЫЕ ДАННЫЕ
ПРЕДСТАВЛЕННЫЕ НАПРАВЛЕНИЯ И УСЛУГИ:
- Ревматология
- Клиническая иммунология
- Аллергии
- Редкие Иммуноопосредованные состояния
- Центр инфузионной терапии
- Дневной стационар
КОЛИЧЕСТВО ПРОВОДИМЫХ ПРОЦЕДУР (В ГОД):
- 22 000 амбулаторных обследований каждый год
Отделение Иммунологии, Ревматологии, Аллергологии и редких заболеваний занимается лечением взрослых пациентов с системными ревматическими и аутоиммунными заболеваниями во всех их проявлениях, от самых частых до самых редких. Это один из крупнейших базисных центров в регионе Ломбардия, занимающихся диагностикой, лечением и исследованиями заболеваний, представляющих ревматологический и иммунопатологический интерес, а также редких заболеваний с иммуноопосредованным патогенезом. Отделение активно участвует в нескольких клинических испытаниях, предлагая тем самым новые потенциальные возможности лечения пациентам со сложными заболеваниями, не способным добиться ремиссии при помощи обычного лечения.
Для максимально качественного оказания медицинской помощи Отделение разделено на несколько специализированных подразделений, где врачи отделения могут накопить значительный и целевой опыт в области специфических ревматических и иммунологических состояний. Такая организация работы оптимизирует усилия по оказанию медицинской помощи и обеспечивает важную синергию для клинических исследований, способствуя быстрому доступу к новой информации о различных состояниях и ускоряя внедрение новых методов лечения. В отделении также имеется специализированный центр для беременных или планирующих беременность женщин с ревматическими или иммунологическими заболеваниями, где им помогают справляться с трудностями и уникальными проблемами, с которыми они сталкиваются во время беременности.
ЛЕЧЕНИЕ
Клиника Артрита
Клиника оказывает помощь взрослым пациентам с воспалительными артропатиями. Отделение специализируется на лечении пациентов с артритом, которым необходимо повысить эффективность лечения заболевания и которые могут начинать лечение с биопрепаратов и / или целевых синтетических препаратов. Пациенты с недавно начавшимся артритом (ранним артритом) напрямую направляются в эту клинику для прохождения за короткий промежуток времени полного клинического, рентгенологического, ультразвукового и биохимического обследования. Три специализированных амбулаторных учреждения и центр инфузионной терапии работают ежедневно, предлагая комплексный уход таким пациентам. Клиника также предлагает УЗИ обследование костно-мышечной системы и внутрисуставные инъекции для лечения не только пациентов с воспалительным артритом, но и пациентов с подагрой, кристаллическими артропатиями и остеоартритом. Клиника артрита тесно сотрудничает с другими специалистами (кардиологами, гастроэнтерологами, рентгенологами, дерматологами и офтальмологами), занимающимися лечением различных сопутствующих заболеваний у пациентов с воспалительными артропатиями. Клиника участвует в нескольких проектах и работает в тесном сотрудничестве с национальными и международными обществами, такими как Итальянское общество ревматологов (SIR) и Европейская лига по борьбе с ревматизмом (EULAR), и в настоящее время участвует в нескольких клинических исследованиях, а также в национальных и международных реестрах.
Основные Патологии, подлежащие лечению:
- Ревматоидный артрит
- Псориатический артрит
- Подагра и другие виды кристаллической артропатии
- Острая ревматическая лихорадка
- Реактивный артрит
- Нерадиологический спондилит
- Аксиальный спондилит (анкилозирующий спондилит)
- Остеоартрит
Клиника волчанки и заболеваний соединительной ткани
Клиника представляет собой средоточие врачей-специалистов в разных областях, предлагая современную многопрофильную и индивидуальную помощь взрослым пациентам с заболеваниями соединительной ткани. Таким образом, здесь пациентам предлагают специфическое и комплексное ревматологическое, офтальмологическе, кардиологическое, неврологическое и дерматологическое обследования. Здесь регулярно проводятся многопрофильные консилиумы по наиболее сложным случаям. Особое внимание в нашем отделении врачи уделяют беременным женщинам с заболеваниями соединительной ткани благодаря налаженному сотрудничеству с клиникой для беременных с аутоиммунными заболеваниями. Отделение также стремиться расширять уже имеющиеся знания о патогенных, клинических и терапевтических аспектах заболеваний соединительной ткани. Наше отделение является частью Итальянского реестрового исследования Волчанки (LIRE) и поддерживает тесные связи с другими национальными и международными организациями, занимающимися исследованиями заболеваний соединительной ткани.
Основные Патологии, подлежащие лечению:
- Системная красная волчанка
- Смешанное / недифференцированное заболевание соединительной ткани
- Синдром Шёгрена
- Дерматомиозит / полимиозит
- Иммунопатология беременности
Клиника склеродермии и сердечной иммунопатологии
Клиника признана Европейским (членом EUSTAR) и Национальным (членом GILS) базисным Центром склеродермии и заболеваний, связанных со склеродермией. Команда врачей клиники включает иммунологов-ревматологов с международным опытом лечения этих заболеваний и обслуживает пациентов, как с ограниченными, так и с рассеянными проявлениями системного склероза. Отделение тесно сотрудничает с другими специалистами, занимающимися лечением таких пациентов: с кардиологами, аритмологами, специалистами по респираторным болезням, гастроэнтерологами, специалистами по уходу за ранами, рентгенологами и радиоизотопными диагностами.
Отделение состоит из дневного стационара, где проводятся инъекции простагландина пациентам с трудноподдающимся лечению феноменом Рейно и язвами на пальцах, капилляроскопия и биопсия кожи. Благодаря тесному сотрудничеству этих специалистов в нашей клинике, Отделение также накопило международный опыт в лечении пациентов, страдающих от воспаления сердца (миокардит). Отделение участвует в нескольких проектах Итальянского общества ревматологов (SIR), Европейской лиги по борьбе с ревматизмом (EULAR) и Европейской группы исследований в области склеродермии (EUSTAR).
Основные Патологии, подлежащие лечению:
- Системный склероз
- Феномен Рейно
- Смешанные заболевания соединительной ткани
- Аутоиммунные интерстициальные заболевания легких
- Синдром антисинтетазных антител
- Локализованная склеродермия (морфея)
- Склеродермия диабетическая
- Склеромикседема
- Миокардит
Клиника васкулита
Клиника является национальным и международным базисным центром диагностики и лечения системного васкулита (член EUVAS). Пациенты оказываются в специализированном и многопрофильном отделении, благодаря тесному и целевому сотрудничеству с другими специалистами, занимающимися лечением васкулита (такими как рентгенологи, сосудистые хирурги, радиоизотопные диагносты, кардиологи и специалисты по уходу за ранами). Центр состоит из отделения инфузионной терапии для внутривенной биологической терапии и дневного стационара для лечения циклофосфамидом и внутривенного введения стероидов. Центр участвует в нескольких проектах основных национальных и международных сообществ: Итальянского общества ревматологов (SIR), Итальянского общества аллергологов и клинических иммунологов (SIAAIC), Европейской лиги по борьбе с ревматизмом (EULAR), Американского колледжа ревматологии (ACR) и Европейской группы по изучению васкулита (EUVAS). Отделение проводит исследования в нескольких направления для изучения патогенных факторов и новых потенциальных терапевтических методов для подобных заболеваний, и в настоящее время участвует в нескольких клинических исследованиях, а также в национальных и международных реестровых исследованиях.
Основные Патологии, подлежащие лечению:
- Синдром Такаясу
- Гигантоклеточный (височный) артериит
- Ревматическая полимиалгия (ПМР)
- Гранулематоз с полиангиитом (болезнь Вегенера)
- Эозинофильный гранулематоз с полиангиитом (Синдром Чарга-Стросса)
- Криоглобулинемия
- IgA васкулит (пурпура Шёнлейна — Ге́ноха)
- нодозный полиартериит (PAN)
- Микроскопический полиангиит (МПА)
Клиника оказывает специализированную помощь взрослым пациентам с редкими расстройствами, начиная от аутовоспалительных состояний (таких как Болезнь Стилла, развившаяся у взрослых, и синдромы периодической лихорадки), до болезни Бехчета, саркоидоза, нодозная эритема и ретроперитонеального фиброза. Клиника также активно наблюдает за крупнейшими европейскими одноцентровыми группами пациентов с IgG4-связанным заболеванием и с болезнью Эрдгейма-Честера, и кроме того поддерживает международное сотрудничество с ведущими исследовательскими институтами, что позволило сделать крупные открытия и разработать инновационные стратегии лечения в этих областях. Центр предлагает пациентам с такими редкими заболеваниями высокопрофессиональную медицинскую помощь, постоянную поддержку и индивидуальный подход к лечению.
Основные Патологии, подлежащие лечению:
- Болезнь Стилла, развившаяся у взрослых, и другие аутовоспалительные заболевания
- Болезнь Бехчета
- Саркоидоз
- Нодозная эритема (EN)
- Болезнь Эрдгейма Честера
- IgG4-связанное заболевание
- Ретроперитонеальный фиброз
Клиника первичного иммунодефицита взрослых
Клиника предлагает несколько видов услуг для пациентов с иммунодефицитом (как с генетически детерминированными видами иммунодефицита, так и с иммунодефицитами, являющимися вторичными в результате лечения других состояний), включая исследование его причины, ведение пациентов в течение всей жизни, внутривенную иммуноглобулиновую заместительную терапию и обучение подкожной терапии в домашних условиях. Мы предлагаем специфическую услугу помощи при переходе пациентов юношеского возраста из детских отделений во взрослые для последующего лечения и непосредственно лечение осложнений.
Основные Патологии, подлежащие лечению:
- Агаммаглобулинемия
- Специфический дефицит антител
- Вариабельный неклассифицируемый иммунодефицит
- Изолированный дефицит подкласса IgG
- Избирательный дефицит IgM
- Избирательный дефицит IgA
- Тяжелый комбинированный иммунодефицит
- Тимома с иммунодефицитом
- Аутоиммунный лимфопролиферативный синдром
- хроническая гранулематозная болезнь
- синдром ДиДжорджи
- синдром Вискотта-Олдрича
- синдром гипер-IgE
- комбинированный иммунодефицит
- Латрогенный иммунодефицит
Клиника фибромиалгии
Клиника оказывает специализированную помощь пациентам с фибромиалгией и синдромом хронической усталости в специализированных медицинских центрах. В настоящее время Клиника наблюдает большую группу пациентов и тесно сотрудничает с пациентскими организациями для выявления неудовлетворенных клинических нужд и выработки более индивидуальных для пациентов подходов. Кроме того, Отделение делает активный вклад в исследования, направленные на понимание патогенеза такого состояния: первичное на уровне учреждения, а также международное сотрудничество в областях клеточной нейрофизиологии, нейропсихологии, иммунологии и воспаления позволило сделать весьма многообещающие доклинические открытия, терапевтический потенциал которых теперь изучается.
Основные Патологии, подлежащие лечению:
- Фибромиалгии
- Синдром хронической усталости
Аллергия
Отделение занимается лечением взрослых пациентов со всеми видами аллергических состояний и проводит обследования in-vivo и in-vitro для точной диагностики и классификации их.
Отделение специализируется на лечении аллергического ринита и рино-конъюнктивита, аллергической астмы, аллергии и непереносимости пищевых продуктов и пищевых добавок, контактного и атопического дерматита, а также реакций гиперчувствительности к насекомым и укусам насекомых.
Отделение широко известно своими методами диагностики и лечения аллергии и гиперчувствительности к лекарственным препаратам, контрастным веществам, биологическим препаратам и противораковым агентам. В отделении были разработаны несколько протоколов десенсибилизации, позволяющие страдающим такими состояниями пациентам безопасно получать эти методы лечения.
Основные Патологии, подлежащие лечению:
- Аллергический ринит
- Риноконъюнктивит
- Аллергическая астма
- Пищевая аллергия и / или непереносимость
- Гиперчувствительность к и / или аллергическая реакция на
- Насекомых и укусы насекомых
- Лекарственные препараты (в том числе биологические препараты)
- Противораковые агенты
СОВРЕМЕННОЕ ТЕХНОЛОГИЧЕСКОЕ ОБОРУДОВАНИЕ
- Видео капилляроскопия
- Суставное УЗИ с энергетической допплерографией
- Полностью оборудованная современная палата инфузионной терапии для приема биологических препаратов и специфических методов лечения
Заболевания суставов и соединительной ткани
Заболевания, при которых поражаются суставы и суставной аппарат – мышцы, кости, хрящ и сухожилия, считаются болезнями соединительной ткани, поскольку все вышеназванные структуры состоят по большей части именно из нее. Многие болезни соединительной ткани связаны с аутоиммунными процессами. Последние же заключаются в том, что по каким-то причинам иммунная система начинает реагировать на собственные ткани организма и вырабатывать атакующие их патологические антитела (аутоантитела).Иммунные реакции сопровождаются воспалением, которое в норме является защитным процессом и стихает, когда отпадает необходимость в защите. Однако при аутоиммунных болезнях воспаление может стать хроническим и привести к повреждению нормальных тканей. Например, при ревматоидном артрите в результате хронического воспаления поражаются суставные хрящи. При этом страдают несколько суставов, так как антитела циркулируют с кровью по всему организму.
Воспаление может развиваться в соединительной ткани внутри и вокруг суставов, а также в других тканях организма. Обычно в воспалительный процесс вовлекаются и мышцы, а иногда и оболочки, которые окружают сердце (перикард), легкие (плевра) и даже мозг. Характер и тяжесть симптомов зависят от того, какие органы поражены.
Диагностика всех аутоиммунных болезней основывается на типичных симптомах, результатах общего осмотра и лабораторных анализов. Иногда бывают такие сочетания симптомов, что невозможно поставить диагноз конкретного заболевания соединительной ткани. В этих случаях диагностируется недифференцированное заболевание соединительной ткани или перекрестный синдром.
Болезни соединительной ткани часто сопровождаются анемией (снижением содержания эритроцитов в крови). При этом в анализах крови определяется увеличение скорости оседания эритроцитов (СОЭ). Увеличение этого показателя свидетельствует о наличии активного воспалительного процесса в организме, но не позволяет определить причину воспаления. Контролируя СОЭ, врач может определить, идет ли болезнь на убыль параллельно уменьшению симптомов.
При некоторых болезнях соединительной ткани в крови могут быть обнаружены необычные антитела. При наличии антител, специфических для какой-либо болезни, подтверждается диагноз соответствующей болезни. Например, антитела к двухспиральной ДНК выявляются почти исключительно при системной красной волчанке. Однако при большинстве болезней соединительной ткани антитела не специфичны. Например, у 70% больных ревматоидным артритом обнаруживаются антитела, называемые ревматоидным фактором, но у остальных больных их нет; кроме того, ревматоидный фактор может выявляться и при некоторых других заболеваниях. В таких случаях результаты лабораторного исследования хотя и помогают врачу в диагностике, но не позволяют поставить точный диагноз.
Когда болезнь поражает определенную ткань или орган, врач может сделать биопсию, то есть взять образец ткани из этого органа и исследовать ее под микроскопом. Результаты позволяют подтвердить диагноз и контролировать течение болезни.
Лечение зависит от вида болезни и степени ее тяжести. Лекарственная терапия назначается для уменьшения воспаления. Когда воспаление вызывает тяжелые симптомы или угрожает жизни, интенсивное лечение должно быть начато немедленно.
К лекарствам, уменьшающим воспаление, относятся нестероидные противовоспалительные средства (НПВС), например аспирин и ибупрофен, которые применяются при легких формах указанных заболеваний и внезапных обострениях. Эти препараты обладают также болеутоляющим действием. Некоторые НПВС можно приобрести без рецепта, но препараты, содержащие их в высоких дозировках, как правило необходимых при лечении аутоиммунных болезней, продаются по рецепту. Если лекарство принимается в средних дозах в течение недолгого времени, побочные эффекты (наиболее частый из них – расстройство желудка) чаще всего незначительны. Но бывают и тяжелые множественные побочные эффекты, особенно если лекарство принимается в высоких дозах или в течение длительного времени.
Кортикостероиды – синтетические препараты естественных гормонов; они обладают очень мощным противовоспалительным действием. Эти препараты назначаются внутрь или в инъекциях. Преднизолон – наиболее широко используемый кортикостероид – принимают внутрь. Низкие дозы кортикостероидов иногда приходится принимать в течение нескольких месяцев или лет даже после того, как воспаление подавлено более высокими дозами препаратов. По сравнению с НПВС кортикостероиды вызывают гораздо более тяжелые побочные эффекты – повышение уровня сахара в крови, увеличение риска инфекционных осложнений, остеопороз, задержку воды в организме и повреждение кожи. Во избежание этого врач обычно назначает минимально эффективную дозу, особенно для длительного лечения.
Иммунодепрессанты (препараты, подавляющие иммунитет), такие как метотрексат, азатиоприн и циклофосфамид, подавляют иммунную реакцию и тем самым уменьшают воспаление. Эти лекарства (некоторые из них используются также для лечения онкологических заболеваний) могут иметь опасные побочные эффекты. При длительном применении азатиоприна и циклофосфамида увеличивается риск развития отдельных видов злокачественных новообразований. Некоторые иммунодепрессанты негативно влияют на репродуктивную (детородную) функцию. Из-за подавления иммунитета самые обычные инфекции могут представлять угрозу для жизни. Поэтому наиболее мощные иммунодепрессанты, как правило, назначаются только в тяжелых случаях.
Терапия » Недифференцированные дисплазии соединительной ткани (проект клинических рекомендаций)
Недифференцированные дисплазии соединительной ткани (проект клинических рекомендаций)
DOI: https://dx.doi.org/10.18565/therapy.2019.7.9-42
Публикуемый проект второго пересмотра клинических рекомендаций по ведению пациентов с недифференцированными дисплазиями соединительной ткани продиктован наличием обоснованных дополнений/замечаний к ранее утвержденным (в 2018 г.) клиническим рекомендациям.
Литература
- Большая медицинская энциклопедия, 3-е изд. под ред. Б.В. Петровского. Режим доступа: http://бмэ.орг/index.php/дисплазия (дата обращения: 10.10.2019).
- Яковлев В.М., Нечаева Г.И., Мартынов А.И., Викторова И.А. Дисплазия соединительной ткани в практике врачей первичного звена здравоохранения: Руководство для врачей. М.: КСТ Интерфорум. 2016; 520 с.
- Клинические рекомендации российского научного медицинского общества терапевтов по диагностике, лечению и реабилитации пациентов с дисплазиями соединительной ткани (первый пересмотр). Медицинский вестник Северного Кавказа. 2018; 1,2(13): 137–210.
- Нечаева Г.И., Мартынов А.И. Дисплазия соединительной ткани: сердечно-сосудистые изменения, современные подходы к диагностике и лечению. Москва: ООО «Медицинское информационное агентство». 2017; 400 с.
- Кадурина Т.И., Горбунова В.Н. Дисплазия соединительной ткани: рук.для врачей. СПб.: Элби, 2009; 704 с.
- Наследственные нарушения соединительной ткани в кардиологии. Диагностика и лечение. Российские рекомендации (1-й пересмотр). Российский кардиологический журнал. 2013; 1: 32.
- Merlocco A., Lacro R.V., Gauvreau K., Rabideau N., Singh M.N., Prakash A. Longitudinal changes in segmental aortic stiffness determined by cardiac magnetic resonance in children and young adults with connective tissue disorders (the Marfan, Loeys-Dietz, and Ehlers-Danlos Syndromes, and nonspecific connective tissue disorders). Am J Cardiol. 2017; 120(7):1214–19.
- Викторова И.А., Нечаева Г.И., Киселева Д.С. Калинина И.Ю. Дисплазия соединительной ткани: особенности амбулаторного ведения пациентов в различных возрастных периодах. Лечащий врач. 2014; 9: 76–81.
- Друк И.В., Нечаева Г.И., Осеева О.В. и др. Персонифицированная оценка риска развития неблагоприятных сердечно-сосудистых осложнений у пациентов молодого возраста с дисплазией соединительной ткани. Кардиология. 2015; 3: 75–84.
- Международная классификация болезней 10-го пересмотра (МКБ-10). Режим доступа: http://mkb-10.com/ (дата обращения: 09.10.2019).
- Конев В.П., Голошубина В.В., Московский С.Н. Особенности формулирования судебно- медицинского диагноза при синдроме дисплазии соединительной ткани. Вестник судебной медицины. 2017; 6(2): 22–26.
- Арсентьев В.Г., Баранов В.С., Шабалов Н.П. Наследственные заболевания соединительной ткани как конституциональная причина полиорганных нарушений у детей. Санкт-Петербург: СпецЛит. 2015; 231 с.
- Яковлев В.М., Нечаева Г.И. Кардиореспираторные синдромы при дисплазии соединительной ткани. Омск. 1994; 217 с.
- Клинические рекомендации Российского научного медицинского общества терапевтов. Дисплазии соединительной ткани (первый пересмотр, сокращенный вариант). Терапия. 2018; 6: 10–58.
- Кильдиярова Р.Р., Углова Д.Ф. Ассоциированная с дисплазией соединительной ткани кардиальная патология у женщин и их новорожденных детей. Российский вестник перинатологии и педиатрии. 2015; 2(60): 54–56.
- Яворская М.В., Кравцов Ю.А., Кильдиярова Р.Р., Кучеров В.А., Матвеев С.В. Критерии диагностики синдрома дисплазии соединительной ткани и задержки полового развития у детей и подростков. Уральский медицинский журнал. 2017; 8: 111–117.
- Семенова Е.В., Семенкин А.А., Чиндарева О.И., Махрова Н.В., Нечаева Г.И., Потапов В.В., Живилова Л.А., Логинова Е.Н. Оптимизация подхода к определению расширения корня аорты при недифференцированной дисплазии соединительной ткани. Кардиология: новости, мнения, обучение. 2017; 1(12): 35–39.
- Конев В.П., Московский С.Н., Коршунов А.С. и др. Использование атомно-силовой микроскопии в изучении плотных тканей орофациальной области. Казанский медицинский журнал. 2012; 6: 887–891.
- Конев В.П., Шестель И.Л., Московский С.Н. и др. Атомно-силовая микроскопия в диагностике патологии соединительной ткани: семиотика твердых тканей зубов и костной ткани. Материалы VIII Международной научно-практической конференции. Москва, 2011; 105–109.
- Тюрин А.В., Хусаинова Р.И., Лукманова Л.З., Давлетшин Р.А., Хуснутдинова Э.К. Поиск маркеров генетической предрасположенности к развитию гипермобильности суставов и остеоартрита у больных из республики Башкортостан. Молекулярная медицина. 2016; 14(6): 41–47.
- Тюрин А.В., Хусаинова Р.И., Хуснутдинова Н.Н., Давлетшин Р.А., Хуснутдинова Э.К. Поиск ассоциаций полиморфных вариантов гена рецептора витамина D (VDR) с остеоартритом и дисплазией соединительной ткани. Медицинская генетика. 2014; 13(9.147): 18–27.
- Хусаинова Р.И., Тюрин А.В., Шаповалова Д.А., Хуснутдинова Э.К. Генетические маркеры остеоартрита у женщин с недифференцированной дисплазией соединительной ткани. Генетика. 2017; 53(7): 816–826.
- Громова О.А., Торшин И.Ю., Калачева А.Г., Гришина Т.Р. О синергизме калия и магния в поддержании функции миокарда. Кардиология. 2016; 56(3): 73–80.
- Громова О.А., Торшин И.Ю., Юдина Н.В. и др. Дефицит магния и нарушения регуляции тонуса сосудов. Кардиология. 2014; 54(7): 66–72.
- Мамедов М.Н. Назначение высоких доз магния для лечения аритмий: показания, основанные на доказательствах. Клиническая фармакология и лекарственные средства. 2013; 2: 43–45.
- Трисветова T.Е. Магний в клинической практике. Фармакотерапия в кардиологии. 2012;4 (8):545–553.
- Громова О.А., Калачева А.Г., Торшин И.Ю. и др. Недостаточность магния – достоверный фактор риска коморбидных состояний: результаты крупномасштабного скрининга магниевого статуса в регионах России. Фарматека. 2013; 6(259): 115–129.
- Нечаева Г.И., Дрокина О.В., Колменкова И.В. Эффективность терапии препаратом мексикор у пациентов при вегетативно-сосудистой дисфункции с недифференцированными формами дисплазии соединительной ткани. Архив внутренней медицины. 2012; (8): 26–32.
- Бабаджанова Н.Э. Психовегетативные нарушения у больных нейроциркуляторной дистонией и возможность их коррекции. Архив внутренней медицины. 2016; 1: 110.
- Особенности психологического статуса лиц молодого возраста с дисплазией соединительной ткани. Друк И.В., Логинова Е.Н., Вершинина М.В., Лялюкова Е.А., Дрокина О.В. Омский психиатрический журнал. 2019; 3(21): 5–9.
- Pervichko E., Zinchenko Y., Martynov A., Akatova E. Assessment of psychological well-being dating and dynamics of clinical symptoms in mitral valve prolapse patients with anxiety disorders receiving long-term integrative psychotherapy. European Psychiatry. 2015; 30 (1S): 1652.
- Воробьева О.В. Полинейропатии, обусловленные соматическими заболеваниями: подходы к диагностике, основные направления лечения. Consilium Medicum. Неврология и ревматология. 2016; 01: 74–78.
- Вершинина М.В., Нечаева Г.И., Хоменя А.А., Дрокина О.В. Эффективность медицинской реабилитации при бронхолегочном синдроме у пациентов с дисплазией соединительной ткани. Медицинский вестник Северного Кавказа. 2015; 10(1): 50–55.
- Аллергология. Федеральные клинические рекомендации. Под ред. акад. РАН Р.М. Хаитов, проф. Н.И. Ильина. М.: «Фармарус Принт Медиа», 2014. 126 с.
- Кононова, Н.Ю., Чернышова Т.Е., Загртдинова Р.М. Оценка биологического возраста и темпа старения у пациенток с недифференцированной дисплазией соединительной ткани. Архив внутренней медицины. 2017; 7(4): 287–291.
- Кононова Н.Ю., Чернышева Т.Е., Стяжкина С.Н. Является ли дисплазия соединительной ткани предиктором преждевременного старения? (результаты 5-летнего мониторинга). Медицинский вестник Северного Кавказа. 2016; 11(2.2): 326–330.
- Громова О.А., Торшин И.Ю., Калачева А.Г., Гришина Т.Р. О синергизме калия и магния в поддержании функции миокарда. Кардиология. 2016; 56(3): 73–80.
- Малев Э.Г., Ким Г.И., Митрофанова Л.Б., Омельченко М.Ю., Земцовский Э.В. Функция левого желудочка при пролапсе митрального клапана, осложненном тяжелой митральной недостаточностью. Российский кардиологический журнал. 2013; 1 (99): 37–41.
- 3Пролапс митрального клапана. Клинические рекомендации. 2016; 21 с.
- Голицын С.П., Кропачева Е.С., Майков Е.Б., Миронов Н.Ю., Панченко Е.П., Соколов С.Ф., Шлевков Н.Б. Клинические рекомендации по диагностике и лечению нарушений ритма сердца и проводимости. Неотложная кардиология. 2013; 104.
- Рекомендации ESC по лечению пациентов с желудочковыми нарушениями ритма и профилактике внезапной сердечной смерти 2015. Российский кардиологический журнал. 2016; 7 (135): 5–86.
- Рекомендации ESC по лечению пациентов с фибрилляцией предсердий, разработанные совместно с EACTS Российский кардиологический журнал 2017, 7 (147): 7–86. http://dx.doi.org/10.15829/1560-4071-2017-7-7-86
- 4Guidelines for the diagnosis and management of syncope. European Heart J. 2018; VAA-21: 1–69. doi: 10.1093/eurheartj/ehy037
- Шляхто Е.В., Арутюнов Г.П., Беленков Ю.Н., Ардашев А.В. Национальные Рекомендации по определению риска и профилактике внезапной сердечной смерти. Архив внутренней медицины. 2013;(4):5–15.
- Национальные рекомендации по определению риска и профилактике внезапной сердечной смерти (2-ое издание). М.: ИД «Медиапрактика-М». 2018; 247 с.
- Kelly R.E. Jr., Mellins R.B., Shamberger R.C. et al. Multicenter study of pectus excavatum, final report: complications, static/exercise pulmonary function, and anatomic outcomes. J. Am. Coll. Surg. 2013; 217(6): 1080–89.
- Хирургическое лечение синдромальных сколиозов. Клинические рекомендации. Новосибирск, 2013; 34 с.
- Ортопедия. Клинические рекомендации под ред. С.П. Миронова. ГЭОТАР-Медиа, 2018; 784 с.
- Миопия. Клинические рекомендации. 2017; 48 с.
- Котова О.В., Акарачкова Е.С. Астенический синдром в практике невролога и семейного врача. Российский медицинский журнал. 2016; 13: 824–829.
- Нечаева Г.И., Логинова Е.Н., Вершинина М.В. Ведущие причины повышения давления в малом круге кровообращения у пациентов с дисплазией соединительной ткани. Лечащий врач. 2016; 3.
- Рекомендации ESC/ERS по диагностике и лечению легочной гипертензии 2015. Российский кардиологический журнал. 2015; 5(133): 5–64.
- Konstantinides S.V., Torbicki A., Agnelli G. et al. ESC Guidelines on the diagnosis and management of acute pulmonary embolism. The Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC) Endorsed by the European Respiratory Society (ERS). Russ. J. Cardiol. 2015; 8(124): 67–110.
- 2018 ЕОК/ЕОАГ Рекомендации по лечению больных с артериальной гипертензией. Российский кардиологический журнал. 2018; 23(12): 143–228.
- Меморандум экспертов Российского кардиологического общества по рекомендациям Европейского общества кардиологов/Европейского общества по артериальной гипертензии по лечению артериальной гипертензии 2018 г. Российский кардиологический журнал. 2018; 23(12): 131–142.
- Смяловский В.Э., Друк И.В., Смяловский Д.В. Особенности течения интракраниальных артериальных аневризм и артериовенозных мальформаций у пациентов с дисплазией соединительной ткани. Журнал неврологии и психиатрии им. С.С. Корсакова. 2014; 114(8): 304–305.
- Erbe R., Aboyans V., Boileau C., Bossone E., D. Bartolomeo R., Eggebrecht H., Evangelista A., Falk V., Frank H. et al. ESC Guidelines on the diagnosis and treatment of aortic diseases. The Task Force for the Diagnosis and Treatment of Aortic Diseases of the European Society of Cardiology (ESC). Eur. Heart J. 2014; 35(41): 2873–926.
- Лялюкова Е.А., Нечаева Г. И., Ливзан М. А. и др. Недостаточность питания у пациентов с дисплазией соединительной ткани: роль постпрандиальных гемодинамических нарушений, подходы к терапии. Лечащий врач. 2015; 3: 67–70.
- Рекомендации Российской гастроэнтерологической ассоциации и ассоциации колопроктологов России по диагностике и лечению взрослых больных дивертикулярной болезнью ободочной кишки. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2016; 1: 65–80.
- Нечаева Г.И., Логинова Е.Н., Цуканов А.Ю., Семенкин А.А., Фисун Н.И., Дрокина О.В. Патология почек при дисплазии соединительной ткани: междисциплинарный подход. Лечащий врач. 2016; 1: 54–57.
- Перепанова Т.С. с соавт. Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов. Федеральные клинические рекомендации. М.: ООО «Прима-принт». 2015; 72 с.
- Кудинова Е.Г. Особенности беременности у пациенток с аномальным коллагенообразованием и нарушениями системы гемостаза. РМЖ. 2016; 15: 1026–32.
- Кудинова Е. Г. Риск репродуктивных нарушений у девочек-подростков с дисплазией соединительной ткани. Репродуктивное здоровье детей и подростков. 2013; 4: 31–32.
- Приказ Минздрава России от 12.11. 2012 № 572н.
- Нечаева Г.И., Друк И.В., Логинова Е.Н., Смольнова Т.Ю., Шупина М.И., Викторова И.А., Семенкин А.А., СеменоваЕ.В. Современные подходы к ведению беременности и родов у пациенток с синдромом Марфана. Медицинский вестник Северного Кавказа. 2016; 11(2): 363–368.
- Диагностика и лечение сердечно-сосудистых заболеваний при беременности. Национальные рекомендации. Российский кардиологический журнал. 2018; 3(155): 91–134.
- Смольнова Т.Ю., Адамян Л.В. Рассечение промежности в родах и леваторопластика у женщин с дисплазией соединительной ткани. Показания и противопоказания. Сб. научн. Трудов: Новые технологии в диагностике и лечении гинекологических заболеваний. Москва, 2013; 175–176.
- Смольнова Т.Ю. Пролапс гениталий и дисплазия соединительной ткани. Клиническая и экспериментальная хирургия. 2015; 2: 53–64.
- Федеральные клинические рекомендации по диагностике и лечению железодефицитной анемии. 2014; 16.
- Кудинова Е.Г., Лыдина И.В., Тараненко И.А. и др. Предикторы риска тромботических осложнений у беременных с мезенхимальной дисплазией. Проблемы клинической медицины. 2012; 4(26–29): 117–123.
- Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений (ВТЭО). Флебология. 2015; 4(2): 1–52.
- Рекомендации ESC по диагностике и ведению пациентов с острой эмболией системы легочной артерии 2014. Российский кардиологический журнал. 2015; 8 (124): 67–110. http://dx.doi.org/10.15829/1560-4071-2015-08-67-110
- Викторова И.А., Киселева Д.С., Кульниязова Г.М. Синдром гипермобильности суставов: диагностика и лечение пациентов в амбулаторной практике диагностика и лечение пациентов в амбулаторной практике. Лечащий врач.2014; 4: 62–69.
- Остеопороз. Клинические рекомендации. 2016; 104 с.
- Кадурина Т.И., Аббакумова Л.Н. Принципы реабилитации больных с дисплазией соединительной ткани. Лечащий врач. 2010; 4: 28–31.
- Дубилей Г.С., Исаева А.С., Фомина О.А. с соавт. Немедикаментозные методы восстановительного лечения пациентов с дисплазией соединительной ткани на этапах медицинской реабилитации. Комплексная реабилитация: наука и практика. 2010; 5(13): 52–56.
- Приказ Министерства здравоохранения РФ от 13.03.2019 № 124н «Об утверждении порядка проведения профилактического медицинского осмотра и диспансеризации определенных групп взрослого населения».
- Друк И.В., Нечаева Г.И., Лялюкова Е.А., Дрокина О.В. Кардиоваскулярные синдромы дисплазии соединительной ткани у лиц молодого возраста: частота регистрации, факторы формирования. Лечащий врач. 2014; 6: 72–75.
Недифференцированное заболевание соединительной ткани – консультант по ревматологии
Есть ли у этого пациента недифференцированное заболевание соединительной ткани?
Недифференцированное заболевание соединительной ткани (НДСТ) – это термин, предложенный Лероем 30 лет назад для обозначения аутоиммунного заболевания, которое не соответствует критериям установленных заболеваний, таких как системная красная волчанка, склеродермия, дерматомиозит, синдром Шегрена, васкулит или ревматоидный артрит.
Обычно пораженное население состоит из молодых женщин, как и популяция молодых пациентов с системной красной волчанкой (СКВ).Поэтому сложно признать эту сущность незаметной, а не просто представляющей раннее проявление одной из вышеупомянутых групп. Действительно, около 70% пациентов, у которых определена ранняя НДСТ, сохранят свои проявления, в то время как 30% будут развиваться и быть переклассифицированы. Хотя в настоящее время нет принятых критериев определения НДСТ ни Американским колледжем ревматологии (ACR), ни Европейской лигой против ревматизма (EULAR), ряд авторов, в частности Моска и Бомбардьери, писали об этой проблеме за последнее десятилетие.Они предложили критерии включения, а также исключения.
Наиболее частыми проявлениями этого синдрома являются артралгия / миалгия, артрит, феномен Рейно, синдром сухости и утомляемость. Большинство авторов предлагают включить в эту группу пациента с положительной АНА. Реже встречаются крапивница, светочувствительность, изъязвления слизистой оболочки, серозит, тиреоидит, цитопения и сыпь.
Помимо ANA, серологические исследования для тестирования в основном служат для исключения пациентов из категории определенного заболевания соединительной ткани.Некоторые могут предсказать эволюцию в сторону СКВ. В следующем разделе приводится выборка обычно получаемых серологий.
Недавние исследования недифференцированного заболевания соединительной ткани
В литературе описана связь НДСТ с идиопатической неспецифической интерстициальной пневмонией (NSIP). В то время как только 20% когорт НДСТ будут иметь поражение легких, высокий процент пациентов с идиопатической неспецифической интерстициальной пневмонией будет иметь НДСТ. Недавняя классификация интерстициального заболевания легких Американским торакальным обществом отделила NSIP от обычного интерстициального пневмонита (UIP).Первое проявляется однородным рисунком клеточного инфильтрата или фиброза при биопсии, ретикулярным рисунком, тракционными бронхоэктазами или матовым стеклом при КТ высокого разрешения и хорошим прогнозом (положительный ответ на стероиды). UIP, с другой стороны, выявляет выраженный фиброз без значительного клеточного инфильтрата при биопсии, ретикулярный узор, сотовые бронхоэктазы с переменной тракцией при КТ высокого разрешения (HRCT) и неблагоприятное течение.
Поскольку болезнь Рейно является общим признаком как НДСТ, так и определенного ревматического заболевания (СКВ, склеродермия, дерматомиозит и ревматоидный артрит (РА), были предприняты попытки определить морфологические, а также биохимические аномалии сосудистой сети этих пациентов.В одном исследовании петли типа склеродермии были обнаружены у небольшого процента пациентов с НДСТ (примерно 14%), что указывает на повышенный риск прогрессирования склеродермии в этой группе. Вторую группу пациентов с первичной болезнью Рейно наблюдали в течение почти пяти лет, и петли склеродермии наблюдались до прогрессирования склеродермии, дерматомиозита, синдрома перекрытия со склеродермией и заболевания смешанных связанных тканей.
Эндотелиальная дисфункция также была обнаружена у молодых пациентов с НДСТ, проявляющейся как зависимыми от оксида азота, так и независимыми механизмами.
Витамин D и его влияние на иммунную систему вызывает повышенный интерес в последнее десятилетие. Было высказано предположение о более высокой частоте аутоиммунных заболеваний у пациентов с дефицитом витамина D. Сообщалось, что пациенты с НДСТ с низким уровнем витамина D имеют более высокую скорость прогрессирования до определенного заболевания соединительной ткани. Недавние данные свидетельствуют о том, что у некоторых пациентов с НДСТ наблюдается повышенная выработка интерферона-γ (активность Т-хелпера 1) и сниженное количество регуляторных Т-клеток (nTreg).Кроме того, было показано, что лечение витамином D (альфакальцидол) снижает уровни цитокинов, связанных с Th2 и Th27, и увеличивает количество nTreg.
Какие тесты проводить?
Диагностическое обследование
Следующие ниже тесты следует рассматривать как часть обязательной оценки пациента с предполагаемым аутоиммунным заболеванием. Они назначаются при предъявлении и повторяются с интервалами, определяемыми течением пациента, но часто с ежегодными интервалами у стабильного пациента для оценки активности и характера заболевания.
Ревматоидный фактор и антитела против цитруллинированного циклического пептида (анти-ЦЦП) – хотя первые могут присутствовать при НДСТ, сочетание положительного ревматоидного фактора (РФ) и ЦКП настоятельно предполагает ревматоидный артрит.
ANA (антинуклеарные антитела) – этот тест считается основным включением, обозначающим аутоиммунитет. В настоящее время это обычно выполняется на клетках HEp-2 и определяется по образцу и титру. В UCTD наиболее распространенный узор будет пятнистым или, реже, однородным.Ядрышковые и антицентромерные паттерны могут указывать на раннюю склеродермию и периферический паттерн СКВ. Титры могут быть низкими или высокими без особого значения.
- Антитело против ДНК
– это обычно наблюдается при СКВ и должно склонить клинициста к такому диагнозу.
белков комплемента C3 и C4 – обычно нормальное при НДСТ. Снижение любого из них должно иметь тенденцию к развитию СКВ, синдрома Шегрена и иммунного комплекса, вызывающего васкулит, то есть криоглобулинемии.
См – высокоспецифичный для СКВ.
Рибонуклеопротеины (РНП) – часто наблюдаются при СКВ, но могут сохраняться при НДСТ
Антигистоновые антитела – следует заказывать при подозрении на лекарственную волчанку.
SSA / B (Ro / La) – часто наблюдается при СКВ, подострой ЛЭ и синдроме Шегрена, но SSA может присутствовать при НДСТ с симптоматическими явлениями сухости и без них.
Антицентромерные и Scl-70 антитела – они высокоспецифичны для ограниченной (синдром CREST) и генерализованной склеродермии, соответственно, у пациентов с симптомами.В то время как оба могут наблюдаться у пациентов без признаков склеродермии или в случае антицентромерных антител при первичном билиарном циррозе, их присутствие в сочетании с синдромом Рейно предполагает эволюцию в сторону этих образований. Изолированный анти-Scl-70 редко наблюдается у здорового человека и может не предсказывать развитие склеродермии.
Панели антител против кардиолипина и гликопротеина бета 2 – они связаны с синдромом первичных антифосфолипидных антител и с СКВ.Антитела без патогенности или с меньшей патогенностью могут наблюдаться при хронических инфекциях.
Антитела к антигенам миозита – ассоциированы с полимиозитом и дерматомиозитом. Anti-Jo-1 ассоциируется с дерматомиозитом, пальцевым дерматитом («руки механика») и интерстициальным заболеванием легких.
Ангиотензинпревращающий фермент – наблюдается у 50% пациентов с саркоидозом, состоянием, которое имитирует заболевание соединительной ткани, с конституциональными симптомами, болью в суставах и часто положительным ANA и ревматоидным фактором.
Рентген грудной клетки (CXR) должен быть получен у всех пациентов, чтобы исключить паренхиматозное заболевание, то есть интерстициальный фиброз, а также исключить аденопатию, которая может указывать на саркоидоз или лимфому, проявляющуюся как паранеопластический синдром.
Другие анализы могут быть проведены на основании конкретных жалоб или результатов пациента:
Компьютерная томография (КТ) функциональных тестов грудной клетки или легких у пациентов с симптомами или аномалиями рентгенографии.КТ может быть особенно полезна для определения интерстициального заболевания как матового стекла в случае INIP, в отличие от сотовой связи, наблюдаемой при обычной интерстициальной пневмонии (UIP).
Электромиограмма (ЭМГ) у пациентов с миалгией или повышенным уровнем креатинкиназы (КК).
УЗИ или МРТ суставов для исключения эрозии в соответствующих условиях.
Биопсия малой слюнной железы, если рассматривается синдром Шегрена.
Капиллярная микроскопия у пациентов с синдромом Рейно. Расширенные петли типа склеродермии наблюдаются как при склеродермии, так и при дерматомиозите.
Биопсия (спросите себя: когда необходима биопсия? Как интерпретировать результаты? Каковы следующие шаги?)
Биопсия выполняется при обнаружении определенных отклонений и вероятности диагностического результата.
Биопсия кожи выполняется для исключения васкулита, кожной волчанки, дерматомиозита и склеродермии
Биопсия мышц выполняется при повышении КК и отклонении от нормы на ЭМГ или магнитно-резонансной томографии (МРТ) мышц
Биопсия лимфатических узлов, эксцизионная или тонкоигольная аспирация, когда лимфаденопатия обнаружена и считается клинически значимой (исключить лимфому, саркоидоз).
Биопсия легкого может быть показана при обнаружении интерстициального заболевания легких (различают обычную интерстициальную пневмонию [UIP] и неспецифическую интерстициальную пневмонию [NSIP] и другие интерстициальные пневмонии).
Биопсия малой слюнной железы или околоушной железы может позволить диагностировать синдром Шегрена или саркоидоз.
Как следует вести пациентов с недифференцированным заболеванием соединительной ткани?
Ведение пациентов с НДСТ, как и пациентов с СКВ, основывается на симптоматических проявлениях, указанных ниже, или на конкретных данных, когда было показано, что лечение положительно влияет на исход.Основное предположение состоит в том, что пациенты обычно имеют благоприятное течение.
Положительная серология – при отсутствии проблем со специфическим органом только положительная серология не лечится.
Артралгия и артрит – поскольку в большинстве случаев пациенты не имеют выраженного синовита, ведущего к эрозивному заболеванию, обезболивание ацетаминофеном или нестероидными противовоспалительными препаратами (НПВП) может быть достаточным и назначаться «по мере необходимости».При более стойких жалобах и / или явном артрите (синовите) к НПВП могут быть добавлены противомалярийные (хлорохин или гидроксихлорохин) или более сильнодействующие иммунодепрессанты (например, метотрексат).
Миалгия – что касается артралгии, при необходимости можно использовать парацетамол, НПВП и противомалярийные препараты. Миозит, хотя и менее вероятно, может потребовать стероидов или иммунодепрессантов (метотрексат или азатиоприн). Миозит потребует подтверждения биопсией мышц и, вероятно, приведет к изменению диагноза с НДСТ на поли или дерматомиозит.Для пациентов с незначительными жалобами и пограничным повышением КК может быть достаточно наблюдения.
Болезнь Рейно – многих пациентов с легкой формой болезни Рейно можно лечить, используя защиту рук и ног, а также быстрое согревание в случае развития приступа. Пациенты с более выраженными синдромами Рейно, то есть с болезненными приступами, трещинами на пульпе пальцев или явными изъязвлениями, нуждаются в лечении. Эта группа обычно получает низкие дозы АСК (81 мг OD) вместе с блокатором кальция (например, нифедипин x1 30-90 мг в день) или альфа-блокатором (например.грамм. празоцин 2-10 мг в сутки).
Интерстициальное заболевание легких – как отмечалось выше, пациенты могут иметь NSIP с благоприятным исходом. Заболевание легкой степени может наблюдаться без лечения, или пациенты могут получать кортикостероиды. Лечение этого состояния обычно согласовывается с лечащими врачами.
Синдром Сикки – заболевание глаз можно лечить с помощью лубрикантов, глазных капель циклоспорина (Рестасис) и закупорки слезных точек. Заболевания полости рта можно улучшить с помощью искусственной слюны, пилокарпина (салаген) и цевимелина (эвоксак).Рекомендуется гигиена полости рта 3–4 раза в год.
Усталость и конституциональные симптомы – могут реагировать на противомалярийные препараты, которые обычно назначают, а также на стероиды или иммунодепрессанты, которых в основном избегают из-за токсичности.
Что происходит с пациентами с недифференцированным заболеванием соединительной ткани?
Один из способов взглянуть на эту проблему – представить себе вселенную людей, демонстрирующих некоторую степень аутоиммунитета.На простейшем уровне у человека может быть аутоантитело без каких-либо других проявлений болезни. Другой пациент может иметь аутоантитела и единственную жалобу без объективного воспаления в конечном органе. Наконец, аутоантитела и жалобы в сочетании с незаметным воспалением конечного органа могут позволить диагностировать конкретное заболевание соединительной ткани. В этом контексте НДСТ представляет большую популяцию пациентов с аутоантителами и мало жалоб или результатов. Иммуногенетика в сочетании с воздействием окружающей среды будет учитывать проявление и прогрессирование.Есть надежда, что коррекция гиповитаминоза D или других, еще не распознанных состояний может быть решена и предотвращена прогрессированием до более серьезного заболевания.
Как отмечалось ранее, у 70% пациентов с НДСТ будут сохраняться проявления и не прогрессировать до определенного ревматического заболевания. В начале курса беспокойство является обычным результатом для пациентов и их семьи, но время и опыт уменьшают беспокойство. Для небольшой группы пациентов, у которых наблюдается прогрессирование, дополнительные проявления заболевания или возрастающая тяжесть первоначальных жалоб будут рассматриваться, как указано выше, или в соответствии с конкретным заболеванием (т.е. развитие нефрита СКВ требует особого протокола). Пациента будут наблюдать на предмет эрозивного артрита, мышечной слабости и легочной дисфункции, но, как правило, они очевидны по жалобе пациента. Один вопрос, который остается спорным, заключается в том, следует ли назначать противомалярийные препараты для предотвращения прогрессирования заболевания. Есть данные, свидетельствующие о том, что, как и при СКВ, у пациентов с НДСТ меньше шансов на прогресс после лечения. Риск пигментации кожи и токсичности для сетчатки следует сопоставить с неопределенной пользой.
Как использовать коллективную заботу?
Пациента, находящегося под наблюдением терапевта, направление к ревматологу поможет обеспечить адекватность обследования и интерпретацию аномальных результатов. Некоторые результаты физикального обследования, например, микроскопия капилляров ногтевого валика, потребуют определенного опыта для правильного выявления аномальных петель. Это, в свою очередь, может указывать на склеродермию или дерматомиозит. Консультации других специалистов будут зависеть от наблюдения за нефритом, интерстициальным заболеванием легких или неврологическим заболеванием.
Особое место в управлении – уход за молодой беременной женщиной. Две группы недавно проанализировали свой опыт и выявили увеличение умеренной степени осложнений, связанных с беременностью, а также повышенный риск развития определенного заболевания соединительной ткани. Поскольку в этой популяции часто обнаруживаются антитела к SSa, понимание возможности развития неонатальной блокады сердца имеет важное значение и требует привлечения опытного неонатального кардиолога.
Какие доказательства?
Моска, М., Тани, С., Бомбардиери, С. «Недифференцированные заболевания соединительной ткани (НДСТ): упрощенные системные аутоиммунные заболевания». Autoimmun Rev. vol. 10. 2011. С. 256-8.
Vaz, C.C, Couto, M, Medeiros, D. «Недифференцированное заболевание соединительной ткани: поперечное исследование с семью центрами 184 пациентов». Clin Rheumatol. т. 28. 2009. С. 915-921.
Conti, V, Esposito, A, Кальюзо, M.«Недифференцированное заболевание соединительной ткани – нерешенная проблема: пересмотр литературы и тематических исследований». Int J Immunopathol Pharmacol. т. 23. 2010. С. 271–278.
Киндер, Б.В., Коллард, Х.Р., Кот, Л. «Идиопатическая неспецифическая интерстициальная пневмония – легочное проявление недифференцированного заболевания соединительной ткани». Am J Respir Care Med. т. 176. 2007. С. 691-697.
Трэвис, WD, Ханнингейк, G, Кинг, TE. «Идиопатическая неспецифическая интерстициальная пневмония – Отчет и проект Американского торакального общества». Am J Respir Care Med. т. 177. 2008. pp. 1338-1347.
Рагху, Дж., Коллард, Х.Р., Иган, Дж. Дж. «Официальное заявление ATS / ERS / JRS / ALAT: Идиопатический фиброз легких: научно обоснованные рекомендации по диагностике и лечению». Am J Respir Care Med. т. 183. 2011. С. 788-824.
Кутоло, М. «Дефицит витамина D или гормона D при аутоиммунных ревматических заболеваниях, включая недифференцированное заболевание соединительной ткани». Исследования и терапия артрита. т.10. 2008. pp. 123
Золд, Е., Содорай, П., Каппельмайер, Дж. «Нарушение гомеостаза регуляторных Т-клеток из-за дефицита витамина D при недифференцированном заболевании соединительной ткани». Scand J Rheumatolo. т. 39. 2010. С. 490-497.
Моска, М., Вирдис, А., Тани, К. «Сосудистая реактивность у пациентов с недифференцированными заболеваниями соединительной ткани». Атеросклероз. т. 203. 2009. С. 185–191.
Кортес, С., Кутолол, М. «Капилляроскопические модели при ревматических заболеваниях». Портвейн Acta Rheum Port. т. 32. 2007. С. 29–36.
Павлов-Долиянович, С., Дамьянов, Н.С., Стоянович, Р.М. «Склеродермия капиллярных изменений ногтевого ложа как прогностическая ценность для развития заболевания соединительной ткани: последующее исследование 3029 пациентов с первичным феноменом Рейно». Rheumatol Int. т. 32. 2012. С. 3039-45.
Spinillo, A, Beneventi, F, Epis, OM. «Влияние недавно диагностированного недифференцированного заболевания соединительной ткани на исход беременности». Am J Obstet Gynecol. т. 199. 2008. pp. 632.e1-6.
Кастеллино, Г., Капуччи, Р., Бернарди, С. «Беременность у пациенток с недифференцированным заболеванием соединительной ткани: проспективное исследование« случай-контроль »». Волчанка. т. 20. 2011. С. 1305-1311.
Авторские права © 2017, 2013 ООО «Поддержка принятия решений в медицине». Все права защищены.
Ни один спонсор или рекламодатель не участвовал, не одобрял и не платил за контент, предоставляемый Decision Support in Medicine LLC.Лицензионный контент является собственностью DSM и защищен авторским правом.
Недифференцированное заболевание соединительной ткани: история вопроса, патофизиология, эпидемиология
Arnett FC, Edworthy SM, Bloch DA, McShane DJ, Fries JF, Cooper NS. Американская ассоциация ревматизма 1987 г. пересмотрела критерии классификации ревматоидного артрита. Революционный артрит . 1988 31 марта (3): 315-24. [Медлайн].
Tan EM, Cohen AS, Fries JF, et al.В 1982 г. были пересмотрены критерии классификации системной красной волчанки. Революционный артрит . 1982 25 ноября (11): 1271-7. [Медлайн].
Hochberg MC. Обновление Американского колледжа ревматологии пересмотрело критерии классификации системной красной волчанки. Революционный артрит . 1997 Сентябрь 40 (9): 1725. [Медлайн].
Американская ассоциация ревматизма. Предварительные критерии классификации системного склероза (склеродермии).Подкомитет по критериям склеродермии Комитета по диагностическим и терапевтическим критериям Американской ассоциации ревматизма. Революционный артрит . 1980 Май. 23 (5): 581-90. [Медлайн].
Бохан А., Питер Дж. Б. Полимиозит и дерматомиозит (первая из двух частей). N Engl J Med . 1975 13 февраля. 292 (7): 344-7. [Медлайн].
Alarcón-Segovia D, Cardiel MH. Сравнение трех диагностических критериев смешанного заболевания соединительной ткани.Исследование 593 пациентов. Дж. Ревматол . 1989 16 марта (3): 328-34. [Медлайн].
Витали С., Бомбардиери С., Мутсопулос Х.М., Балестриери Г., Бенчивелли В., Бернштейн Р.М. Предварительные критерии классификации синдрома Шегрена. Результаты предполагаемых согласованных действий при поддержке Европейского сообщества. Революционный артрит . 1993 марта, 36 (3): 340-7. [Медлайн].
Фокс Р.И., Сайто И. Критерии диагностики синдрома Шегрена. Rheum Dis Clin North Am . 1994 Май. 20 (2): 391-407. [Медлайн].
LeRoy EC, Maricq HR, Kahaleh MB. Недифференцированные синдромы соединительной ткани. Революционный артрит . 1980 марта 23 (3): 341-3. [Медлайн].
Моска М., Нери Р., Бомбардиери С. Недифференцированные заболевания соединительной ткани (НДСТ): обзор литературы и предложение по предварительным критериям классификации. Clin Exp Rheumatol . 1999 сентябрь-октябрь.17 (5): 615-20. [Медлайн].
Danieli MG, Fraticelli P, Franceschini F, et al. Пятилетнее наблюдение за 165 итальянскими пациентами с недифференцированными заболеваниями соединительной ткани. Clin Exp Rheumatol . 1999 сентябрь-октябрь. 17 (5): 585-91. [Медлайн].
Грир Дж. М., Пануш Р. С.. Неполная красная волчанка. Arch Intern Med . 1989 ноябрь 149 (11): 2473-6. [Медлайн].
Ganczarczyk L, Urowitz MB, Gladman DD.«Скрытая волчанка». Дж. Ревматол . 1989 г., 16 (4): 475-8. [Медлайн].
Swaak AJ, van de Brink H, Smeenk RJ, Manger K, Kalden JR, Tosi S. Неполная красная волчанка: результаты многоцентрового исследования под наблюдением Постоянного комитета EULAR по международным клиническим исследованиям, включая терапевтические испытания (ESCISIT). Ревматология (Оксфорд) . 2001 г., 40 (1): 89-94. [Медлайн].
Bodolay E, Csiki Z, Szekanecz Z, et al.Пятилетнее наблюдение за 665 венгерскими пациентами с недифференцированным заболеванием соединительной ткани (НДСТ). Clin Exp Rheumatol . 2003 май-июнь. 21 (3): 313-20. [Медлайн].
Cavazzana I, Franceschini F, Belfiore N, et al. Недифференцированное заболевание соединительной ткани с антителами к Ro / SSa: клинические особенности и наблюдение 148 пациентов. Clin Exp Rheumatol . 2001 июль-август. 19 (4): 403-9. [Медлайн].
Vaz CC, Couto M, Medeiros D, Miranda L, Costa J, Nero P.Недифференцированное заболевание соединительной ткани: поперечное исследование с семью центрами 184 пациентов. Clin Rheumatol . 2009 28 августа (8): 915-21. [Медлайн].
Моска М., Тани С., Бомбардиери С. Случай недифференцированного заболевания соединительной ткани: это отдельная клиническая форма ?. Нат Клин Практик Ревматол . 2008 июн. 4 (6): 328-32. [Медлайн].
Дориа А., Моска М., Гамбари П.Ф., Бомбардиери С. Определение неклассифицируемых заболеваний соединительной ткани: неполное, недифференцированное или и то, и другое ?. Дж. Ревматол . 2005 Февраль 32 (2): 213-5. [Медлайн].
Conti V, Esposito A, Cagliuso M, Fantauzzi A, Pastori D, Mezzaroma I. Недифференцированное заболевание соединительной ткани – нерешенная проблема: пересмотр литературы и тематических исследований. Int J Immunopathol Pharmacol . 2010 Янв-март. 23 (1): 271-8. [Медлайн].
Bizzaro N, Tozzoli R, Shoenfeld Y. Находимся ли мы на стадии прогнозирования аутоиммунных ревматических заболеваний ?. Революционный артрит .2007 июн. 56 (6): 1736-44. [Медлайн].
Cappelli S, Bellando Randone S, Martinovic D, Tamas MM, Pasalic K, Allanore Y, et al. «Быть или не быть», десять лет спустя: данные о смешанном заболевании соединительной ткани как отдельном субъекте. Сыворотка семенного артрита . 2011 27 сентября. [Medline].
Хорват Л., Цирджак Л., Фекете Б. и др. Уровни антител к семейству белков теплового шока C1q и 60 кДа в сыворотках крови пациентов с различными аутоиммунными заболеваниями. Иммунол Летт . 2001 г. 1. 75 (2): 103-9. [Медлайн].
Испания TA, Sun R, Gradzka M, et al. Активатор транскрипции Sp1, новый аутоантиген. Революционный артрит . 1997 июн. 40 (6): 1085-95. [Медлайн].
Szodoray P, Nakken B, Barath S, Gaal J, Aleksza M, Zeher M. Прогрессивные дивергентные сдвиги в естественных и индуцированных Т-регуляторных клетках означают переход от недифференцированного к дефинитивному заболеванию соединительной ткани. Инт Иммунол . 2008 20 августа (8): 971-9. [Медлайн].
Zold E, Szodoray P, Nakken B, Barath S, Kappelmayer J, Csathy L. и др. Лечение альфакальцидолом восстанавливает нарушенную иммунную регуляцию у пациентов с недифференцированным заболеванием соединительной ткани. Аутоиммунная Ред. . 2011 10 января (3): 155-62. [Медлайн].
Guerrero LF, Rueda JC, Arciniegas R, Rueda JM. Недифференцированное заболевание соединительной ткани в ревматологическом центре в Кали, Колумбия: клинические особенности 94 пациентов, наблюдаемых в течение года. Ревматол Инт . 2011 25 ноября. [Medline].
Моска М., Тани С., Бомбардиери С. Определение недифференцированных заболеваний соединительной ткани: проблема для ревматологов. Волчанка . 2008. 17 (4): 278-80. [Медлайн].
Моска М., Нери Р., Бенцивелли В., Тавони А., Бомбардиери С. Недифференцированное заболевание соединительной ткани: анализ 83 пациентов с минимальным периодом наблюдения 5 лет. Дж. Ревматол . 2002 29 ноября (11): 2345-9.[Медлайн].
Гупта Д., Роппельт Х., Бауэрс Б., Кунц Д., Натараджан М., Грубер Б. Успешная ремиссия тромботической тромбоцитопенической пурпуры с помощью ритуксимаба у пациента с недифференцированным заболеванием соединительной ткани. Дж. Клин Ревматол . 2008 г., 14 (2): 94-6. [Медлайн].
Martorell EA, Hong C, Rust DW, Salomon RN, Krishnamani R, Patel AR. Женщина 32 лет с артралгиями и тяжелой гипотонией. Революционный артрит .2008 15 ноября. 59 (11): 1670-5. [Медлайн].
Келли Б.Т., Муа Т. Наложение интерстициальной пневмонии с аутоиммунными признаками с недифференцированным заболеванием соединительной ткани и вклад НВП в смертность. Респирология . 2018 10 января. 176 (7): 691-7. [Медлайн].
Дэн XL, Лю XY. Сравнительное исследование 181 случая диффузного заболевания соединительной ткани, осложненного сердечно-сосудистым заболеванием. Международный журнал ревматических болезней .Ноя 2008. 11 (Приложение 1): A462.
Oh CW, Lee SH, Heo EP. Случай, предполагающий лимфоцитарный васкулит как признак раннего недифференцированного заболевания соединительной ткани. Ам Дж. Дерматопатол . 2003 25 октября (5): 423-7. [Медлайн].
Оиси Ю., Араи М., Кираку Дж., Дои Х., Учияма Т., Хасегава А. Неклассифицированное заболевание соединительной ткани, проявляющееся тампонадой сердца: отчет о клиническом случае. Jpn Circ J . 2000 августа 64 (8): 619-22.[Медлайн].
Zhang Y, Zhang FK, Wu XN, Wang TL, Jia JD, Wang BE. Недифференцированное повреждение печени, связанное с заболеваниями соединительной ткани. Мир Дж. Гастроэнтерол . 2008 7 мая. 14 (17): 2780-2. [Медлайн].
Williams HJ, Alarcon GS, Joks R и др. Раннее недифференцированное заболевание соединительной ткани (ДЗТ). VI. Начальная когорта через 10 лет: ремиссии болезни и изменения диагнозов при четко установленных и недифференцированных CTD. Дж. Ревматол . 1999 26 апреля (4): 816-25. [Медлайн].
Аларкон Г.С., Уильямс Г.В., Зингер Дж.З., Стин В.Д., Клегг Д.О., Паулюс Х. Раннее недифференцированное заболевание соединительной ткани. I. Ранние клинические проявления у большой группы пациентов с недифференцированными заболеваниями соединительной ткани по сравнению с когортами пациентов с хорошо установленным заболеванием соединительной ткани. Дж. Ревматол . 1991 Сентябрь 18 (9): 1332-9. [Медлайн].
Danieli MG, Fraticelli P, Salvi A, Gabrielli A, Danieli G.Недифференцированное заболевание соединительной ткани: естественное течение и эволюция в определенный CTD, оцененные у 84 пациентов, у которых изначально был диагностирован UCTD. Clin Rheumatol . 1998. 17 (3): 195-201. [Медлайн].
Кальво-Ален Дж., Аларкон Г.С., Бургард С.Л. и др. Системная красная волчанка: предикторы ее возникновения среди когорты пациентов с недифференцированным ранним заболеванием соединительной ткани: многомерный анализ и идентификация факторов риска. Дж. Ревматол .1996 г., 23 (3): 469-75. [Медлайн].
Heinlen LD, McClain MT, Merrill J, Akbarali YW, Edgerton CC, Harley JB. Клинические критерии системной красной волчанки предшествуют диагностике, а ассоциированные аутоантитела присутствуют до появления клинических симптомов. Революционный артрит . 2007 июль 56 (7): 2344-51. [Медлайн].
Моска М., Бальдини С., Бомбардиери С. Недифференцированные заболевания соединительной ткани в 2004 г. Clin Exp Rheumatol .2004 янв-фев. 17 (5): 22 (3 Дополнение 33). [Медлайн].
Meroni PL, Schur PH. Скрининг ANA: старый тест с новыми рекомендациями. Энн Рум Дис . 2010 августа 69 (8): 1420-2. [Медлайн].
Tozzoli R, Bizzaro N, Tonutti E, Villalta D, Bassetti D, Manoni F и др. Руководство по лабораторному использованию тестов на аутоантитела в диагностике и мониторинге аутоиммунных ревматических заболеваний. Ам Дж. Клин Патол . 2002 Февраль 117 (2): 316-24.[Медлайн].
Ceribelli A, Cavazzana I, Franceschini F, Quinzanini M, Rizzini FL, Cattaneo R. Переключение изотипа и изменение титра антител против Ro / SSA с течением времени у 100 пациентов с недифференцированным заболеванием соединительной ткани (НДСТ). Clin Exp Rheumatol . 2008 янв-фев. 26 (1): 117-20. [Медлайн].
Зольд Э, Содорай П., Гаал Дж., Каппельмайер Дж., Чати Л., Дьимеси Э. Дефицит витамина D при недифференцированном заболевании соединительной ткани. Лечение артрита . 2008. 10 (5): R123. [Медлайн].
Cortes S, Clemente-Coelho P. [Капилляроскопия ногтевых складок в оценке феномена Рейно и недифференцированного заболевания соединительной ткани]. Порт Acta Reumatol . 2008 апр-июн. 33 (2): 203-9. [Медлайн].
Spinillo A, Beneventi F, Epis OM, Montanari L, Mammoliti D, Ramoni V. Влияние недавно диагностированного недифференцированного заболевания соединительной ткани на исход беременности. Am J Obstet Gynecol . 2008 декабрь 199 (6): 632.e1-6. [Медлайн].
Cordiali-Fei P, Mussi A, D’Agosto G, Trento E, Bordignon V, Trincone S и др. Оценка регуляторных Т-клеток и расширенное профилирование аутоантител могут предложить новые биомаркеры для клинического лечения системного склероза и недифференцированного заболевания соединительной ткани. Клин Дев Иммунол . 2013. 2013: 3. [Медлайн]. [Полный текст].
van den Hoogen F, Khanna D, Fransen J, Johnson SR, Baron M, Tyndall A и др.Критерии классификации системного склероза 2013 года: совместная инициатива Американского колледжа ревматологии / Европейской лиги против ревматизма. Революционный артрит . 2013 ноябрь 65 (11): 2737-47. [Медлайн].
Shiboski SC, Shiboski CH, Criswell L, Baer A, Challacombe S, Lanfranchi H, et al. Критерии классификации синдрома Шегрена в Американском колледже ревматологии: основанный на данных подход консенсуса экспертов в когорте Международного совместного клинического альянса Шегрена. Центр по уходу за артритом (Хобокен) . 2012 Апрель 64 (4): 475-87. [Медлайн]. [Полный текст].
Алетаха Д., Неоги Т., Силман А. Дж., Фуновиц Дж., Фелсон Д. Т., Бингхэм СО 3-й и др. Критерии классификации ревматоидного артрита 2010 года: совместная инициатива Американского колледжа ревматологии / Европейской лиги против ревматизма. Революционный артрит . 2010 сентябрь 62 (9): 2569-81. [Медлайн].
Лучано Н., Бальдини С., Тарантини Дж., Ферро Ф., Серниси Ф., Варанини В. и др.Ультрасонография основных слюнных желез: высокоспецифичный инструмент для дифференциации первичного синдрома Шегрена от недифференцированных заболеваний соединительной ткани. Ревматология (Оксфорд) . 2015 Декабрь 54 (12): 2198-204. [Медлайн].
Гарсиа-Гонсалес М., Родригес-Лосано Б., Бустабад С., Феррас-Амаро И. Недифференцированное заболевание соединительной ткани: предикторы эволюции в определенное заболевание. Clin Exp Rheumatol . 2017 сен-окт. 35 (5): 739-745. [Медлайн].
Что такое недифференцированное заболевание соединительной ткани?
Недифференцированное заболевание соединительной ткани (UCTD) и смешанное заболевание соединительной ткани (MCTD) – это состояния, которые имеют некоторое сходство с другими системными аутоиммунными заболеваниями или заболеваниями соединительной ткани, но есть различия, которые их различают. Когда критерии названных аутоиммунных заболеваний не выполняются, состояние определяется как НДСТ.
Выделяют 5 аутоиммунных заболеваний соединительной ткани.Они классифицируются на основе сочетания симптомов, результатов физикального обследования и тестирования на антитела.
Они есть:
Если вы соответствуете критериям классификации более чем одного аутоиммунного заболевания соединительной ткани, это называется синдромом перекрытия. MCTD – это специфический синдром перекрытия с признаками системной красной волчанки, склеродермии и воспалительной миопатии с антителами к RNP.
BSIP / UIG / Getty ImagesПризнаки недифференцированного заболевания соединительной ткани
Если у вас НДСТ, у вас могут быть такие симптомы, как боль в суставах, результаты лабораторных анализов, такие как положительный результат ANA, или другие признаки системного аутоиммунного заболевания.
Характерные симптомы НДСТ включают артрит, артралгию, феномен Рейно, лейкопению (низкое количество лейкоцитов), сыпь, алопецию, язвы во рту, сухость глаз, сухость во рту, субфебрильную температуру и светочувствительность. Обычно неврологического или почечного поражения нет, печень, легкие и мозг обычно не поражаются. Около 80% людей с этим заболеванием проходят тесты на антитела, которые дают положительный результат на аутоантитела против Ro или RNP. Взаимодействие с другими людьми
Примерно у одной трети тех, кому поставлен диагноз НДСТ, наступает ремиссия, а у около трети сохраняется легкое течение НДСТ.Считается, что 30% тех, кому изначально поставлен диагноз НДСТ, прогрессируют до окончательного диагноза определенного заболевания соединительной ткани.
Диагностика и лечение UCTD
В рамках процесса диагностики НДСТ необходимо собрать полный анамнез, физический осмотр и лабораторные исследования, чтобы исключить возможность других ревматических заболеваний. Лечение обычно направлено на устранение симптомов.
Обычно лечение НДСТ состоит из некоторой комбинации анальгетиков и нестероидных противовоспалительных средств (НПВП) для лечения боли и местных кортикостероидов для управления воздействием на кожу и слизистые ткани.Иногда используют Плаквенил (гидроксихлорохин), модифицирующий заболевание противоревматический препарат (DMARD). Если улучшение недостаточно, можно назначить пероральный преднизон в низких дозах на короткое время.
Метотрексат может быть вариантом лечения тяжелых излечимых случаев НДСТ. Высокие дозы кортикостероидов, цитотоксических препаратов (например, цитотоксана) или других DMARDS (таких как имуран) обычно не используются.
Итог
Прогноз для НДСТ на удивление хороший. Существует низкий риск прогрессирования четко выраженного заболевания соединительной ткани, особенно среди пациентов, у которых не изменилась НДСТ в течение 5 лет и более.Взаимодействие с другими людьми
Большинство случаев остаются легкими, и симптомы обычно лечат без необходимости применения сильнодействующих иммунодепрессантов.
Недифференцированное заболевание соединительной ткани: современное состояние руководств по клинической практике
Ключевые сообщения
Что уже известно об этом предмете?
Недифференцированные заболевания соединительной ткани (НДСТ) – это орфанное ревматологическое заболевание, которое часто наблюдается в клинической практике.
Нет рекомендаций по диагностике и лечению НДСТ, которые широко распространены или используются в повседневной практике.
Что добавляет это исследование?
Как это может повлиять на клиническую практику?
Клиницисты обеспокоены отсутствием надлежащего определения НДСТ, оценки риска, а также мониторинга и терапевтических стратегий для пациентов с НДСТ.
Пациенты с НДСТ могут испытывать неуверенность в отношении диагноза НДСТ, терапевтического подхода и прогноза.
Введение
Термин «недифференцированное заболевание соединительной ткани» (НДСТ) обычно используется для описания клинических состояний, характеризующихся серологическими признаками аутоиммунитета и наличием клинических симптомов, часто наблюдаемых в связи с системными аутоиммунными заболеваниями (SAD), пока что не соответствует критериям для конкретного SAD.По сравнению с другими SAD, классификации которых официально выпускаются ревматологическими обществами и периодически подвергаются обсуждению и пересмотру, общая концепция UCTD может показаться довольно расплывчатой и подверженной (неправильной) интерпретации. Таким образом, у клиницистов может возникнуть соблазн классифицировать ранние фазы других основных САР как НДСТ. Неудивительно, что литературные данные показывают, что до 30% НДСТ может развиться в определенную «серьезную» САД в течение нескольких лет после постановки диагноза (все рассмотрено в 1). Использование термина UCTD для описания ранней фазы серьезного ревматического заболевания и пациента, у которого временно отсутствуют достаточные признаки, чтобы соответствовать другим критериям классификации, было впервые предложено LeRoy et al в 1980 году.2 Чтобы лучше различать НДСТ с риском развития и стабильную НДСТ, в 1999 г. были предложены предварительные, но часто принятые критерии НДСТ. 3 Пациентов можно классифицировать как НДСТ, если они соответствуют следующим критериям: (1) признаки и симптомы, указывающие на заболевание соединительной ткани (CTD), но не отвечающее критериям определенного CTD, (2) положительные антинуклеарные антитела по двум отдельным контрольным измерениям и (3) продолжительность заболевания не менее 3 лет. Эти критерии сильно зависят от отсутствия других SAD, то есть невозможности выполнить другие критерии классификации для основных CTD.В течение последнего десятилетия критерии классификации для других основных SAD подвергались тщательному анализу в попытке сделать их более чувствительными и способными улавливать ранние фазы CTD4–8. Этот процесс активно продолжается и, вероятно, приведет к появлению новых наборов критериев. в ближайшем будущем.9 Очевидно, что любые новые или пересмотренные критерии для SAD могут повлиять на наше представление о UCTD и изменить метку, которую врачи ставят на пациентов с ранними аутоиммунными заболеваниями. Тем не менее, неясно, в какой степени это улучшенное знание в конечном итоге повлияет на клиническую практику и отношение врачей к постели больного.Также могут быть затронуты текущие знания о развитии болезни у пациентов с НДСТ и факторах, которые могут повлиять на прогрессирование в направлении определенного САР.10 Эти проблемы преувеличены, учитывая ограниченные критерии классификации эффективности, которые могут иметь место при использовании в качестве диагностических инструментов при отсутствии надлежащих методов диагностики. диагностические критерии.11 С другой стороны, диагностические критерии для НДСТ может быть трудно разработать в отсутствие четких определений, а если они будут слишком строгими, они могут ограничить возможность постановки клинического диагноза и помешать пациентам надлежащее лечение и последующее наблюдение. .
В настоящей работе делается попытка идентифицировать текущие клинические практические рекомендации (CPG) в UCTD и неудовлетворенные потребности клиницистов и пациентов, которые возникают вместе с диагнозом и изменением определения UCTD.
Методы
Поиск существующих руководств
Мы провели систематический поиск в PUBMED и EMBASE на основе контролируемых терминов (MeSH и Emtree, см. Ниже) и ключевых слов болезни и типа публикации (CPG). Два независимых рецензента (RT, CAS) проверили все отобранные статьи, используя следующие критерии включения: UCTD (популяция) и CPG в области диагностики, мониторинга и лечения (дизайн исследования).CPG были определены в соответствии с определением Института медицины 2011 года ( Руководства по клинической практике – это утверждения, которые включают рекомендации, предназначенные для оптимизации ухода за пациентами, которые основаны на систематическом обзоре доказательств и оценке преимуществ и вреда альтернативных вариантов ухода ). Ограничения по языку или году публикации не применялись.
Координаторы по заболеваниям (DC) ERN-ReCONNET для UCTD (LB, MA) сначала выполнили скрининг среди статей, включенных в окончательный список (систематический) на основе названия и аннотации выбранных руководств по доказательной медицине; во-вторых, они выполнили ручной поиск существующих руководств на выбранных сайтах национальных клинических обществ и через несколько поисковых систем (Google и Bing).Предварительно определенные данные включают автора, год, область, охват клинических вопросов и области AGREE II (объем и цель; участие заинтересованных сторон; строгость разработки; ясность представления; применимость; редакционная независимость. Данные планировалось сообщать описательно по областям (диагноз, мониторинг и управление), чтобы описать охват и сообщить о неудовлетворенных потребностях.
Термины Medline (Pubmed)
(недифференцированные (все поля) И («заболевания соединительной ткани» (термины MeSH) ИЛИ («соединительные» (все поля) ) И «ткань» (все поля) И «болезни» (все поля)) ИЛИ «заболевания соединительной ткани» (все поля) ИЛИ («соединительная ткань» (все поля) И «ткань» (все поля) И «болезнь» ( Все поля)) ИЛИ «заболевание соединительной ткани» (Все поля))) И («Практическое руководство» (Тип публикации) ИЛИ «Практическое руководство как тема» (термины MeSH) ИЛИ Практическое руководство (Тип публикации) ИЛИ «Практическое руководство» ( Текстовое слово) ИЛИ «Практические рекомендации» (текстовое слово) ИЛИ «Рекомендации» (тип публикации) ИЛИ «Рекомендации в качестве темы» (термины MeSH) ИЛИ Руководство (Тип публикации) ИЛИ «Рекомендации» (текстовое слово) ИЛИ «Рекомендации» (текстовое слово) ИЛИ «Конференция по развитию консенсуса» (тип публикации) ИЛИ «Конференции по развитию консенсуса в качестве темы» (Термины MeSH) ИЛИ «Консенсус» (Термины MeSH) ИЛИ «Консенсус» (текстовое слово) ИЛИ «Рекомендация» (текстовое слово) ИЛИ «Рекомендации» (текстовое слово) ИЛИ «Лучшая практика» (текстовое слово) ИЛИ «Лучшие практики» (Текстовое слово)).
Embase
(«недифференцированное заболевание соединительной ткани» / exp ИЛИ («заболевание соединительной ткани» / exp ИЛИ «заболевание соединительной ткани» ИЛИ «заболевания соединительной ткани» ИЛИ «заболевание соединительной ткани» И недифференцированное)) И («практическое руководство ‘/ exp OR’ практическое руководство ‘OR’ практическое руководство ‘/ exp OR’ практическое руководство ‘OR’ руководство по клинической практике ‘/ exp OR’ руководство по клинической практике ‘OR’ руководство по клинической практике ‘/ exp OR’ руководство по клинической практике ‘OR’ руководящие принципы клинической практики как тема ‘/ exp ИЛИ’ руководящие принципы клинической практики как тема ‘ИЛИ’ руководство ‘/ exp ИЛИ’ руководство ‘ИЛИ’ руководящие принципы ‘/ exp ИЛИ’ руководящие принципы ‘ИЛИ’ руководящие принципы как тема ‘/ exp ИЛИ’ руководящие принципы как тема ‘ ИЛИ ‘развитие консенсуса’ / exp OR ‘развитие консенсуса’ OR ‘конференция по развитию консенсуса’ / exp OR ‘конференция по развитию консенсуса’ OR ‘конференции по развитию консенсуса’ / exp OR ‘конференции по развитию консенсуса’ OR ‘конференции по развитию консенсуса как тема’ / exp ИЛИ ‘достижение консенсуса c как тема ‘ИЛИ’ консенсус ‘/ exp ИЛИ’ консенсус ‘ИЛИ’ рекомендация ‘ИЛИ’ рекомендации ‘) И (embase) / lim NOT (medline) / lim
Идентификация неудовлетворенных потребностей пациента
Пациенты и семьи, обращающиеся к ERN ReCONNET Европейская группа по защите интересов пациентов (ePAG), а также лица, обеспечивающие уход, были глубоко вовлечены в деятельность ERN, и их личное мнение о неудовлетворенных потребностях UCTD было выражено во время веб-конференций и встреч.Собранные потребности были рассмотрены и перефразированы представителем пациентов и представлены здесь в упрощенной и описательной форме.
Результаты
Идентификация существующих CPG
Всего 108 статей были признаны подходящими для просмотра после поиска в PUBMED и EMBASE. Все они были независимо рассмотрены LB и MA; оба рецензента согласились, что ни одна из выбранных статей не содержит подходящих CPG для дальнейшей оценки. Точно так же ручной поиск через поисковые системы и на выбранных веб-сайтах не дал никаких публикаций, соответствующих критериям включения. Общий результат состоит в том, что в настоящее время нет общедоступных рекомендаций CPG по UCTD.
Неудовлетворенные потребности клиницистов
Из литературы и ручного поиска становится ясно, что некоторые аспекты НДСТ все еще неясны, и поэтому мы можем определить несколько потенциальных областей вмешательства или интереса для практикующих клинических врачей.
Отсутствие CPG на UCTD может отражать отсутствие согласованного определения UCTD. На сегодняшний день критерии классификации UCTD являются лишь предварительными и могут считаться устаревшими в свете новых критериев SAD, которые с повышенной чувствительностью охватывают ранние или даже доклинические CTD у пациентов.Таким образом, мы можем определить необходимость разработки, уточнения и подтверждения определения UCTD как острой потребности.
Из-за отсутствия надлежащих руководств неясно, должны ли пациенты с НДСТ с характеристиками, напоминающими основные САР, следовать существующим протоколам и руководствам (т. ) или если необходимо разработать конкретные руководящие принципы.
Было бы интересно провести надлежащую стратификацию пациентов с НДСТ в отношении риска развития специфических САР.Эти пациенты обычно могут быть помечены как «НДСТ с риском […]» в соответствии с клиническими, серологическими или другими доступными данными. Подобно тому, что обсуждалось ранее (см. Пункт 2), для таких пациентов можно разработать специальные руководства или, в качестве альтернативы, следует адаптировать и применять к ним существующие.
В связи с отсутствием точных проспективных эпидемиологических данных неясно, в какой степени раннее введение или использование лекарств, разработанных для других показаний или обычно прописываемых в клинической практике ревматологии, может быть полезным для пациентов с НДСТ.Влияние такого терапевтического подхода на естественное течение НДСТ неясно. Специальные (международные) национальные реестры для UCTD могут облегчить сбор этих данных12.
Неудовлетворенные потребности пациентов
Этот параграф призван подчеркнуть неудовлетворенные потребности европейского сообщества по недифференцированным заболеваниям соединительной ткани. Содержание этого параграфа было реализовано ERN ReCONNET ePAG, которая тщательно, но неуклонно собирала голоса и точки зрения всего европейского сообщества на болезнь, которую они представляют.Редкость заболевания и нехватка организаций пациентов сделали эту работу тяжелее, чем ожидалось.
Пациенты неуверенно относятся к названию болезни; слово «недифференцированный» заставляет их чувствовать, что у них нет настоящего заболевания, а скорее болезнь, которая только в будущем станет признанной болезнью. Это чувство сильно влияет на качество жизни, связанное со здоровьем. Пациенты могут чувствовать, что ими пренебрегают, поскольку простое присутствие титров антинуклеарных антител не оправдывает необходимость последовательной диагностики и последующего наблюдения, которые следует лучше объяснить.Следует лучше описать (низкий) процент риска развития другого САР и его последствия, равно как и больший шанс не разовьется еще один САР. Пациенты также ссылаются на отсутствие информации о заболевании и сообщают о недостаточном участии медицинских работников в подготовке существующих документов, возможно, из-за нехватки групп пациентов. Отсутствие CPG для UCTD, кажется, подтверждает эту жалобу.
Заключение
Текущее отсутствие доступных CPG ясно показывает, что UCTD каким-то образом игнорируется по сравнению с другими основными SAD.Несмотря на возможность того, что некоторые пациенты с НДСТ действительно могут иметь возможность прогрессировать к ранним и определенным формам других ДСТ, нет единого мнения об оптимальном ведении этих пациентов. В отсутствие четких эпидемиологических исследований и тщательной оценки риска выбор клинициста по-прежнему определяется индивидуальным опытом. Таким образом, пациенты с НДСТ остаются в зоне неопределенности, несмотря на общие заверения в том, что их заболевание как-то «мягче» по сравнению с определенными САР.Такое отношение явно является источником дискомфорта, поскольку пациенты и родственники чувствуют тревогу из-за неопределенной ситуации, которая может оставить больше вопросов, чем ответов (что именно у меня есть? Что со мной будет? Как будет развиваться моя болезнь?) Неопределенность в отношении диагноза НДСТ, терапевтического подхода и прогноза может влиять на стратегии выживания пациентов, препятствовать тщательному и систематическому наблюдению и оценке, что может иметь потенциальные недостатки при раннем выявлении случаев, прогрессирующих в сторону определенных САР или серьезных осложнений.Пациенты могут чувствовать снижение доверия к поставщикам медицинских услуг, что напрямую влияет на результаты лечения.13 Следовательно, явно необходимы целенаправленные усилия, чтобы интегрировать опыт специалиста с потребностями и ожиданиями пациентов, чтобы способствовать разработке официальных CPG UCTD.
Благодарности
Спасибо всем членам Руководящего комитета ERN ReCONNET за огромную приверженность этой работе. Особая благодарность всем членам команды ERN ReCONNET за поддержку на всех этапах рабочего пакета 3.
Заболевание соединительной ткани – обзор
Недифференцированное заболевание соединительной ткани и неполные синдромы волчанки
НДСТ – более широкая категория, чем ВЗВ или латентная волчанка, которые являются более конкретными терминами, применяемыми к пациентам с некоторыми признаками СКВ, но у которых четыре из них. критериев классификации нет 2,3 (рис. 48.1). Повреждения других органов, кроме кожи, обычно отсутствуют при ИВС, и общие баллы повреждений низкие. 4 Однако пациенты с НДСТ или ИВС сообщают о снижении качества жизни, что может быть связано с тревогой, связанной с диагностической неопределенностью. 5-7
Рабочий набор критериев для классификации НДСТ был описан в главе 2. Распространенность НДСТ трудно определить, но, вероятно, это одно из наиболее распространенных состояний, наблюдаемых в ревматологической практике, и 10% до 20% обращений в клиники высокоспециализированной медицинской помощи могут быть связаны с этим диагнозом. 8
Обозначения UCTD и ILE включают два основных подмножества с различными клиническими значениями (рис. 48.2). Первая подгруппа состоит из пациентов со стабильным течением, относительно легкими проявлениями и хорошим прогнозом.Пациенты этой категории могут иметь различные формы, такие как синдромы сухости, не удовлетворяющие критериям Шегрена, 9 феномен Рейно или артралгии. Некоторых осматривают врачи других специальностей, например, с кожными проявлениями, за которыми следуют дерматологи. 10,11 Аутоиммунные заболевания щитовидной железы наблюдаются поставщиками эндокринной системы, 12 и пациенты с цитопенией наблюдаются гематологами. 13 Другие распространенные сценарии требуют оценки неврологами. 14,15
Вторая подгруппа состоит из лиц, находящихся на развивающейся стадии аутоиммунного заболевания. Термин доклиническая волчанка также применяется к этой группе пациентов. 16,17 Однако доклиническое определение может быть сделано только задним числом, что является перспективой, недоступной в клинической практике. Кроме того, как уже отмечалось, заболевания, которые могут развиваться, не обязательно ограничиваются теми, которые обычно наблюдаются специалистами по СКВ, но могут, например, включать неврологические состояния.Даже в категории ILE может произойти переход в другое ревматологическое состояние, кроме СКВ. Скелетно-мышечные проявления, включая артралгии, могут указывать на раннюю стадию ревматоидного артрита (РА). 18 Оценки того, сколько пациентов с ИВС находятся в состоянии перехода к СКВ, сильно различаются: от 10% до 38%. 19-21 Точная идентификация пациентов с вероятным прогрессом пока невозможна, хотя такие факторы риска, как молодой возраст и женский пол, можно легко определить. 8,22 Накопление аутоантител предшествует СКВ, а за несколько лет до постановки диагноза СКВ. 23 Другие прогностические особенности, наблюдаемые в продольных исследованиях, включают стойкую протеинурию и язвы в полости рта 24 и, возможно, низкий уровень витамина D. Был предложен диагностический алгоритм для пациентов с подозрением на СКВ. 8 Первый ключевой шаг – «подозрение на СКВ». Три возможных исхода – это СКВ, возможная СКВ и НДСТ. Учитывая высокий риск нелеченой СКВ, пациентов из категории «возможная СКВ» рассматривают так, как если бы они страдали СКВ.
Как подать заявление на получение пособия по инвалидности при заболевании соединительной ткани
Что такое недифференцированное и смешанное заболевание соединительной ткани?
Заболевание соединительной ткани – это заболевание, поражающее соединительные ткани тела, вещества, которые соединяют и удерживают вместе клетки тела. Примеры соединительной ткани – жир и хрящ. Эти соединительные ткани находятся по всему телу и имеют жизненно важное значение для формы и функции многих его частей.
Существует много различных видов заболеваний соединительной ткани, но они обычно подразделяются на два разных типа в зависимости от того, что их вызывает.
Некоторые заболевания соединительной ткани вызываются определенными генетическими мутациями, унаследованными при рождении, и влияют на определенные системы организма. Двумя примерами из них являются синдром Марфана, который может вызывать дефекты сердца, легких, глаз и костей, и синдром Элерса-Данлоса, который характеризуется дряблостью кожи и суставов.
Другая, гораздо большая группа заболеваний соединительной ткани не имеет известной причины, но связана с генетическими недостатками, которые заставляют иммунную систему организма атаковать собственные ткани, вызывая воспаление и другие осложнения.По этой причине многие соединительные ткани классифицируются как аутоиммунные заболевания. Примерами являются системная волчанка, ревматоидный артрит, склеродермия, полимиозит и дерматомиозит. Симптомы каждого из них следующие:
- Системная волчанка характеризуется сыпью на лице, язвами во рту, лихорадкой, припухлостью слизистой оболочки сердца и легких, плохим кровообращением и другими осложнениями.
- Ревматоидный артрит характеризуется лихорадкой, болями и болями, воспалением, покраснением и болью в суставах во время обострений артрита.
- Склеродермия характеризуется толстыми, твердыми участками кожи, которые могут вызывать боль или ограничивать движения.
- Полимиозит характеризуется мышечной слабостью и атрофией.
- Дерматомиозит характеризуется выступающей кожной сыпью на лице, туловище и суставах пальцев, а также мышечной слабостью.
Все эти аутоиммунные типы заболеваний соединительной ткани имеют характерные симптомы, которые легко идентифицировать по их симптомам, а также по анализам крови, которые показывают наличие определенных антител и аномалий.Однако для их полного развития могут потребоваться годы, если они вообще когда-нибудь это сделают. Поэтому начальные и более легкие случаи этих заболеваний не так легко диагностировать, пока они не прогрессируют.
Если врач не уверен, какое заболевание соединительной ткани присутствует, поскольку симптомы еще недостаточно серьезны или ясны, он часто называет это недифференцированным заболеванием соединительной ткани. Позже болезнь может проявить более четкие симптомы и результаты анализа крови, чтобы поставить точный диагноз. Иногда более легкие недифференцированные случаи проясняются и никогда не достигают точки диагностики.С другой стороны, если симптомы и результаты анализа крови присутствуют для более чем одного заболевания соединительной ткани, это классифицируется как случай смешанного заболевания соединительной ткани.
Могу ли я подать заявку на пособие при диагнозе смешанного заболевания соединительной ткани?
Если вы подаете заявление на получение пособия по социальному страхованию по инвалидности из-за недифференцированного или смешанного заболевания соединительной ткани, необходимо соблюдать важные правила. Состояние и симптомы вашего заболевания должны соответствовать требованиям Синей книги SSA.
Недифференцированные и смешанные заболевания соединительной ткани перечислены SSA как квалифицируемые нарушения в категории «Иммунные заболевания» в разделе 14 Синей книги.
Чтобы иметь право на инвалидность в связи с этим заболеванием, у вас должно быть медицинское доказательство того, что ваши симптомы указывают на:
- Недифференцированное заболевание соединительной ткани – симптомы, связанные с заболеванием соединительной ткани, но не соответствующие критериям и, следовательно, не могут быть ограничены одним конкретным заболеванием
- Смешанное заболевание соединительной ткани – симптомы и анализы крови, которые однозначно указывают на более чем один тип заболевания соединительной ткани.
В дополнение к этому SSA требует одного из следующих сочетаний симптомов и сценариев:
- Болезнь должна быть затронута двумя или более частями вашего тела. По крайней мере, в одной из этих областей должны проявляться серьезные симптомы; Кроме того, вы должны показать как минимум два симптома тяжелого заболевания (лихорадка, потеря веса, сильная слабость и т. д.).
- У вас должны быть частые симптомы болезни, по крайней мере, два признака тяжелой болезни, и вы должны доказать, что ваше состояние не позволяет вам выполнять повседневные задачи и взаимодействовать с другими людьми, одновременно работая умственно и физически для выполнения рабочих задач.
Пациент с инвалидностью по поводу недифференцированного и смешанного заболевания соединительной ткани
Если вы страдаете заболеванием соединительной ткани, которое еще не может быть диагностировано или которое осложняется симптомами и признаками многих конкретных заболеваний, вы все равно можете иметь право на получение социального страхования по инвалидности или дополнительного социального дохода. Эти заболевания реагируют таким образом достаточно часто, чтобы медицинские работники, а также SSA признали их состояниями. То, что они смешанные или недифференцированные, не означает, что ваши заболевания соединительной ткани недостаточно серьезны, чтобы вывести их из строя и иметь право на получение льгот.
Получение помощи по вашему приложению
Подача документов на пособие по инвалидности часто является чрезмерной и сложной, поэтому вам следует подумать о том, чтобы воспользоваться услугами опытного адвоката по вопросам социального обеспечения по инвалидности или адвоката, который поможет вам в вашем деле. Просто заполните форму для бесплатной оценки дела, чтобы обсудить вашу претензию с одним из этих специалистов.
Полезные ресурсы
Заболевания иммунной системы и инвалидность по социальному обеспечениюСмешанное заболевание соединительной ткани (MCTD)
УЧЕБНИКИ
Greidinger EL.Синдромы перекрытия, В: Системная красная волчанка: основные, прикладные и клинические аспекты, Tsokos G Ed., New York: Elsevier, 2016.
Zang Y, Martinez L, Fernandez I, Pignac-Kobinger J, Greidinger EL. Сохранение патогенной гомологии TCR через ограничения класса II в анти-рибонуклеопротеидном аутоиммунитете: повышенная эффективность терапии Т-клеточной вакциной. J Immunol. 2014; 192 (9): 4093-102.
Greidinger EL, Смешанное заболевание соединительной ткани, В: Энциклопедия медицинской иммунологии: аутоиммунные заболевания, MacKay I and Rose NR Eds., Нью-Йорк: Springer, 2014. ISBN 13: 9780387848280.
Bennett JC, Plum F, eds. Сесил Учебник медицины. 20-е изд. Филадельфия, Пенсильвания: W.B. Saunders Co; 1996: 1447.
СТАТЬИ ИЗ ЖУРНАЛА
Carpintero MF, Martinez L, Fernandez I, Romero AC, Mejia C, Zang YJ, Hoffman RW, Greidinger EL. Диагностика и стратификация риска у пациентов с аутоиммунитетом против РНП. Волчанка 2015 Сентябрь; 24 (10): 1057-66. https://www.ncbi.nlm.nih.gov/pubmed/25736140
Сзодорай П., Хаджас А., Кардос Л. и др.Отличительные фенотипы при смешанном заболевании соединительной ткани: подгруппы и выживаемость. Волчанка 2012; 21: 1412-22. https://www.ncbi.nlm.nih.gov/pubmed/22864236
Gunnarsson R, Molberg O, Gilboe IM, Gran JT; PAHNOR1 Study Group. Распространенность и частота смешанных заболеваний соединительной ткани: национальное многоцентровое исследование норвежских пациентов. Ann Rheum Dis. 2011 июн; 70 (6): 1047-51. https://www.ncbi.nlm.nih.gov/pubmed/21398332
Мальдонадо М., Перес М., Пиньяк-Кобингер Дж., Триана Е., Тозман Е., Грейдингер Е.Л., Хоффман Р.В.Клинические и иммунологические проявления смешанного заболевания соединительной ткани (MCTD) в популяции Майами по сравнению с популяцией MCTD Среднего Запада Кавказа. J Rheumatol. 2008; 35: 429-37. https://www.ncbi.nlm.nih.gov/pubmed/18260175
Hoffman RW, et al. Смешанное заболевание соединительной ткани. Curr Opin Rheumatol. 2000; 12: 386-90.
Мэддисон П.Дж. Смешанное заболевание соединительной ткани: синдромы перекрытия. Baillieres Best Practise Res Clin Rheumatol. 2000; 14: 111-24.
Ян YH и др. Детское смешанное заболевание соединительной ткани.

