Рекомендации остеоартроз – Остеоартроз > Клинические рекомендации РФ (Россия) > MedElement
Остеоартроз > Клинические рекомендации РФ (Россия) > MedElement
Диагностика
Диагноз ОА устанавливается на основании жалоб и анамнестических данных больного, клинико-инструментального исследования и исключения других заболеваний. Важным фактором диагностики является тщательный сбор анамнеза, позволяющий выделить определенные причины (факторы риска) развития ОА.
Факторы риска, связанные с развитием ОА
| Факторы | Описание |
| Системные | Возраст |
| Пол | |
| Раса | |
| Гормональный статус | |
| Генетические факторы | |
| Минеральная плотность кости | |
| Витамин Д | |
| Локальные | Предшествующее повреждение сустава |
| Слабость мышц | |
| Неправильная ось сустава | |
| Гипермобильность | |
| Внешние факторы | Ожирение |
| Избыточная нагрузка суставов | |
| Спортивная физическая нагрузка | |
| Профессиональные факторы |
Клиническая картина
Чаще в процесс вовлекаются суставы, подвергающиеся большой нагрузке (коленные, тазобедренные), мелкие суставы кистей (дистальные и проксимальные межфаланговые суставы, первый пястно-запястный сустав) и позвоночник. Большое значение имеет поражение тазобедренных и коленных суставов, являющееся основной причиной снижения качества жизни и инвалидизации больных, страдающих ОА.
Клиническая картина ОА включает три основных симптома: боль, крепитацию и увеличение объёмов суставов.
Ведущий клинический признак ОА – боль в суставах, продолжающаяся большинство дней предыдущего месяца. Причины суставных болей многочисленны. Они не связаны с поражением собственно хряща (он лишён нервных окончаний), а определяются изменениями в:
– синовиальной оболочке, связанными с воспалением;
– околосуставных тканях – повреждение связок, мышечный спазм, бурсит, растяжение капсулы сустава;
– психоэмоциональной сфере и др.
Характер болей разнообразный, но, как правило, механический, т.е. боли усиливаются при физической активности и ослабевают в покое. О наличии воспалительного компонента в происхождении болей может свидетельствовать внезапное без видимых причин их усиление, появление ночных болей, утренней скованности (чувство вязкости, геля в поражённом суставе), припухлости сустава (признак вторичного сино-вита). Иногда интенсивность боли меняется в зависимости от погодных условий (усиливается в холодное время года и при высокой влажности) и атмосферного давления, оказывающего влияние на давление в полости сустава. Гонартроз и коксартроз имеют определённые клинические особенности:
– При поражении тазобедренного сустава в начале заболевания боли локализуются не в области бедра, а в колене, паху, ягодице, усиливаются при ходьбе, стихают в покое, определяется ограничение и болезненность при внутренней ротации сустава в согнутом положении. Наблюдается атрофия ягодичных мышц, болезненность при пальпации паховой области латеральнее места пульсации бедренной артерии, укорочение ноги.
• Крепитация – характерный симптом ОА, проявляющийся хрустом, треском или скрипом в суставах при активном движении, возникает вследствие нарушения конгруэнтности суставных поверхностей, ограничения подвижности в суставе или блокады «суставной мышью» (фрагментом суставного хряща, свободно лежащего в суставной полости).
• Увеличение объёма сустава чаще происходит за счёт пролиферативных изменений (остеофитов), но может быть и следствием отёка околосуставных тканей. Особенно характерно образование узелков в области дистальных (узелки Гебердена) и проксимальных (узелки Бушара) меж-фаланговых суставов кистей. Выраженная припухлость и локальное повышение температуры над суставами возникает редко, но может появляться при развитии вторичного синовита. Постепенно развиваются деформации конечностей (варусная деформация коленных суставов, «квадратная» кисть, узелки Гебердена и Бушара соответственно в дистальных и проксимальных межфаланговых суставах кистей).
В отличие от воспалительных заболеваний суставов внесуставные проявления при ОА не наблюдают.
Лабораторные исследования
Патогномоничных для ОА лабораторных признаков не существует. Тем не менее, лабораторные исследования следует проводить в целях:
– Дифференциального диагноза (при ОА отсутствуют воспалительные изменения в клиническом анализе крови, не обнаруживают РФ, концентрация мочевой кислоты в сыворотке крови соответствует норме).
– Перед началом лечения (общий анализ крови и мочи, креатинин сыворотки крови, сывороточные трансаминазы) с целью выявления возможных противопоказаний для назначения ЛС.
– Для выявления воспаления необходимо исследовать СОЭ и С-реактивный протеин. Умеренное повышение характерно для вторичного синовита на фоне ОА. Выраженное повышение свидетельствует о другом заболевании.
– Исследование синовиальной жидкости следует проводить только при наличии синовита в целях дифференциального диагноза. Для ОА характерен невоспалительный характер синовиальной жидкости: прозрачная или слегка мутная, вязкая, с концентрацией лейкоцитов менее 2000/мм3.
Инструментальные исследования
Рентгенологическое исследование — наиболее достоверный метод диагностики ОА, который выявляет сужение суставной щели, краевые остеофиты и заострение мыщелков большеберцовой кости, субхондральный склероз.
При подозрении на ОА коленных суставов рентгеновский снимок делается в передне-задней и боковой проекциях в положении стоя, для исследования пателло-феморального сустава – снимок в боковой проекции при сгибании (В).
При подозрении на ОА тазобедренного сустава необходимо проводить рентгенологическое исследование костей таза с захватом обоих тазобедренных суставов (уровень С).
Классификация рентгенологических изменений при остеоартрите Келлгрена и Лоуренса (1957)
| 0 | Изменения отсутствуют |
| I | Сомнительные рентгенологические признаки |
| II | Минимальные изменения (небольшое сужение суставной щели, единичные остеофиты) |
| III | Умеренные проявления (умеренное сужение суставной щели, множественные остеофиты) |
| IV | Выраженные изменения (суставная щель почти не прослеживается, выявляются грубые остеофиты) |
Не редко рентгенологические признаки не коррелируют с клинической симптоматикой ОА и чаще только более выраженные рентгенологические изменения сопровождаются клиническими симптомами, поэтому в условиях первичной медицинской помощи пожилым больным с болью в колене при назначении лечения по поводу ОА рентгенологического подтверждения диагноза не требуется (С).
Показания к проведению рентгенографического исследования коленных суставов при первом обращении пациента
‒ Молодой возраст
‒ Травма, предшествовавшая появлению боли в суставе (для исключения перелома)
‒ Значительный выпот с выраженной дефигурацией сустава, особенно при поражении одного сустава
‒ Выраженное уменьшение объема движений в суставе
‒ Интенсивная боль в суставе, даже в случае, если диагноз ОА ранее был установлен
‒ Планируемая консультация ортопеда
‒ Неэффективность адекватной консервативной терапии
Повторное рентгенологическое исследование суставов при ОА должно использоваться только в клинических целях. Повторное рентгенологическое исследование суставов при ОА проводится при подозрении на присоединение новой патологии или планируемое хирургическое вмешательство на суставе(при направлении на консультацию к ортопеду).
Диагностические критерии
Таблица. Классификационные критерии остеоартроза (Альтман и др., 1991)
| Клинические | Клинические, лабораторные, рентгенологические |
| Коленные суставы | |
| 1. Боль | 1. Боль |
| и | и |
| 2а. Крепитация | 2. Остеофиты |
| 2б. Утренняя скованность £30 мин | или |
| 2в. Возраст ³38 лет | 3а. Синовиальная жидкость, характерная для ОА (или возраст ³40 лет) |
| или | |
| 3а. Крепитация | 3б. Утренняя скованность £30 мин |
| 3б. Утренняя скованность £30 мин | 3в. Крепитация |
| 3в. Костные разрастания | |
| или | |
| 4а. Отсутствие крепитации | |
| 4б. Костные разрастания | |
| Чувствительность 89% | Чувствительность 94% |
| Специфичность 88% | Специфичность 88% |
| Тазобедренные суставы | |
| 1. Боль | 1. Боль |
| и | и не менее 2-х из 3 критериев |
| 2а. Внутренняя ротация <15 | 2а. СОЭ <20 мм/ч |
| 2б. СОЭ < 15 мм/ч (или сгибание в тазобедренном суставе >115°) | 2б. Остеофиты |
| или | 2в. Сужение суставной щели |
| 3а. Внутренняя ротация <15° 3б. Утренняя скованность <60 мин 3в. Возраст >50 лет 3г. Боль при внутренней ротации | |
| Чувствительность 86% | Чувствительность 89% |
| Специфичность 75% | Специфичность 91% |
| Суставы кистей | |
| 1. Боль продолжительная или скованность 2. Костные разрастания 2-х и более суставов из 10 оцениваемых* 3. Менее 2 припухших пястно-фаланговых суставов 4а. Костные разрастания, включающие 2 и более дистальных межфаланговых сустава** (2-й и 3-й дистальные межфаланговые суставы могут приниматься во внимание в двух критериях: 2 и 4а) | |
| или | |
| 4б. Деформация одного и более суставов из 10 оцениваемых* | |
| Чувствительность 93% Специфичность 91% | |
Примечания. * — 2-й и 3-й дистальные межфаланговые суставы; 2-й и 3-й проксимальные межфаланговые суставы; 1-й запястно-пястный сустав обеих кистей. ** — 2-й и 3-й дистальные межфаланговые суставы могут приниматься во внимание в двух критериях: 2 и 4а
diseases.medelement.com
– ГБУ “КОКБ” Курганская областная клиническая больница — Официальный сайт
20 тысяч пациентов
ежегодно доверяют нам заботу о своем здоровье и проходят лечение в стационаре
10 тысяч операций
ежегодно выполняется в КОКБ, многие из которых уникальны
600 пациентов в день
обращаются в областную консультативную поликлинику, прием
проводится по 25 специальностям
1275 сотрудников
сегодня работает в КОКБ, в том числе 189 врачей и 558 средних медицинских работников
6
докторов
медицинских наук
18 кандидатов медицинских наук, 8 заслуженных врачей РФ трудятся сегодня к КОКБ
72% врачей
имеют высшую и первую категорию
6 корпусов
больничный городок состоит из 6 корпусов, хозяйственных служб
19
специализированных
отделений
в состав больницы входят 19 отделений на 520 коек
4
сертифицированные
лаборатории
Все виды анализов с использованием современного оборудования
1713
электронных
листков нетрудоспособности
выдано с начала 2018 года
7 врачей
ГБУ «КОКБ» в 2018 году удостоились награды «Лучший врач года»
24 врача
ГБУ «КОКБ» являются главными внештатными специалистами Департамента здравоохранения Курганской области
kokb45.ru
Остеоартроз > Клинические протоколы МЗ РК
Цели лечения:
– Замедление прогрессирования процесса,
– Уменьшение выраженности боли и воспаления,
– Снижение риска обострений и поражения новых суставов,
– Улучшение качество жизни и предотвращение инвалидизации.
Тактика лечения пациентов с ОА:
Немедикаментозное лечение:
– Физические упражнения при OA способствуют снижению боли и сохранению функциональной активности суставов. Кроме того, физические упражнения необходимы больным с точки зрения профилактики сердечно- сосудистых заболеваний.
– Диета. В отличие от первичной профилактики OA, специальных исследований, подтверждающих роль снижения массы тела в задержке прогрессирования уже имеющегося OA, не проводили. Следует ориентировать больных на поддержание нормальной массы тела с позиции механической разгрузки суставов, а также профилактики сердечно- сосудистой патологии.
– Ортезы для коленных суставов применяются при начальных стадиях заболевания, а также специально при деформациях – варус и вальгус вариантах с биомеханической коррекцией до 20º (EVERYDAY, MEDIAL, LATERAL (RT,LT)).
Медикаментозное лечение:
Основные:
НПВП плюс анальгетики (парацетамол до 1,5 г/сутки)
Синтетические анальгетики центрального действия ( трамадол 100 мг/2 мл)
Ацеклофенак 100 мг табл
Мелоксикам 15 мг, таб.
Диацереин 50мг, капс.
ГКС (локально) пролонгированного действия (при поражении крупных суставов):
1. Бетаметазона ацетат 4 мг/мл;
2. Метилпреднизолона ацетат 20,40,80 мг/мл
Внутрисуставные иньекции гиалуроната натрия (при поражениях крупных и мелких суставов)
Вязкоупругий имплантат 10 мг -1,0мл (остенил мини), внутрисуставно, для мелких суставов кисти и стоп 1 раз в неделю №3 (в течении 3 недель), вязкоупругий имплантат 20 мг-2.0 мл (остенил средний ) внутрисуставно для крупных суставов № 3, цикл из 3-5 иньекции, вводимых 1 раз в неделю, вязкоупругий имплантат 40 мг-2.0 мл (остенил плюс) в крупные суставы №1- 1 раз в неделю.
Хондропротекторы:
1. Хондроитин сульфат 1000 мг/сутки в течение 6 месяцев
2. Хондроитина сульфат мазь/гель для наружного применения 5% 30г. 3 раза в день 2-3 месяца.
3. Глюкозамин+ хондроитин сульфат (терафлекс 500мг, артра 500мг)
Перечень дополнительных медикаментов:
Дополнительные:
Антидепрессанты
1. Амитриптилин 25 мг, табл
2. Флуоксетин 10мг и 20мг, кап.
3. Венлафаксин 75 мг, 150 мг, капсулы пролонгированного действия, таблетки
Миорелаксанты центрального действия (толперизон 50-150 мг -3 раза в сутки, или внутримышечно 100 мг – 2 раза в сутки)
СИМПТОМАТИЧЕСКИЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА БЫСТРОГО ДЕЙСТВИЯ
•Парацетамол показан при умеренных болях (при OA без признаков воспаления ) с целью уменьшения боли. Дозу парацетамола подбирают индивидуально, но не более 2,0 г/сут, так как более высокие дозы сопровождаются развитием осложнений со стороны ЖКТ. В указанной дозе доказана безопасность применения парацетамола при OA в течение 2 лет.
•НПВП показаны при OA в случае неэффективности парацетамола, а также при наличии признаков воспаления. Преимущества по эффективности какого-либо НПВП над другим не выявлено. Выбор НПВП определяется прежде всего его безопасностью в конкретных клинических условиях. Например, среди клинико-фармакологических свойств индометацина следует принять во внимание его отрицательное воздействие на метаболизм суставного хряща при OA. ♦Селективные ингибиторы ЦОГ-2 следует назначать при наличии следующих факторов риска развития нежелательных явлений: возраст старше 65 лет, наличие в анамнезе язвенной болезни или желудочно- кишечного кровотечения, одновременный приём ГК или антикоагулянтов, тяжёлые сопутствующие заболевания.
♦Приём неселективных НПВП в сочетании с синтетическим простагландином мизопростолом в дозе 200— 800 мг/сут, несмотря на наличие положительного эффекта в отношении ЖКТ, имеет значительно более высокую стоимость лечения.
♦НПВП при OA применяют только в период усиления болей, в отличие от их систематического приёма при воспалительных артритах. Доза НПВП при OA ниже, чем при артритах. Неселективные ингибиторы ЦОГ: лорноксикам 12-16 мг/сут; ибупрофен по 400—600 мг 3 раза в сутки, кетопрофен по 100 мг/сут, диклофенак по 50 мг 2 раза в сутки, лорноксикам 12-16 мг/сут. Селективные ингибиторы ЦОГ-2: ацеклофенак 200 мг/сут, мелоксикам 7,5 мг/сут, нимесулид по 100 мг 2 раза в сутки, целекоксиб по 100 мг 1 —2 раза в сутки
•лекарство из группы наркотических обезболивающих средств (анальгетиков). Трамадол (опиоидный анальгетик, в первые дни по 50 мг/сут с постепенным увеличением дозы до 200—300 мг/сут) применяют в течение короткого периода для купирования сильной боли при условии неэффективности парацетамола или НПВП, а также невозможности назначения оптимальных доз этих ЛС.
СИМПТОМАТИЧЕСКИЕ ЛЕКАРСТВЕННЫЕ СРЕДСТВА МЕДЛЕННОГО ДЕЙСТВИЯ
•Колхицин. Применяют в случае множественного поражения суставов при OA с признаками воспаления и выраженными болями, резистентным к другому лечению. Применение колхицина основано, с одной стороны, на обнаружении в указанных случаях OA кристаллов пирофосфата кальция в синовиальной жидкости, а с другой стороны — на свойстве колхицина тормозить дегрануляцию нейтрофилов, стимулированных кристаллами. Колхицин назначают в дозе 1 мг/сут.
Внутрисуставное введение глюкокортикоидов. Введение ГК в полость сус- тава показано при OA с симптомами воспаления. При OA ГК вводят только в коленные суставы. Эффект лечения, выражающийся в уменьшении боли и симптомов воспаления, длится от 1 нед до 1 мес. Применяют триамцинолон (20-40 мг), метилпреднизолон (20-40 мг), бетаметазон (2-4 мг). Частоту введения не следует превышать более 2—3 в год. Более частое введение не рекомендуют ввиду прогрессирования разрушения хряща.
• Хондроитина сульфат, глюкозамина гидрохлорид назначают внутрь по 500 мг глюкозамина гидрохлорида, 400 мг хондроитина сульфата 3 раза в сутки первые 3 недели, затем по 500 мг глюкозамина гидрохлорида, 400 мг хондроитина сульфата 2 раза в сутки. Минимальный курс приема – 2 месяца. Курсы лечения повторят с интервалами в 3 месяца.
• Препараты, содержащие хондроитин сульфат и глюкозамина сульфат, уменьшают боли в суставах при ОА; эффект сохраняется в течение нескольких месяцев после их отмены, хорошо переносятся больными (принимаются перорально и парентерально). Получены данные об их возможном структур- но-модифицирующем действии (замедление сужения суставной щели, образования остеофитов) при OA коленных суставов (хондроитин сульфат, глюкозамина сульфат), мелких суставов кистей (хондроитин сульфат), при остеоартрите у женщин постменопаузального возраста (глюкозамина сульфат).
♦Хондроитин сульфат применяют по 750 мг 2 раза в сутки – первые 3 нед, затем по 500 мг внутрь 2 раза в сутки, длительность курса — 6 мес.
♦Глюкозамина сульфат назначают внутрь по 1500 мг/сут (однократно) или в/м 2—3 раза в неделю, общий курс 4-12 нед, курсы повторяют 2— 3 раза в год.
• Производные гиалуроната (остенил) применяют для внутрисуставного введения с оптимальной молекулярной массой гиалуроната. Лечение хорошо переносится, очень редко при их введении боли в суставе могут усиливаться по типу псевдоподагрической атаки. Получены данные об их структурно-модифицированном эффекте (восполнение синовиальной жидкости в суставе, действующее как амортизирующее средство, смазочное вещество и фильтр, предотвращая проникновение вредных веществ и клеток, вызывающих воспаление).
Ингибитор интерлейкина 1 (диацереин) применяют для уменьшения боли, улучшения функции суставов и, вероятно, замедления прогрессирования ОА. Диацереин уменьшает боль, эффект сохраняется в течение нескольких месяцев после завершения лечения при ОА коленных и тазобедренных суставов. Диацереин применяют по 50 мг 1раз в сутки, затем по 50мг 2 раза в сутки; длительно.
Неомыляемые соединения авокадо и сои (НСАС) – пиаскледин применяют для уменьшения боли, улучшения функции суставов и, вероятно, замедления прогрессирования ОА. НСАС повышают уровень стимуляторов тканевой продукции и оказывают хондропротективный эффект при индуцированном ОА. НСАС уменьшает боль, снижает потребность в НПВП и обладает последействием в течение нескольких месяцев после завершения лечения. Пиаскледин применяют по 300 мг 1 раз в сутки, длительно.
Другие виды лечения. Хирургическое лечение. Эндопротезирование суставов показано у больных ОА с выраженным болевым синдромом, не поддающимся консервативному лечению, при наличии серьёзного нарушения функций сустава (до развития значительных деформаций, нестабильности сустава, контрактур и мышечной атрофии). Наилучшие результаты эндопротезирования отмечены у больных в возрасте 45–75 лет, с массой тела <70 кг, с высоким социальным уровнем жизни.
Профилактические мероприятия – контроль за массой тела – исключение тяжелых физических перегрузок (бытовых, спортивных, профессиональных).
Дальнейшее ведение
– Диспансерное наблюдение
– При прогрессирующем течении – консультация хирургов (для решения вопроса необходимости хирургической коррекции),
Индикаторы эффективности лечения:
• Отсутствие поражения новых суставов.
• Уменьшение или исчезновение болевого синдрома, признаков воспаления.
• Улучшение качества жизни.
diseases.medelement.com
Лечение остеоартроза клинические рекомендации
Эндопротезирование коленных суставов приводит к уменьшению боли и улучшению двигательной функции.
Федеральные клинические рекомендации по диагностике и лечению остеоартроза

Общероссийская общественная организация «Ассоциация ревматологов России»
Федеральные клинические рекомендации по диагностике и лечению остеоартроза
2. Определение и диагностика ………………………………. 4
2.4. Клиническая картина ……………………………………..6
2.5. Лабораторные исследования …………………………8
2.6. Инструментальные исследования ………………….8
2.7. Диагностические критерии …………………………….10
2.8. Дифференциальный диагноз ………………………….11
3.1. Нефармакологические методы……………………….12
3.2. Медикаментозное лечение …………………………….14
3.3. Хирургическое лечение …………………………………..17
3.4. Алгоритм ведения больных ОА ……………………….18
Методы, использованные для сбора/селекции доказательств:
поиск в электронных базах данных
Описание методов, использованных для сбора/селекции доказательств:
Методы, использованные для оценки качества и силы доказательств
· Оценка значимости в соответствии с рейтинговой схемой
Уровни доказательности, принятые при разработке данных рекомендаций
· высококачественный (++) обзор или систематический обзор когортных исследований или исследований случай-контроль или
· высококачественное (++) когортное исследование или исследование случай контроль с очень низким уровнем систематической ошибки или
· описание серии случаев или
· неконтролируемое исследование или
Индикаторы доброкачественной практики (Good Practice Points – GPPs)
Рекомендуемая доброкачественная практика базируется на клиническом опыте членов рабочей группы по разработке рекомендаций
Экономический анализ не проводился и публикации по фармакоэкономике не анализировались
Метод валидизации рекомендаций:
· Внешняя экспертная оценка
· Внутренняя экспертная оценка
2. Определение и диагностика
2.1.Определение
ОА — гетерогенная группа заболеваний различной этиологии со сходными биологическими, морфологическими, клиническими проявлениями и исходом, в основе которых лежит поражение всех компонентов сустава, в первую очередь хряща, а также субхондральной кости, синовиальной оболочки, связок, капсулы, околосуставных мышц.
МКБ-10: М15–М19 Артрозы
Аббревиатура: ОА — остеоартроз
Выделяют две основные формы остеоартроза: первичный (идиопатический) и вторичный, возникающий на фоне различных заболеваний.
Локализованный (поражение менее 3 суставов)
Генерализованный (поражение 3 групп суставов и более)
— Врождённые, приобретённые, эндемические заболевания (болезнь Пертеса, синдром гипермобильности и др.)
— Метаболические болезни ( охроноз, гемохроматоз, болезнь Вильсона—Коновалова, болезнь Гоше)
— Эндокринопатии ( акромегалия, гиперпаратиреоз, сахарный диабет, гипотиреоз)
— Болезнь отложения кальция (пирофосфат кальция, гидроксиапатит)
— Невропатии (болезнь Шарко)
— Другие заболевания (остеонекроз, ревматоидный артрит, болезнь Педжета и др.)
Факторы риска, связанные с развитием ОА
Минеральная плотность кости
Предшествующее повреждение сустава
Неправильная ось сустава
Избыточная нагрузка суставов
Спортивная физическая нагрузка
Клиническая картина ОА включает три основных симптома: боль, крепитацию и увеличение объёмов суставов.
ü субхондральной кости – усиление костной резорбции на ранних стадиях заболевания, отек костного мозга, рост остеофитов;
ü синовиальной оболочке, связанными с воспалением;
ü околосуставных тканях — повреждение связок, мышечный спазм, бурсит, растяжение капсулы сустава;
ü психоэмоциональной сфере и др.
В отличие от воспалительных заболеваний суставов внесуставные проявления при ОА не наблюдают.
2.5. Лабораторные исследования
Патогномоничных для ОА лабораторных признаков не существует. Тем не менее, лабораторные исследования следует проводить в целях:
v Дифференциального диагноза (при ОА отсутствуют воспалительные изменения в клиническом анализе крови, не обнаруживают РФ, концентрация мочевой кислоты в сыворотке крови соответствует норме).
v Перед началом лечения (общий анализ крови и мочи, креатинин сыворотки крови, сывороточные трансаминазы) с целью выявления возможных противопоказаний для назначения ЛС.
v Исследование синовиальной жидкости следует проводить только при наличии синовита в целях дифференциального диагноза. Для ОА характерен невоспалительный характер синовиальной жидкости: прозрачная или слегка мутная, вязкая, с концентрацией лейкоцитов менее 2000/мм3.
2.6. Инструментальные исследования
Классификация рентгенологических изменений при остеоартрите
Келлгрена и Лоуренса (1957)
Сомнительные рентгенологические признаки
Минимальные изменения (небольшое сужение суставной щели, единичные остеофиты)
Умеренные проявления (умеренное сужение суставной щели, множественные остеофиты)
IV Выраженные изменения (суставная щель почти не прослеживается,
выявляются грубые остеофиты)
Показания к проведению рентгенографического исследования коленных суставов при первом обращении пациента
‒ Травма, предшествовавшая появлению боли в суставе (для исключения перелома)
‒ Значительный выпот с выраженной дефигурацией сустава, особенно при поражении одного сустава
‒ Выраженное уменьшение объема движений в суставе
‒ Интенсивная боль в суставе, даже в случае, если диагноз ОА ранее был установлен
‒ Неэффективность адекватной консервативной терапии
2.7. Диагностические критерии
Ы Автору. Таблица переделана. Прошу выверить, но изменений непосредственно в эту таблицу не вносить: либо ниже перекопируйте таблицу и правьте в ней (изменения обязательно выделить шрифтом иного цвета и оговорить цвет шрифта), либо опишите нужные изменения словами. ЭГ, 28.02.05 20:41
Ы ВЁРСТКА. Вставить таблицу 40 «Классификационные критерии остеоартроза»
Ы Вёрстка. К таблице имеется подтабличное примечание: не отрывать от таблицы.
Таблица 40. Классификационные критерии остеоартроза (Альтман и др., 1991)13
Клинические, лабораторные, рентгенологические
Клинические рекомендации Остеоартроз (взрослые, дети) Сокращённый вариант
СМОТРЕТЬ ДРУГИЕ КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
Год утверждения: 2016 (пересмотр каждые 2 года)
Профессиональные ассоциации:
Общероссийская общественная организация «Ассоциация ревматологов России»
Оглавление
1. Краткая информация
1.1 Определение
Остеоартроз (ОА) — поражение всех компонентов сустава различной этиологии со сходными проявлениями и исходом.
1.2 Этиология и патогенез
Патологический процесс возникает в результате взаимодействия возрастных, гормональных, генетических и средовых факторов.
1.3 Эпидемиология
Самое частое заболевание суставов — более 10% населения.
С 2000 по 2010 год в РФ число больных ОА увеличилось почти в 2.5 раза.
В России распространенность коленного и (или) тазобедренного ОА у населения старше 18 лет -13%.
1.4 Кодирование по МКБ-10
Остеоартроз (M15- М19):
М15 – Первичный генерализованный остеоартроз;
М15.1 – Узлы Гебердена;
М15.2 – Узлы Бушара;
М18 – Артроз 1-го запястно-пястного сустава;
М19 – Другие остеоартрозы.
1.5. Классификация
Локальный — поражение одной группы суставов.
Генерализованный — поражение 3 и более суставных групп.
Клиническая классификация ОА:
1. Первичный ОА: коленные; тазобедренные; суставы кистей; суставы стоп; позвоночник; другие. суставы.
Скорая медицинская помощь при эклампсии и преэклампсии (Алгоритм действий на основе Рекомендаций РОСМП)
Клинические рекомендации Хронический болевой синдром (ХБС) у взрослых пациентов, нуждающихся в паллиативной медицинской помощи Сокращённый вариант
Скорая медицинская помощь при напряженном пневмотораксе (Алгоритм действий на основе Рекомендаций РОСМП)
Клинические рекомендации Фибрилляция и трепетание предсердий у взрослых Сокращённый вариант
Клинические рекомендации Острая респираторная вирусная инфекция (ОРВИ) у детей Сокращённый вариант
Обновленные рекомендации ESCEO (2016) по фармакотерапии остеоартроза коленного сустава: от научных доказательств к результатам в реальной клинической практике

Шаг 1: Стартовое
фармакологическое лечение
Парацетамол
Симптоматические препараты замедленного действия для лечения остеоартроза (SYSADOAs)
Топические НПВС
Шаг 2: Расширенное фармакологическое лечение
Пероральные НПВС
Гиалуроновая кислота
Шаг 3: Терапия резерва
Трамадол
Подготовила Наталья Мищенко
СТАТТІ ЗА ТЕМОЮ Хірургія, ортопедія та анестезіологія
Оценка статьи:
 Загрузка…
Загрузка…Поделиться с друзьями:
Твитнуть
Поделиться
Поделиться
Отправить
Класснуть
Лечение остеоартроза клинические рекомендации Ссылка на основную публикацию

Adblock detector
| Эндопротезирование суставов |
sanatorii-volna.ru
Клинические рекомендации по лечению остеоартроза
Эндопротезирование коленных суставов приводит к уменьшению боли и улучшению двигательной функции.
Федеральные клинические рекомендации по диагностике и лечению остеоартроза

Общероссийская общественная организация «Ассоциация ревматологов России»
Федеральные клинические рекомендации по диагностике и лечению остеоартроза
2. Определение и диагностика ………………………………. 4
2.4. Клиническая картина ……………………………………..6
2.5. Лабораторные исследования …………………………8
2.6. Инструментальные исследования ………………….8
2.7. Диагностические критерии …………………………….10
2.8. Дифференциальный диагноз ………………………….11
3.1. Нефармакологические методы……………………….12
3.2. Медикаментозное лечение …………………………….14
3.3. Хирургическое лечение …………………………………..17
3.4. Алгоритм ведения больных ОА ……………………….18
Методы, использованные для сбора/селекции доказательств:
поиск в электронных базах данных
Описание методов, использованных для сбора/селекции доказательств:
Методы, использованные для оценки качества и силы доказательств
· Оценка значимости в соответствии с рейтинговой схемой
Уровни доказательности, принятые при разработке данных рекомендаций
· высококачественный (++) обзор или систематический обзор когортных исследований или исследований случай-контроль или
· высококачественное (++) когортное исследование или исследование случай контроль с очень низким уровнем систематической ошибки или
· описание серии случаев или
· неконтролируемое исследование или
Индикаторы доброкачественной практики (Good Practice Points – GPPs)
Рекомендуемая доброкачественная практика базируется на клиническом опыте членов рабочей группы по разработке рекомендаций
Экономический анализ не проводился и публикации по фармакоэкономике не анализировались
Метод валидизации рекомендаций:
· Внешняя экспертная оценка
· Внутренняя экспертная оценка
2. Определение и диагностика
2.1.Определение
ОА — гетерогенная группа заболеваний различной этиологии со сходными биологическими, морфологическими, клиническими проявлениями и исходом, в основе которых лежит поражение всех компонентов сустава, в первую очередь хряща, а также субхондральной кости, синовиальной оболочки, связок, капсулы, околосуставных мышц.
МКБ-10: М15–М19 Артрозы
Аббревиатура: ОА — остеоартроз
Выделяют две основные формы остеоартроза: первичный (идиопатический) и вторичный, возникающий на фоне различных заболеваний.
Локализованный (поражение менее 3 суставов)
Генерализованный (поражение 3 групп суставов и более)
— Врождённые, приобретённые, эндемические заболевания (болезнь Пертеса, синдром гипермобильности и др.)
— Метаболические болезни ( охроноз, гемохроматоз, болезнь Вильсона—Коновалова, болезнь Гоше)
— Эндокринопатии ( акромегалия, гиперпаратиреоз, сахарный диабет, гипотиреоз)
— Болезнь отложения кальция (пирофосфат кальция, гидроксиапатит)
— Невропатии (болезнь Шарко)
— Другие заболевания (остеонекроз, ревматоидный артрит, болезнь Педжета и др.)
Факторы риска, связанные с развитием ОА
Минеральная плотность кости
Предшествующее повреждение сустава
Неправильная ось сустава
Избыточная нагрузка суставов
Спортивная физическая нагрузка
Клиническая картина ОА включает три основных симптома: боль, крепитацию и увеличение объёмов суставов.
ü субхондральной кости – усиление костной резорбции на ранних стадиях заболевания, отек костного мозга, рост остеофитов;
ü синовиальной оболочке, связанными с воспалением;
ü околосуставных тканях — повреждение связок, мышечный спазм, бурсит, растяжение капсулы сустава;
ü психоэмоциональной сфере и др.
В отличие от воспалительных заболеваний суставов внесуставные проявления при ОА не наблюдают.
2.5. Лабораторные исследования
Патогномоничных для ОА лабораторных признаков не существует. Тем не менее, лабораторные исследования следует проводить в целях:
v Дифференциального диагноза (при ОА отсутствуют воспалительные изменения в клиническом анализе крови, не обнаруживают РФ, концентрация мочевой кислоты в сыворотке крови соответствует норме).
v Перед началом лечения (общий анализ крови и мочи, креатинин сыворотки крови, сывороточные трансаминазы) с целью выявления возможных противопоказаний для назначения ЛС.
v Исследование синовиальной жидкости следует проводить только при наличии синовита в целях дифференциального диагноза. Для ОА характерен невоспалительный характер синовиальной жидкости: прозрачная или слегка мутная, вязкая, с концентрацией лейкоцитов менее 2000/мм3.
2.6. Инструментальные исследования
Классификация рентгенологических изменений при остеоартрите
Келлгрена и Лоуренса (1957)
Сомнительные рентгенологические признаки
Минимальные изменения (небольшое сужение суставной щели, единичные остеофиты)
Умеренные проявления (умеренное сужение суставной щели, множественные остеофиты)
IV Выраженные изменения (суставная щель почти не прослеживается,
выявляются грубые остеофиты)
Показания к проведению рентгенографического исследования коленных суставов при первом обращении пациента
‒ Травма, предшествовавшая появлению боли в суставе (для исключения перелома)
‒ Значительный выпот с выраженной дефигурацией сустава, особенно при поражении одного сустава
‒ Выраженное уменьшение объема движений в суставе
‒ Интенсивная боль в суставе, даже в случае, если диагноз ОА ранее был установлен
‒ Неэффективность адекватной консервативной терапии
2.7. Диагностические критерии
Ы Автору. Таблица переделана. Прошу выверить, но изменений непосредственно в эту таблицу не вносить: либо ниже перекопируйте таблицу и правьте в ней (изменения обязательно выделить шрифтом иного цвета и оговорить цвет шрифта), либо опишите нужные изменения словами. ЭГ, 28.02.05 20:41
Ы ВЁРСТКА. Вставить таблицу 40 «Классификационные критерии остеоартроза»
Ы Вёрстка. К таблице имеется подтабличное примечание: не отрывать от таблицы.
Таблица 40. Классификационные критерии остеоартроза (Альтман и др., 1991)13
Клинические, лабораторные, рентгенологические
📕 Клинические рекомендации Остеоартроз (взрослые, дети) Сокращённый вариант
СМОТРЕТЬ ДРУГИЕ КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
Год утверждения: 2016 (пересмотр каждые 2 года)
Профессиональные ассоциации:
Общероссийская общественная организация «Ассоциация ревматологов России»
Оглавление
1. Краткая информация
1.1 Определение
Остеоартроз (ОА) — поражение всех компонентов сустава различной этиологии со сходными проявлениями и исходом.
1.2 Этиология и патогенез
Патологический процесс возникает в результате взаимодействия возрастных, гормональных, генетических и средовых факторов.
1.3 Эпидемиология
Самое частое заболевание суставов — более 10% населения.
С 2000 по 2010 год в РФ число больных ОА увеличилось почти в 2.5 раза.
В России распространенность коленного и (или) тазобедренного ОА у населения старше 18 лет -13%.
1.4 Кодирование по МКБ-10
Остеоартроз (M15- М19):
М15 – Первичный генерализованный остеоартроз;
М15.1 – Узлы Гебердена;
М15.2 – Узлы Бушара;
М18 – Артроз 1-го запястно-пястного сустава;
М19 – Другие остеоартрозы.
1.5. Классификация
Локальный — поражение одной группы суставов.
Генерализованный — поражение 3 и более суставных групп.
Клиническая классификация ОА:
1. Первичный ОА: коленные; тазобедренные; суставы кистей; суставы стоп; позвоночник; другие. суставы.
📗 Скорая медицинская помощь при эклампсии и преэклампсии (Алгоритм действий на основе Рекомендаций РОСМП)
📕 Клинические рекомендации Хронический болевой синдром (ХБС) у взрослых пациентов, нуждающихся в паллиативной медицинской помощи Сокращённый вариант
📗 Скорая медицинская помощь при напряженном пневмотораксе (Алгоритм действий на основе Рекомендаций РОСМП)
📕 Клинические рекомендации Фибрилляция и трепетание предсердий у взрослых Сокращённый вариант
📕 Клинические рекомендации Острая респираторная вирусная инфекция (ОРВИ) у детей Сокращённый вариант
Обновленные рекомендации ESCEO (2016) по фармакотерапии остеоартроза коленного сустава: от научных доказательств к результатам в реальной клинической практике

Шаг 1: Стартовое
фармакологическое лечение
Парацетамол
Симптоматические препараты замедленного действия для лечения остеоартроза (SYSADOAs)
Топические НПВС
Шаг 2: Расширенное фармакологическое лечение
Пероральные НПВС
Гиалуроновая кислота
Шаг 3: Терапия резерва
Трамадол
Подготовила Наталья Мищенко
СТАТТІ ЗА ТЕМОЮ Хірургія, ортопедія та анестезіологія
Оценка статьи:
 Загрузка…
Загрузка…Поделиться с друзьями:
Твитнуть
Поделиться
Поделиться
Отправить
Класснуть
Клинические рекомендации по лечению остеоартроза Ссылка на основную публикацию

Adblock detector
| Эндопротезирование суставов |
sanatorii-volna.ru
Обновление клинических рекомендаций по лечению больных остеоартритом 2019 года | Алексеева Л.И.
В статье представлены обновленные на основании доказательной системы GRADE и новых систематических обзоров и метаанализов клинические рекомендаций по лечению больных остеоартритом 2019 года.

Введение
Остеоартрит (ОА) — это хроническое прогрессирующее заболевание, при котором в зависимости от тяжести болезни требуется комплексный подход к лечению. ОА чаще возникает во второй половине жизни, и, по данным эпидемиологических исследований, частота его возрастает из-за увеличения продолжительности жизни человека. Второй, не менее важной, причиной его возникновения является «эпидемия» ожирения, которое не только ассоциируется с развитием ОА, но и обусловливает более быструю прогрессию болезни [1]. Эти факторы определяют и высокую коморбидность больного ОА, при которой наблюдается повышение риска развития кардиоваскулярных заболеваний (КВЗ), нежелательных явлений (НЯ) со стороны желудочно-кишечного тракта (ЖКТ), почек, влияющих на выбор антиостеоартритической терапии.
Современная модель доказательной медицины основывается на принципе использования баз данных, путем анализа которых принимаются клинические решения и рекомендации. Рекомендации, в свою очередь, создаются на основе баланса между относительной пользой и вредом от лечения, с одной стороны, и важности лечения для пациента и его предпочтений — с другой.
Работа над рекомендациями по лечению больных ОА крупных суставов берет свое начало в 1995 г., когда эксперты Американского колледжа ревматологов предложили клинические рекомендации по управлению ОА крупных суставов. Немного позже последовательно появились рекомендации, созданные под эгидой EULAR (European League Against Rheumatism — Европейская антиревматическая лига) по управлению ОА коленных, тазобедренных суставов и суставов кистей [2–4]. Далее были предложены совместные европейские и американские рекомендации по ведению больных ОА [5–7].
Углубленное изучение патогенетических путей развития болезни привело к пониманию того, что ОА включает в себя несколько подтипов болезни, которые можно гипотетически разделить, например, по установленным факторам риска развития ОА либо по первоначальным изменениям тех или иных тканей, образующих сустав (остеогенный, воспалительный и др.). И, безусловно, меняющееся представление об ОА ставит новые задачи по его лечению, а именно создание рекомендаций для определенного фенотипа ОА. Это обусловлено прежде всего весьма противоречивыми результатами многочисленных систематических обзоров и метаанализов, на основании которых разрабатываются клинические рекомендации по лечению ОА.
Подходы к лечению ОА
Первая попытка персонифицированного подхода к лечению ОА коленных суставов была предпринята экспертами OARSI (Osteoarthritis Research Society International — Международное общество по изучению остеоартрита) [8], которые предложили дифференцированный подход к лечению на основании выделения фенотипов ОА по локализации поражения и наличию или отсутствию коморбидности (рис. 1).
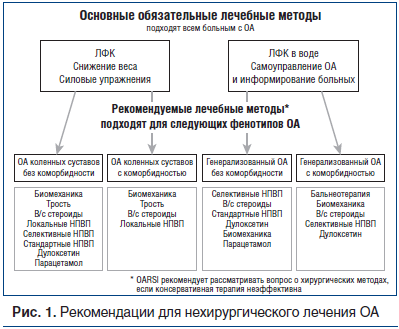
В июле 2014 г. [9] был опубликован алгоритм ведения больных ОА коленных суставов в реальной клинической практике, последовательно отражающий основные принципы лечения ОА. Он был создан комитетом, состоящим из клиницистов и ученых разных стран, Европейского общества по клиническим и экономическим аспектам остеопороза и остеоартрита (ESCEO), и учитывал эффективность и безопасность лечебных мероприятий.
Существующие многочисленные рекомендации по лечению ОА содержат данные по эффективности тех или иных методов лечения, но различные уровни доказательств относительно безопасности и НЯ терапии ОА. На очередном конгрессе ESCEO в 2019 г., состоявшемся в Париже, были обновлены прежние рекомендации на основании доказательной системы GRADE и новых систематических обзоров и метаанализов.
Лечение больных ОА должно проводиться с использованием комбинации нефармакологических и фармакологических методов. Нефармакологические методы помимо образовательных программ, лечебной физкультуры и снижения массы тела должны включать ортопедические приспособления для коррекции оси сустава. Интересно, что недавно появились рекомендации по немедикаментозным методам для врачей первичного звена (рис. 2), которые с учетом гетерогенности боли при ОА рекомендуют психосоциальные вмешательства и коррекцию нарушений сна [10].
![Рис. 2. Рекомендации EULAR по ведению пациентов с ОА [10] Рис. 2. Рекомендации EULAR по ведению пациентов с ОА [10]](/800/600/https/www.rmj.ru/upload/medialibrary/a78/2-2.png)
Что касается медикаментозного лечения, то пошаговое назначение препаратов сохранено (рис. 3). Шаг 1 — это базисное лечение ОА. На первых этапах при небольших болях рекомендовался прием парацетамола. Парацетамол длительное время использовался в качестве анальгетического средства при ОА благодаря его безопасности, несмотря на относительно небольшой анальгетический эффект. В последние годы стало увеличиваться количество данных о повышении частоты развития КВЗ, НЯ со стороны ЖКТ, почек и печени при длительном его применении. Conaghan et al. [11] представили клинический обзор литературы по безопасности парацетамола, рекомендуя c осторожностью использовать его при хронической боли.
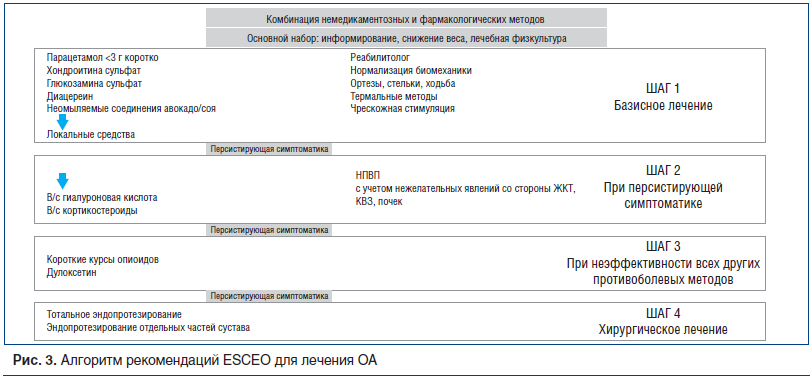
Симптоматические медленнодействующие препараты (SYSADOA) — класс разнообразных препаратов, которые положительно влияют на симптомы ОА и имеют доказательства болезнь-модифицирующего действия при их длительном применении [12–14]. Метаанализы плацебо-контролируемых исследований SYSADOA доказали, что глюкозамина сульфат (ГС), хондроитина сульфат (ХС) и диацереин, неомыляемые соединения авокадо/соя обладают положительным действием (от небольшого до умеренного) при ОА [14]. ESCEO рекомендуют использование этих препаратов, но только фармацевтически качественных, как первое базисное лечение ОА. Применение в нескольких исследованиях кристаллизованного ГС продолжительностью от 6 мес. до 3 лет при ОА доказало его преимущество перед плацебо по влиянию на боль (0,27 (95% доверительный интервал (95% ДИ): 0,12–0,43) и функцию суставов (0,33 (95% ДИ: 0,17–0,48) [15]. Другими словами, размер эффекта оказался таким же, как при применении коротких курсов нестероидных противовоспалительных препаратов (НПВП), а применение его в течение 3 лет замедляло прогрессирование ОА [16]. В России появились инъекционная и пероральная формы ГС — Сустагард®Артро, изучен синергизм препарата с 7 наиболее часто назначаемыми НПВП, его антитромботические эффекты, безопасность его применения при сопутствующем сахарном диабете, установлено синергичное действие ГС одновременно на транскриптом, протеом и реактом. Комплексное противовоспалительное действие ГС, снижающее синтез провоспалительных цитокинов и ослабляющее их воздействие на клетки, является фактором, влияющим на патогенез не только ОА, но и коморбидных ему патологий, сопровождающихся хроническим воспалением [17, 18].
ХС тоже способен замедлять прогрессирование ОА, кроме того, этот препарат обладает довольно выраженным действием на боль — размер анальгетического эффекта, по некоторым данным, достигает 0,75. Недавно опубликованное исследование показало эффективность ХС в отношении уменьшения структурных изменений в суставах с параллельным симптоматическим клинически значимым действием [19], что нашло подтверждение и в последующих работах. Эффективность и безопасность инъекционной формы ХС (Хондрогард®) изучались у 70 пациентов с ОА коленных суставов в ФГБНУ НИИР им. В.А. Насоновой. Терапия ХС в виде внутримышечных инъекций была эффективна у подавляющего большинства больных. Отмечено статистически значимое улучшение как отдельных показателей: боли, скованности, функциональной недостаточности (ФН), так и индекса WOMAC (Western Ontario and McMaster Universities Osteoarthritis Index) в целом. Из 63 пациентов, отметивших положительный эффект проводимой терапии, полностью прекратили прием НПВП 44% человек. Уменьшили дозу в 2 раза или стали принимать НПВП не чаще 1 раза в 3 дня 33% больных [20].
Несмотря на противоречивость некоторых рекомендаций по лечению ОА, SYSADOA широко с успехом используются во многих странах и как рецептурные препараты, и как продаваемые без рецепта. Профиль безопасности препаратов этой группы был представлен в систематическом обзоре и метаанализе исследований по сравнению SYSADOA с плацебо при ОА [21]. ХС и ГС, только фармацевтически качественные, рекомендуются как безопасные и эффективные SYSADOA. Ограниченные данные относительно безопасности представлены по неомыляемым соединениям авокадо/соя, которые содержат ингредиенты из многих натуральных растительных экстрактов, показана безопасность запатентованного препарата. Применение диацереина ассоциируется с отдельными небезопасными явлениями, поэтому польза препарата должна оцениваться для каждого пациента с учетом подходящей дозы и характеристик больного [22].
Локальные НПВП в целом рекомендуются до назначения пероральных НПВП, они обладают умеренным действием на боль, сравнимым с эффектом пероральных НПВП, но лучшим профилем безопасности благодаря низкой системной адсорбции. Эти данные систематического обзора и метаанализа представлены Honvo et al. [23]. Было отмечено незначимое увеличение кожных и подкожных НЯ, большинство из них относились к диклофенаку. Локальные НПВП могут рассматриваться как безопасное лечение, особенно по отношению к ЖКТ.
При персистирующей симптоматике назначаются системные НПВП. Их средняя эффективность при лечении боли ассоциируется с широким диапазоном токсичности со стороны ЖКТ, КВЗ и почек. В литературном обзоре Cooper et al. [24] представили резюме по безопасности неселективных НПВП с 2011 г. Отмечено, что токсичность как в отношении ЖКТ, так и в отношении сердечно-сосудистой системы присуща всем НПВП [25]. Практически все НПВП потенциально могут вызывать острое повреждение почек, и коморбидные больные ОА с такими патологиями, как сахарный диабет 1 типа, артериальная
гипертензия и сердечная недостаточность, имеют увеличенный риск развития НЯ.
Curtis et al. представили систематический обзор и метаанализ ингибиторов циклооксигеназы 2 типа
(ЦОГ-2) [26]. Хотя ингибиторы ЦОГ-2 были созданы для того, чтобы избежать НЯ со стороны верхних отделов ЖКТ, результаты этого анализа показали наличие повышенного риска со стороны указанных отделов, особенно абдоминальной боли, у всех препаратов данного класса. Эти препараты ассоциируются с увеличением риска КВЗ. Даже при удалении из метаанализа рофекоксиба риск развития сердечной недостаточности и отеков остается значимым, поэтому предлагается осторожный подход к использованию НПВП и ингибиторов ЦОГ-2 при выборе лечения, с учетом индивидуальных характеристик пациента и ограничением длительности применения препаратов — интермиттирующего или курсового — для минимизации НЯ.
Внутрисуставное введение гиалуроновой кислоты (ГК) рекомендуется в случае наличия противопоказаний для приема НПВП, у пожилых больных с коморбидностью или у больных, не ответивших на проводившуюся ранее терапию [27]. Несмотря на возрастающее количество доказательств эффективности ГК, особенно при ОА коленных суставов, и широкое использование ГК в клинической практике, все еще обсуждается соотношение польза/риск применения этих препаратов. Данные систематического обзора и метаанализа Honvo et al. [28] не позволяют определенно высказаться в отношении безопасности ГК (только низко- и среднемолекулярной), поэтому требуется дальнейшее накопление данных.
Опиоиды рассматриваются только как фармакологическое лечение ОА при наличии очень интенсивной боли, когда нет ответа на другие методы лечения, когда уже возникает вопрос о хирургическом лечении [27]. Систематический обзор и метаанализ, проведенный Fuggle et al. [29], подтверждают безопасность использования опиоидов при ОА, но они ассоциируются с увеличенным риском развития НЯ со стороны ЖКТ, кожи и центральной нервной системы, поэтому опиоиды рекомендуется назначать при неэффективности всех других противоболевых методов и только на короткий период времени.
При неэффективности терапевтического лечения и ухудшении качества жизни проводится оперативное лечение.
Заключение
Таким образом, обновленный алгоритм лечения больных ОА на основании принципов доказательной медицины предлагает комплексный подход к лечению ОА, с помощью системы доказательств GRADE обосновывает необходимость назначения базисной терапии препаратами SYSADOA уже на первом этапе лечения, с пошаговым назначением лекарственных препаратов, что, безусловно, будет полезным для практикующих врачей.
www.rmj.ru
Рекомендации по ведению больных остеоартрозом коленных суставов в реальной клинической практике | #01/15
Остеоартроз (ОА) представляет собой самую частую форму артрита и одну из главных причин нетрудоспособности [1]. Наиболее распространенная локализация ОА — коленные суставы, при которой наблюдается высокая частота болевого синдрома [2], поэтому эта форма ОА представляет собой хорошую модель для развития рекомендаций по лечению заболевания. И действительно, в последние 10 лет предложено множество рекомендаций, в том числе международных, созданных обществами врачей различных специальностей в разных странах. ОА, или остеоартрит, рассматривается в настоящее время не как единая болезнь, скорее как синдром, объединяющий различные фенотипические субтипы болезни, например, метаболический, возрастной, генетический, травматический и др. И хотя причины таких состояний многообразны, развитие болезни во всех случаях обусловлено клеточным стрессом и деградацией экстрацеллюлярного матрикса, которые возникают при макро- или микроповреждениях, и при этом активируются не нормальные адаптивные восстановительные ответы, включая провоспалительные пути иммунной системы, костное ремоделирование и образование остеофитов.
Несмотря на большое количество рекомендаций по лечению ОА, ведение больных до сих пор остается сложным вопросом, поскольку рекомендации часто содержат противоречивые данные. Возможное объяснение этому лежит в многообразии форм ОА, поэтому во всех метаанализах и обзорах, на основе которых создаются рекомендации по лечению ОА, констатируется высокая гетерогенность популяции больных, включенных в исследования, которая сама по себе может влиять на эффективность тех или иных средств для лечения ОА ( 1).
В последних рекомендациях Международного общества по изучению остеоартроза (The Osteoarthritis Research Society International, OARSI) 2014 г. [3] сделана попытка выделить определенные формы ОА с учетом локализации поражения и наличия коморбидности (рис. 2) и на основании такого разделения предложен дифференцированный подход к лечению (рис. 3). Однако эти рекомендации оставляют нерешенными ряд вопросов, например, при генерализованном процессе и коморбидности рекомендуется внутрисуставное (в/с) введение гормонов: в какие суставы — не понятно, ведь процесс генерализованный, а если у больного имеется сопутствующий диабет 2-го типа? Или назначение селективных нестероидных противовоспалительных препаратов (НПВП) при осложнениях со стороны сердечно-сосудистой системы и т. д. Что касается лечебных средств из группы симтоматических препаратов замедленного действия, то рекомендации еще более неопределенны. Глюкозамин и хондроитина сульфат не рекомендуется назначать для замедления сужения суставной щели, хотя существуют двойные слепые плацебо-контролируемые длительные исследования, показавшие их возможный структурно-модифицирующий эффект. Симптоматическое действие этих препаратов оценено как неопределенное, хотя размер анальгетического эффекта для хондроитина сульфата составляет от 0,13 до 0,75, для глюкозамина — от 0,17 до 0,45 [4]. По другим препаратам этой группы — рекомендации тоже неопределенные.
В июле 2014 г. [5] был предложен алгоритм ведения больных ОА коленных суставов для практики, отражающий последовательно основные принципы лечения ОА, созданный комитетом, состоящим из клиницистов и ученых разных стран, Европейского общества по клиническим и экономическим аспектам остеопороза и остеоартрита (European Society for Clinicaland Economic Aspects of Osteoporosis and Osteoarthritis, ESCEO), и учитывающий не только эффективность, но и безопасность лечебных мероприятий.
Как и во всех существующих рекомендациях, подчеркивается необходимость комбинации нефармакологических и фармакологических методов лечения ОА. Немедикаментозные методы обязательно должны включать образовательные программы, обеспечивающие больного знаниями о природе заболевания и разных методах лечения. В этих программах должна содержаться информация по изменению образа жизни: снижение избыточного веса, способы защиты или разгрузки суставов. В действительности чрезвычайно трудно убедить больного выполнять такие рекомендации, но необходимо разъяснять, что такие меры, по крайней мере, не будут вызывать усиление болей или ухудшать прогрессирование заболевания. Известно, что небольшое (до 5%) снижение веса при избыточной массе тела в большей степени улучшает функцию суставов, но не снижает выраженность боли. Основываясь на последнем качественном исследовании [6], комитет сделал заключение, что только снижение веса на 10% от первоначального вызывает значимое уменьшение симптомов ОА, более того, такая потеря веса улучшает качество и увеличивает толщину хряща медиального отдела бедренной кости [7]. Образовательные программы для больных должны содержать информацию по двигательной активности и лечебной физкультуре, поскольку эти методы (индивидуальные, групповые, занятия дома) благоприятно влияют на боль и функцию коленных суставов [8]. Убедительные данные получены по занятиям лечебной физкультурой в воде, по силовым упражнениям для нижних конечностей, тренировке квадрицепса, аэробным упражнениям, например ходьбе. И хотя четких доказательств влияния этих методов на прогрессирование ОА нет, по мнению экспертов, такие программы, лучше смешанные, должны быть обязательными для всех больных [9].
Вместе с тем использование только немедикаментозных методов после установления диагноза обычно бывает недостаточно, прежде всего, для купирования боли и улучшения функционального статуса, поэтому возникает необходимость добавления фармакологических методов лечения ОА.
Если больной испытывает боли в суставах (рис. 4), одновременно с немедикаментозными методами назначаются лекарственные средства либо в виде монотерапии, либо при недостаточной эффективности — комбинации препаратов, для более быстрого достижения удовлетворительного клинического эффекта (шаг 1). Впервые в рекомендациях обосновывается участие в лечебном процессе физиотерапевта, который оценивает функциональный статус больного, обращая особое внимание на отклонения оси суставов, поскольку варусная и вальгусная деформации являются признанными факторами риска не только развития, но и прогрессирования ОА. Использование надколенников и стелек улучшает биомеханику сустава, и, как следствие, уменьшается боль в суставах, улучшается их функция, а длительное их применение даже замедляет прогрессирование процесса [9]. Участие физиотерапевта в лечебном процессе не должно ограничиваться только первым этапом, поскольку параллельно с лекарственной терапией можно назначать и другие методы лечения для дополнительного уменьшения боли.
Одна из основных целей лечения заключается в уменьшении симптомов болезни. Практически в любых рекомендациях при небольших болях в суставах рекомендуется парацетамол в суточной дозе не больше 3,0 г из-за предположения о его большей безопасности по сравнению с другими анальгетическими средствами, несмотря на то, что он вызывает незначительное уменьшение боли. Но в последнее время безопасность такого лечения поставлена под сомнение, поскольку накопились данные о частых нежелательных лекарственных реакциях (НЛР) со стороны желудочно-кишечного тракта (ЖКТ), увеличении уровней печеночных ферментов, в США самой частой причиной лекарственного поражения печени признан парацетамол. Более безопасным было бы использование симптоматических препаратов замедленного действия (Symptomatic slow acting drugs for osteoarthritis — SYSADOA) в качестве базовой терапии с короткими курсами назначения парацетамола для быстрого обезболивающего эффекта. Последний Кохрановский обзор [11] показал, что глюкозамин (суммарно оценивались все препараты) уменьшает боль при ОА, однако отмечена высокая гетерогенность исследований, которая могла повлиять на результаты, тем более что субанализ подгрупп не выявил преимущества глюкозамина над плацебо по влиянию на боль. Вместе с тем 3 исследования продолжительностью от 6 месяцев до 3 лет у больных ОА с небольшой или умеренной болью без гетерогенности, проведенные в Европе, с применением кристаллизованного глюкозамина сульфата продемонстрировали его преимущество над плацебо по влиянию на боль (размер эффекта — 0,27 (95% CI: 0,12–0,43) [9] и функцию суставов (0,33 (95% CI: 0,17–0,48) [12], другими словами, размер эффекта оказался таким же, как при применении коротких курсов НПВП [13]. Кроме того, длительное лечение глюкозамина сульфатом задерживает прогрессирование ОА [14].
Хондроитина сульфат тоже обладает способностью замедлять прогрессирование ОА [15], кроме того, этот препарат обладает довольно выраженным действием на боль, и хотя мнения различных исследователей не всегда единодушны, размер анальгетического эффекта по некоторым данным достигает 0,75. Недавно опубликованное исследование показало эффективность хондроитина сульфата в отношении уменьшения структурных изменений в суставах с параллельным симптоматическим клинически значимым действием [16], что нашло подтверждение и в другой работе [17]. Помимо уже установленной эффективности, эти препараты обладают высокой безопасностью, частота НЛР при лечении этими средствами не отличалась от плацебо [11, 16], что тоже усиливает их роль в качестве базовой терапии ОА. Из-за предположения об аддитивном действии глюкозамин и хондроитина сульфат часто используются в комбинации. Так, в исследовании, проведенном в Америке [18], было отмечено, что комбинация глюкозамина гидрохлорида и хондроитина сульфата по анальгетическому действию превосходила плацебо у больных с умеренной и выраженной болью. В настоящее время показано, что такая комбинация имела одинаковую эффективность с целекоксибом после 6 месяцев лечения больных ОА коленных суставов с умеренными или сильными болями в суставах [19]. Представляет интерес недавно опубликованное 2-годичное исследование из Австралии, в котором продемонстрировано структурно-модифицирующее действие такой комбинации при ОА коленных суставов [20]. Структурно-модифицирующий эффект комбинации хондроитина сульфата и глюкозамина гидрохлорида подтвержден и учеными из Канады [21], когда независимо от приема анальгетиков или НПВП через 24 месяца отмечалась меньшая потеря объема хряща по сравнению с больными, не принимавшими такую комбинацию. Эффективность и безопасность применения комбинированной терапии хондроитина сульфатом и глюкозамина гидрохлоридом (Терафлекс) подтверждена и результатами исследования, проведенного в НИИР РАМН, у 50 амбулаторных больных с ОА коленных суставов. Более того, на основании годичного наблюдения 100 больных гонартрозом продемонстрировано, что интермиттирующая терапия Терафлексом (лечение — 3 месяца, 3 месяца — перерыв, 3 месяца лечения) обладает равной эффективностью с постоянным приемом препарата в течение 9 месяцев по влиянию на боль и функцию суставов [22].
Как правило, исследования по изучению так называемых препаратов замедленного действия (SYSADOA) проводятся с сопутствующей анальгетической терапией: либо парацетамол, либо НПВП, по снижению дозы которых косвенно судят о противоболевой и противовоспалительной эффективности исследуемых средств. Препараты SYSADOA обычно развивают свое действие через 4–8–12 недель от начала лечения, поэтому для купирования боли необходима обезболивающая терапия.
Прием анальгетиков и НПВП при усилении болей совместно с другими лекарственными препаратами, которые больной принимает для лечения сопутствующих заболеваний, приводит, как это наблюдается при длительном лечении многих хронических заболеваний, к снижению приверженности лечению. Известно, что повысить комплаентность можно либо изменяя схему лечения, например, уменьшая частоту приема лекарства, либо сочетая различные препараты в одной таблетке. Открытое 3-месячное рандомизированное сравнительное исследование эффективности и безопасности препарата Терафлекс Адванс, содержащего глюкозамин, хондроитина сульфат и ибупрофен, по сравнению с препаратами Терафлекс и ибупрофен у 60 пациентов с ОА коленных суставов показало, что Терафлекс Адванс, обладая хорошей переносимостью, быстрее, по сравнению с Терафлексом, уменьшает боль, скованность и улучшает функцию суставов и может быть рекомендован при ОА в первые три недели лечения с последующей заменой его на Терафлекс [23].
Доказательства по другим медленно действующим препаратам более скудны. Тем не менее, появляются препараты других групп, претендующие на роль структурно-модифицирующих средств. Например, стронций ранелат, который действует на субхондральную кость и хрящ, тем самым оказывая позитивное действие на прогрессирование ОА. Недавно проведенное высококачественное 3-годичное плацебо-контролируемое исследование установило, что стронций ранелат замедляет рентгенологическое прогрессирование ОА вместе с уменьшением симптомов заболевания [24]. Переносимость препарата в этом исследовании была хорошей, но Европейское агентство по лекарственным средствам (European Medicines Agency, ЕМА) недавно ограничило использование этого препарата, рекомендовав его применение только при тяжелом остеопорозе из-за возможного увеличения кардиоваскулярного риска, поэтому место этого препарата в лечении ОА в будущем будет нуждаться в переоценке.
Если после назначенного базового лечения больной все еще испытывает боль, можно добавлять локальные средства одновременно с немедикаментозными методами. Эффективность локальных средств установлена во многих исследованиях. Рандомизированные исследования подтвердили сходную эффективность локальных и пероральных НПВП. Локальные НПВП обладают лучшей ЖКТ-безопасностью, но чаще вызывают кожные НЛР, однако длительность исследований эффективности локальных средств, как правило, составляет в среднем только 12 недель, а длительных исследований нет для суждения о долгосрочном эффекте.
Члены комитета рекомендуют при неудовлетворительном симптоматическом эффекте переходить к следующему шагу 2. И здесь основная роль традиционно принадлежит НПВП. Известно, что и селективные, и неселективные НПВП обладают преимуществом по сравнению с парацетамолом по действию на симптомы болезни, размер эффекта на боль составляет до 0,29 (0,22–0,35) [13], т. е. в 2 раза превосходит эффект парацетамола. И действительно, больные отдают предпочтение НПВП. И хотя сравнение НПВП и глюкозамина сульфата не показало разницы в их эффективности по влиянию на боль и функцию суставов, члены комитета пришли к мнению, что НПВП нужно рекомендовать больным с выраженной болью, особенно когда SYSADOA не дают нужного эффекта. С другой стороны, при использовании SYSADOA в качестве базовой терапии они уменьшают потребность в НПВП. Недавние систематические обзоры не выявили различий по эффективности неселективных, селективных НПВП, поэтому выбор НПВП зависит от профиля безопасности препарата, сопутствующих заболеваний пациента и его состояния. ЦОГ-2 селективные НПВП ассоциируются с меньшей частотой ульцерогенного действия при коротких курсах применения, однако не ясно, как обстоят дела при длительном их применении, особенно целекоксиба и эторикоксиба. Действительно, недавно получены доказательства, что коксибы значимо увеличивают риск НЛР со стороны верхних отделов ЖКТ по сравнению с плацебо, хотя риск ниже, чем при использовании неселективных НПВП [25]. С одной стороны, при назначении неселективных НПВП требуется одновременный прием ингибиторов протонной помпы (ИПП), а с другой — принимая во внимание описанное выше и данные по затратной эффективности, члены комитета полагают, что даже у больных с нормальным риском ЖКТ-осложнений врачи должны рассматривать возможность назначения ИПП и при сочетании с селективными НПВП. У больных с высоким риском НЛР со стороны ЖКТ нужно избегать назначения неселективных НПВП, а селективные сочетать с ИПП. При сочетанном применении Аспирина со стандартными НПВП тоже увеличивается риск НЛР со стороны ЖКТ, в этом случае селективные НПВП частично улучшают толерантность со стороны ЖКТ, а сочетание их с ИПП еще больше снижает риск таких осложнений.
И стандартные, и селективные НПВП увеличивают риск серьезных осложнений со стороны сердечно-сосудистой системы, только Напроксен ассоциируется с меньшим риском тромботических кардиоваскулярных осложнений. Недавно проведенный метаанализ 638 рандомизированных исследований [25] показал, что коксибы, диклофенак и ибупрофен (в высоких дозах) увеличивали сосудистые коронарные осложнения, но не Напроксен [25], поэтому комитет рекомендует избегать назначения коксибов, диклофенака и высоких доз ибупрофена у больных с увеличенным кардиоваскулярным риском [25]. Данные более раннего метаанализа [26] показали, что среди широко применяемых НПВП Напроксен и низкие дозы ибупрофена в наименьшей степени увеличивают риск развития сердечно-сосудистых событий. Кроме того, нужно помнить, что нельзя назначать ибупрофен вместе с Аспирином из-за их фармакодинамического взаимодействия. Необходимо учитывать, что НПВП могут повышать артериальное давление, ухудшать течение сердечной недостаточности, вызывать почечную дисфункцию. НПВП нельзя назначать больным с хроническим заболеванием почек при сниженном клиренсе креатинина < 30 мл/мин.
При противопоказаниях для НПВП и продолжающемся болевом синдроме следует рассматривать вопрос о применении в/с лечения. Мнение о препаратах гиалуроновой кислоты противоречиво, однако есть данные и о позитивном эффекте этих средств при ОА коленных суставов. Данные последнего метаанализа говорят о небольшом размере эффекта, составляющем 0,34 (0,22–0,46), однако очень важно, что позитивный эффект сохраняется в течение 6 месяцев [27]. Необходимо также учитывать, что в/с введение препаратов гиалуроновой кислоты в целом безопасно, хотя и сообщается о редком развитии псевдоартрита, особенно при использовании высокомолекулярных препаратов. Кроме того, введение гиалуроната дает длительное облегчение боли по сравнению с введением стероидов и может отодвинуть необходимость эндопротезирования сустава. В недавнем исследовании показано, что гиалуроновая кислота по обезболивающему действию сходна с НПВП [28], поэтому она может быть хорошей альтернативой у пожилых больных или у больных с высоким риском НПВП-осложнений.
При наличии выпота в суставе можно применять стероиды, хотя эта рекомендация скорее теоретическая. Стероиды обладают большей эффективностью по сравнению с гиалуронатами, но только в течение первой недели после введения, и длительность такого эффекта небольшая и составляет от 1 до 3 недель [29].
Последние фармакологические попытки (шаг 3) предпринимаются у больных-кандидатов на эндопротезирование. Комитет рекомендует назначать Трамадол, но размер эффекта небольшой и часто отмечаются НЛР. При длительной хронической боли возникает центральная сенситизация, в этом случае можно использовать антидепрессанты. Результаты 2 рандомизированных плацебо-контролируемых исследований показали хороший эффект дулоксетина в течение 13 недель применения, но были отмечены частые НЛР, включая тошноту, сухость во рту и др. Для назначения этих препаратов необходимо обследование больного для выявления признаков центральной сенситизации, и в этих случаях нужно назначать дулоксетин больным с неадекватным ответом на НПВП [30].
Если болевой синдром не поддается терапевтическим воздействиям, если значительно ухудшается качество жизни, необходимо оперативное лечение.
Таким образом, предложенный алгоритм лечения больных ОА коленных суставов суммирует все используемые немедикаментозные и фармакологические методы, применяемые при лечении ОА, и основывается на имеющихся доказательствах эффективности различных методов. Алгоритм не только обосновывает мультимодальный подход к ведению больных, но предлагает последовательную схему включения различных методов, представляющую собой рекомендации для практикующих врачей разных специальностей, имеющих дело с больными ОА.
Литература
- Bijlsma J. W., Berenbaum F., Lafeber F. P. Osteoarthritis: an update with relevance for clinical practice // Lancet. 2011; 377: 2115–2126.
- Pereira D., Peleteiro B., Araújo J., Branco J., Santos R. A., Ramos E. The effect of оsteoarthritis definition on prevalence and incidence estimates: a systematic review // Osteoarthritis Cartilage. 2011; 19: 1270–1285.
- McAlindon T. E., Bannuru R. R., Sullivan M. C., Arden N. K., Berenbaum F., Bierma-Zeinstra S. M. et al. OARSI guidelines for the non-surgical management of knee osteoarthritis // Osteoarthritis Cartilage. 2014; 22: 363–388.
- Hochberg M. C., Zhan M., Langenberg P. The rate of decline of joint space width in patients with osteoarthritis of the knee: a systematic review and metaanalysis of randomized placebo-controlled trials of chondroitin sulfate // Curr Med Res Opin. 2008; 24: 3029–3035.
- Bruyère O., Cooper C., Pelletier J.-P., Branko J., Brandy M. L. et al. An algorithm recommendation for the management of knee osteoarthritis in Europe and internationally: A report from a task force of the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO) // Seminars in Arthritis and Rheumatism. 2014: 2–11.
- Messier S. P., Mihalko S. L., Legault C., Miller G. D., Nicklas B. J., DeVita P. et al. Effects of intensive diet and exercise on knee joint loads, inflammation, and clinical outcomes among overweight and obese adults with knee osteoarthritis: the IDEA randomized clinical trial // J Am Med Assoc. 2013; 310: 1263–1273.
- Anandacoomarasamy A., Leibman S., Smith G., Caterson I., Giuffre B., Fransen M. et al. Weight loss in obese people has structure-modifying effects on medial but not on lateral knee articular cartilage // Ann Rheum Dis. 2012; 71: 26–32.
- McAlindon T. E., Bannuru R. R., Sullivan M. C., Arden N. K., Berenbaum F., Bierma-Zeinstra S. M. et al. OARSI guidelines for the non-surgical management of knee osteoarthritis // Osteoarthritis Cartilage. 2014; 22: 363–388.
- Fernandes L., Hagen K. B., Bijlsma J. W., Andreassen O., Christensen P., Conaghan P. G. et al. EULAR recommendations for the non-pharmacological core management of hip and knee osteoarthritis // Ann Rheum Dis. 2013; 72: 1125–1135.
- Segal N. A. Bracing and orthoses: a review of efficacy and mechanical effects for tibiofemoral osteoarthritis // PM R. 2012; 4 (Suppl. 5): S89–96.
- Towheed T. E., Maxwell L., Anastassiades T. P., Shea B., Houpt J., Robinson V. et al. Glucosamine therapy for treating osteoarthritis // Cochrane Database Syst Rev. 2009: CD002946.
- Reginster J. Y. The efficacy of glucosamine sulfate in osteoarthritis: financial and nonfinancial conflict of interest // Arthritis Rheum. 2007; 56: 2105–2110.
- Bjordal J. M., Klovning A., Ljunggren A. E., Slordal L. Short-term efficacy of pharmacotherapeutic interventions in osteoarthritic knee pain: a metaanalysis of randomised placebo-controlled trials // Eur J Pain. 2007; 11: 125–138.
- Pavelká K., Gatterová J., Olejarová M., Machacek S., Giacovelli G., Rovati L. C. Glucosamine sulfate use and delay of progression of knee osteoarthritis: a 3-year, randomized, placebo-controlled, double-blind study // Arch Intern Med. 2002; 162: 2113–2123.
- Wildi L. M., Raynauld J. P., Martel-Pelletier J., Beaulieu A., Bessette L., Morin F. et al. Chondroitin sulphate reduces both cartilage volume loss and bone marrow lesions in knee osteoarthritis patients starting as early as 6 months after initiation of therapy: a randomised, double-blind, placebo-controlled pilot study using MRI // Ann Rheum Dis. 2011; 70: 982–989.
- Kahan A., Uebelhart D., De Vathaire F., Delmas P. D., Reginster J. Y. Long-term effects of chondroitins 4 and 6 sulfate on knee osteoarthritis: the study on osteoarthritis progression prevention, a two-year, randomized, double-blind, placebo-controlled trial // Arthritis Rheum. 2009; 60: 524–533.
- Zegels B., Crozes P., Uebelhart D., Bruyère O., Reginster J. Y. Equivalence of a single dose (1200 mg) compared to a three-time a day dose (400 mg) of chondroitin 4&6 sulfate in patients with knee osteoarthritis. Results of a randomized double blind placebo controlled study // Osteoarthritis Cartilage. 2013; 21: 22–27.
- Clegg D. O., Reda D. J., Harris C. L., Klein M. A., O’Dell J. R., Hooper M. M. et al. Glucosamine, chondroitin sulfate, and the two in combination for painful knee osteoarthritis // N Engl J Med. 2006; 354: 795–808.
- Hochbergy M. C. et al. The Multicentric Osteoarthritis interVEntion Study with Sysadoa (MOVES). MOVES Steering Committee // Osteoarthritis and Cartilage. 2014; 22: S7–S56.
- Fransen M., Agaliotis M., Nairn L. et al. Glucosamine and chondroitin for knee placebo- controlled clinical trial evaluating osteoarthritis: a double-blind randomised single and combination regimens // Ann Rheum Dis. 2014; 0: 1–8. doi: 10.1136/annrheumdis-2013–203954.
- Martel-Pelletier J., Roubille C., Abram F., CHochberg M. et al. Data from the osteoarthritis initiative progression cohort Published Online First 13 December 2013.
- Алексеева Л. И., Кашеварова Н. Г., Шарапова Е. П., Зайцева Е. М., Северинова М. В. Сравнение постоянного и интермиттирующего лечения больных остеоартрозом коленных суставов комбинированным препаратом «Терафлекс» // Научно-практическая ревматология. 2008; № 3, с. 68–72.
- Шарапова Е. П., Алексеева Л. И. Комбинированные симптоматические препараты замедленного действия в терапии остеоартроза // РМЖ. 2009. 17, № 3, с. 160–165.
- Reginster J. Y., Badurski J., Bellamy N., Bensen W., Chapurlat R., Chevalier X. et al. Efficacy and safety of strontium ranelate in the treatment of knee osteoarthritis: results of a double-blind, randomised placebo-controlled trial // Ann Rheum Dis. 2013; 72: 179–186.
- Coxib and traditional NSAID Trialists’ (CNT) Collaboration: Bhala N., Emberson J., Merhi A., Abramson S., Arber N. et al. Vascular and upper gastrointestinal effects of non-steroidal anti-inflammatory drugs: meta-analyses of individual participant data from randomised trials // Lancet. 2013; 382: 769–779.
- McGettigan P., Henry D. Cardiovascular Risk with Non-Steroidal Anti-Inflammatory Drugs: Systematic Review of Population-Based Controlled Observational Studies // PLoS Med. 2011; Vol. 8, Is. 9: e1001098.
- Bannuru R. R., Natov N. S., Dasi U. R., Schmid C. H., McAlindon T. E. Therapeutic trajectory following intra-articular hyaluronic acid injection in knee osteoarthritis — meta-analysis // Osteoarthritis Cartilage. 2011; 19: 611–619.
- Bannuru R. R., Vaysbrot E. E., Sullivan M. C., McAlindon T. E. Relative efficacy of hyaluronic acid in comparison with NSAIDs for knee osteoarthritis: a systematic review and meta-analysis // Semin Arthritis Rheum. 2013; 43: 593–599 [pii: S0049–0172 (13)00206–0].
- Bannuru R. R., Natov N. S., Obadan I. E., Price L. L., Schmid C. H., McAlindon T. E. Therapeutic trajectory of hyaluronic acid versus corticosteroids in the treatment of knee osteoarthritis: a systematic review and meta-analysis // Arthritis Rheum. 2009; 61: 1704–1711.
- Risser R. C., Hochberg M. C., Gaynor P. J., D’Souza D. N., Frakes E. P. Responsiveness of the Intermittent and Constant Osteoarthritis Pain (ICOAP) scale in a trial of duloxetine for treatment of osteoarthritis knee pain // Osteoarthritis Cartilage. 2013; 21: 691–694.
Л. И. Алексеева, доктор медицинских наук, профессор
ФГБНУ НИИР им. В. А. Насоновой МЗ РФ, Москва
Контактная информация: Alekseeva@irramn.ru
Купить номер с этой статьей в pdf
www.lvrach.ru

