Что такое резорбция костной ткани: Что такое резорбция костной ткани? — ответы врача-стоматолога НоваДент
Терапия нарушений метаболизма костной ткани | Лесняк О.М., Санникова О.Ю.
Остеопороз (ОП) – прогрессирующее системное заболевание скелета, характеризующееся снижением костной массы и нарушением микроархитектоники (качества) костной ткани, что приводит к хрупкости костей и повышению риска перелома. Важно подчеркнуть, что заболевание протекает асимптомно до тех пор, пока не случится низкоэнергетический перелом. Он – самое распространенное заболевание костной ткани: остеопоротические переломы отмечается у половины всех женщин, находящихся в периоде постменопаузы, а также у мужчин старших возрастных групп [1]. По данным Российской ассоциации по ОП, каждые 5 минут в России происходит перелом шейки бедра, вызванный ОП, а в год в нашей стране из–за него происходит 9 млн переломов периферического скелета и более 3 млн случаев переломов позвонков (www.osteoporoz.ru). Пациенты, перенесшие один остеопоротический перелом, имеют высокий риск повторных переломов. Следовательно, наиболее важной целью лечения ОП является предотвращение переломов [1].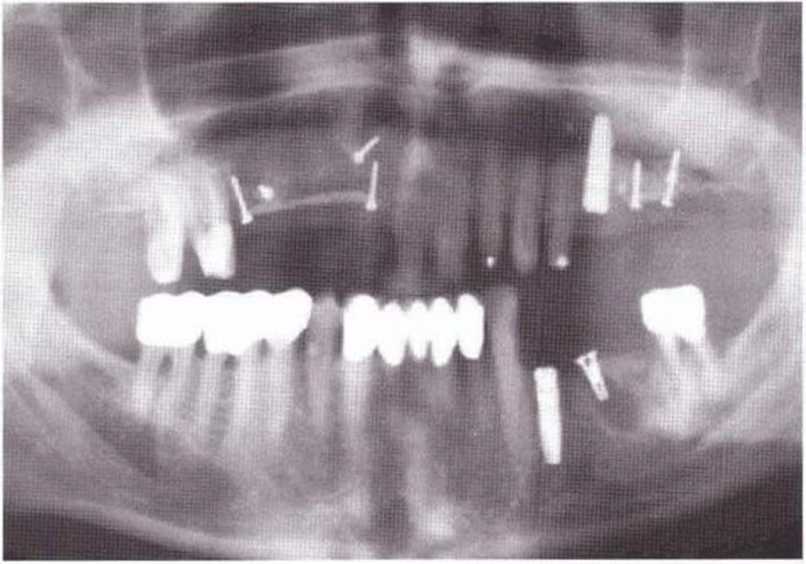

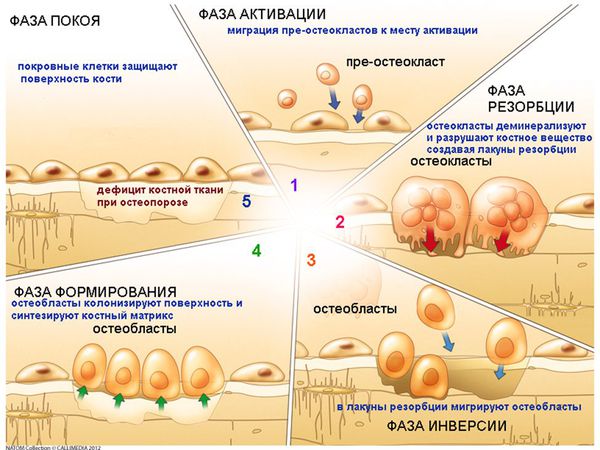
Ремоделирование выполняется двумя основными клетками костной ткани: остеокластами, резорбирующими кость, и остеобластами, формирующими новую кость. Остеокласты – многоядерные гигантские клетки, происходящие из мононуклеарных фагоцитов, продуцируемых гематопоэтической системой. Прикрепившись к кости, остеокласты начинают продуцировать множество протеолитических ферментов, разрушающих матрикс кости, а также ионы водорода, рассасывающие кристаллы гидроксиапатита. Весь процесс резорбции кости занимает обычно несколько дней.
Процесс костеобразования, продолжающийся несколько недель, выполняется остеобластами. Последние происходят из предшественников – мезенхимальных или стромальных стволовых клеток. Остеобласты значительно меньше размером, чем остеокласты, и имеют одно ядро. Они синтезируют остеоид, органический матрикс кости, и ответственны за дальнейшую его минерализацию. Примерно один из десяти остеобластов при образовании нового костного матрикса остается замурованным внутри и превращается в остеоцит.

Костное ремоделирование – гомеостатический процесс, вовлекающий повторные циклы резорбции и депозиции новой кости. В норме ежедневно в различных частях скелета работают от 2 до 5 млн единиц (мест) костного ремоделирования, каждая состоящая из нескольких остеокластов и множества остеобластов. Важно понимать, что их активности тесно связаны друг с другом: костная резорбция предшествует костеобразованию и связана с целым рядом сложнейших метаболических изменений. Предшественники остеобластов вырабатывают ряд веществ, способных связываться с рецепторами остеокластов и, как это ни парадоксально, усиливают дифференцировку и активацию остеокластов. Ведущую роль из них играют макрофаг–колониестимулирующий фактор (М–КСФ) и лиганд RANK (рецептора активации фактора NF–KB).
 Мононуклеары обеспечивают условия для работы новых остеобластов, синтезирующих компоненты органического матрикса для восстановления дефекта кости. Активация одних клеток приводит к активации других, так что количество резорбированной ткани соответствует количеству вновь образованной кости. Затем наступает период относительного покоя, сменяющийся периодом незначительной активности клеток, далее проходит новый цикл ремоделирования. Постоянный костный обмен важен для здоровья костной ткани, он предупреждает накопление старой, «усталой» кости, способствует репарации микропереломов и изменению костной архитектоники в ответ на повторные нагрузки. Не надо забывать, что кость является резервуаром кальция в организме и ремоделирование обеспечивает процесс гомеостаза кальция.
Мононуклеары обеспечивают условия для работы новых остеобластов, синтезирующих компоненты органического матрикса для восстановления дефекта кости. Активация одних клеток приводит к активации других, так что количество резорбированной ткани соответствует количеству вновь образованной кости. Затем наступает период относительного покоя, сменяющийся периодом незначительной активности клеток, далее проходит новый цикл ремоделирования. Постоянный костный обмен важен для здоровья костной ткани, он предупреждает накопление старой, «усталой» кости, способствует репарации микропереломов и изменению костной архитектоники в ответ на повторные нагрузки. Не надо забывать, что кость является резервуаром кальция в организме и ремоделирование обеспечивает процесс гомеостаза кальция. Постменопаузальный ОП характеризуется гиперактивностью остеокластов, приводящей к столь высокой скорости потери кости, что для компенсации последствий работы нескольких аномально активированных остеокластов требуется несколько месяцев деятельности многочисленных остеобластов. В связи с указанным процессом за первые 10 лет от наступления менопаузы женщина теряет 20–30% трабекулярной и 5–10% кортикальной кости. Одновременно ухудшается качество кости: уменьшается ее объем и толщина трабекул, снижается их количество. Чрезмерная резорбция костной ткани, не компенсируемая костеобразованием, лежит в основе и других костных заболеваний, таких как болезнь Педжета, метастазирование опухолей и др.
Постменопаузальный ОП характеризуется гиперактивностью остеокластов, приводящей к столь высокой скорости потери кости, что для компенсации последствий работы нескольких аномально активированных остеокластов требуется несколько месяцев деятельности многочисленных остеобластов. В связи с указанным процессом за первые 10 лет от наступления менопаузы женщина теряет 20–30% трабекулярной и 5–10% кортикальной кости. Одновременно ухудшается качество кости: уменьшается ее объем и толщина трабекул, снижается их количество. Чрезмерная резорбция костной ткани, не компенсируемая костеобразованием, лежит в основе и других костных заболеваний, таких как болезнь Педжета, метастазирование опухолей и др.Возможности медикаментозного воздействия на костную ткань в мировой медицинской литературе обсуждаются с 60–х годов XX столетия. В 1962 г. Н. Fleisch и S. Bisaz впервые высказали предположение о влиянии пирофосфата на физиологическую регуляцию процесса обмена кальция, что привело в дальнейшем к внедрению в клиническую практику целой группы фармакологических препаратов, получивших название бисфосфонатов.
Первенцем на этом пути стал этидронат. Синтезированный около 100 лет назад, он нашел применение как ингибитор коррозии или комплексный агент в различных отраслях промышленности при изготовлении тканей, минеральных удобрений, нефтепереработке. Первое описание медицинского применения бисфосфонатов опубликовано в 1969 г. в журнале «Ланцет», когда 16–месячного ребенка с оссифицирующим миозитом успешно лечили этидронатом с целью подавления внекостной оссификации. В 1972 г. была опубликована первая статья об эффективности этидроната при болезни Педжета [2].
В последующем было синтезировано второе поколение бисфосфонатов, содержащих атом азота, антирезорбтивная активность которых была существенно выше. Сейчас известно, что азотсодержащие бисфосфонаты подавляют метаболизм мевалоната и пренилирование белков, что приводит к структурным изменениям внутри остеокласта и нарушению его функции. Благодаря этому костный обмен возвращается к физиологическому уровню, наблюдавшемуся до менопаузы, и предупреждаются дальнейшая деструкция микроархитектоники и потеря кости. Обмен кости остается стабильным на протяжении длительного приема алендроната, по крайней мере в течение 10 лет. Это доказывает, что аккумуляция препарата в кости не приводит к гиперсупрессии ремоделирования.
В настоящее время в клинической практике используется несколько бисфосфонатов (алендронат, ризедронат, ибандронат, золедроновая кислота) с различными путями и режимами введения (таблетка 1 раз/нед. или 1 раз/мес., внутривенные введения раз в 3 месяца или раз в год).
Первое место по продолжительности изучения, количеству проведенных исследований и наличию серьезной и разнообразной доказательной базы эффективности и переносимости в клинической практике занимает алендронат. Лечение алендронатом эффективно уже к концу года приема у 95% пациентов [3].
Наиболее весомый вклад в проблему изучения эффективности алендроната внесли исследования FOSIT (Fosamax International Trial) и FIT (Fracture Intervention Trial), из которых известно, что МПК в области позвоночника уже к 3–му мес. лечения увеличивается на 3%. К концу 12–го мес. приема алендроната отмечено повышение МПК в поясничном отделе позвоночника на 13,7% и проксимальном отделе бедра на 5,4%. Риск новых переломов позвонков снизился на 47%, частота прогрессирования деформации позвонков – на 64%, риск болезненных переломов позвонков – на 55%.
 Продолжением исследования FIT послужило исследование FLEX по 10– либо 5–летнему приему алендроната с переводом на плацебо, показавшее снижение общего риска периферических переломов на фоне непрерывного 10–летнего лечения (частота составила 5,3% для плацебо и 2,4% для алендроната).
Продолжением исследования FIT послужило исследование FLEX по 10– либо 5–летнему приему алендроната с переводом на плацебо, показавшее снижение общего риска периферических переломов на фоне непрерывного 10–летнего лечения (частота составила 5,3% для плацебо и 2,4% для алендроната).К настоящему времени доказано, что алендронат снижает риск не только переломов позвонков, но также других типов остеопоротических переломов, включая переломы предплечья и проксимального отдела бедра. По данным мета–анализов результатов рандомизированных контролируемых испытаний, алендронат снижает относительный риск новых переломов позвонков на 48%, внепозвоночных переломов – на 49%, перелома шейки бедра – на 55%. Кроме того, алендронат эффективен при первичной профилактике переломов позвонков. Исследование FIT продемонстрировало также уменьшение боли и повышение мобильности больных постменопаузальным ОП, принимающих алендронат. Сходные результаты были обнаружены у мужчин и пациентов со стероидным ОП.
Особенности метаболизма бисфосфонатов и их прочное длительное соединение с костной тканью позволили предположить, а затем и доказать эффективность более редкого приема. Так, алендронат, принимаемый в дозе 70 мг 1 раз/нед., так же эффективен, как принимаемый ежедневно в дозе 10 мг/сут., но при этом сопровождается лучшей приверженностью пациента проводимому лечению.
В целом бисфосфонаты хорошо переносятся и побочные эффекты встречаются редко. Тем не менее пациенты должны быть проинформированы о возможных осложнениях лечения. Началу лечения должно предшествовать обследование пациента, направленное на поиск возможных противопоказаний: состояние полости рта, функциональные пробы почек и печени, общий клинический анализ крови, уровень кальция, магния, фосфора и щелочной фосфатазы в сыворотке крови.
При приеме бисфосфонатов возможна транзиторная гипокальциемя, обычно протекающая бессимптомно. Клинически значимая гипокальциемия регистрировалась при слишком быстрой внутривенной инфузии бисфосфоната и при одновременном лечении аминогликозидами.
 Индуцированная бисфосфонатами гипокальциемия также наблюдается при дефиците витамина D, поэтому для ее предупреждения лечение этими препаратами всегда сопровождается назначением холекальциферола или альфакальцидола.
Индуцированная бисфосфонатами гипокальциемия также наблюдается при дефиците витамина D, поэтому для ее предупреждения лечение этими препаратами всегда сопровождается назначением холекальциферола или альфакальцидола.При пероральном приеме бисфосфонатов отмечены случаи раздражения пищевода, обычно связанные с нарушениями инструкции по приему препарата (принимать таблетку утром с полным стаканом воды, после чего 30 мин. не принимать пищу и не ложиться). Крупное рандомизированное контролируемое испытание с участием более 20 000 пациентов продемонстрировало отсутствие разницы в частоте любых побочных эффектов, включая гастроинтестинальные, между ежедневным, еженедельным приемом алендроната и плацебо.
После внутривенной инфузии бисфосфоната у 20–40% больных регистрируется лихорадка и другие проявления гриппоподобного синдрома (головная боль, миалгии и т.д.). Обычно эта реакция начинается 10 ч спустя после инфузии и продолжается 1–2 дня. Возможно назначение симптоматической терапии, которая, однако, в большинстве случаев не требуется.
 В целом острофазовая реакция наблюдается практически только на первую инфузию и крайне редко наблюдается при повторных вливаниях.
В целом острофазовая реакция наблюдается практически только на первую инфузию и крайне редко наблюдается при повторных вливаниях. У больных с инфекцией полости рта, а также у пациентов после иплантации, экстракции зуба или другого вмешательства в полости рта возможно развитие остеонекроза челюсти на лечении бисфосфонатами, наблюдающееся крайне редко. В подавляющем большинстве описанные в литературе случаи касались пациентов с онкологическими заболеваниями, получавших длительно большие дозы внутривенных бисфосфонатов по поводу костных метастазов.
Оптимальной продолжительностью лечения бисфосфонатами считается 3–5 лет. Выделяются 3 фазы лечения: до 12 мес. – фаза репарации, от 6 до 36 мес. – фаза восстановления, 24–60 мес. – фаза поддержки костной ткани [2]. Лечение бисфосфонатами должно проводиться в непрерывном режиме на протяжении ряда лет, и это необходимо объяснять каждому пациенту, который начинает лечение. Наибольшая скорость повышения МПК наблюдается в течение первых 12 мес.
 лечения, когда лакуны резорбции начинают репарироваться и заполняются костной тканью. Во время последующих фаз повышение МПК не столь заметно, поскольку в этот период восстанавливаются структура трабекулярной ткани и ширина трабекул. Общепринято, что выраженное снижение риска перелома в течение первого года терапии бисфосфонатами обусловлено восстановлением трабекулярной сети и повышением МПК.
лечения, когда лакуны резорбции начинают репарироваться и заполняются костной тканью. Во время последующих фаз повышение МПК не столь заметно, поскольку в этот период восстанавливаются структура трабекулярной ткани и ширина трабекул. Общепринято, что выраженное снижение риска перелома в течение первого года терапии бисфосфонатами обусловлено восстановлением трабекулярной сети и повышением МПК. К настоящему времени опубликованы результаты длительных (7–10–летних) исследований по применению алендроната при постменопаузальном ОП, показавшие постоянное увеличение МПК примерно на 0,7% в год. Таким образом, за 10–летний период плотности кости в области позвоночника увеличивается на 13,7%, в области шейки бедра – на 6,7%. Это свидетельствует о том, что позитивный баланс при костном ремоделировании сохраняется на всем протяжении длительного лечения. При этом показано отсутствие значимых нарушений минерализации скелета. Биопсии костной ткани, проведенные через 7 лет после начала терапии, показали, что строение трабекул не нарушается, микропереломы не обнаруживаются, а количество нормальных кристаллов гидроксиапатита увеличивается, свидетельствуя о том, что кость становится более устойчивой к компрессии.
Показателем эффективности применения бисфосфонатов является снижение концентрации маркеров костной резорбции в сыворотке крови пациента, наблюдаемое уже через 3–6 нед. лечения. Если к концу 2–3–го мес. терапии не произошло снижения маркеров на 30–40%, следует задуматься, принимает ли пациент препарат и правильно ли он это делает. Денситометрия при приеме бисфосфонатов проводится раз в год. Интересно, что в крупных многоцентровых исследованиях бисфосфонатов было показано снижение риска переломов даже в отсутствие повышения МПК.
В последние годы на рынке появились дженерики бисфосфонатов, в частности алендроната. Для широкого внедрения в клиническую практику важно знать, были ли проведены исследования на биоэквивалентность дженерического препарата и оригинального средства.
В 2003 г. было проведено исследование биоэквивалентности Теваната оригинальному препарату, целью которого является сравнение фармакокинетических параметров Теваната и оригинального препарата (Фосамакс).
Таким образом, хорошо изученный механизм действия бисфосфонатов наряду с опытом длительного лечения тысяч пациентов с ОП в контролируемых испытаниях свидетельствуют об их положительном влиянии на здоровье костной ткани. Они снижают скорость обмена костной ткани и повышают МПК. Эти изменения ассоциируются с достоверным статистически значимым снижением риска переломов позвонков и переломов периферического скелета. Данные клинических испытаний продолжительностью до 10 лет продемонстрировали сохраняющуюся эффективность и хорошую переносимость алендроната. Более редкий режим приема обеспечивает больных более удобной формой приема при сохраненной эффективности.
Азотсодержащие бисфосфонаты включены во все зарубежные клинические рекомендации по ОП, а также наряду со стронция ранелатом названы препаратами первой линии в лечении постменопаузального ОП в «Российских клинических рекомендациях по диагностике и лечению ОП» [5]. Алендронат также эффективен при ОП у мужчин, стероидном ОП и в качестве средства первичной профилактики ОП.
Литература
1. The living skeleton. Ed. Ch. Roux. Wolters Kluwer Health 2007; 113pp.
2. Bartl R., Frisch B., von Tresckow E., Bartl C. Bisphosphonates in Medical Practice. Springer 2007; 265 pp.
3. Hochberg M.C., Rizzoli R. Long–term experience with alendronate in the treatment of osteoporosis. Expert Opin. Pharmacother. 2006; 7(9): 1201–1210.
4. MDS Pharma Services Canada 2003. Report AA 03870.
5. Остеопороз/под ред. О.М.Лесняк, Л.И.Беневоленской.– 2–е изд., перераб. и доп. – М.: ГЭОТАР–Медиа, 2010.– 272 с. – (Серия «Клинические рекомендации»).
.
Резорбция костной ткани зуба – лечение, симптомы, цены
Резорбция костной ткани – это естественный процесс, который начинается с возрастом у каждого человека. В год теряется около 1-2% костной ткани, и это считается нормальным, но при сильной атрофии возможны серьезные заболевания (в частности, остеопороз). Помимо возраста, существует и целый ряд других факторов, влияющих на этот процесс. Например, в группу риска входят курящие люди, у которых риск атрофии костной ткани намного выше. Индивидуальные особенности во многом определяют и то, насколько интенсивно происходит рассасывание костной ткани челюсти.
Причины атрофии костной тканиГлавной причиной, как уже было отмечено, является отсутствие нагрузки на ткани. Они не получают давления и перестают полноценно насыщаться питательными веществами, в результате чего кость постепенно истончается. Среди других провоцирующих факторов выделяют:
- Наследственные и воспалительные заболевания (пародонтоз, гранулемы).
- Естественные возрастные изменения в организме.
- Механические травмы челюсти.
- Индивидуальные особенности строения зубного ряда.
Вследствие атрофии костной ткани и отсутствия зубов нарушается жевательная функция, что может привести к болезням пищеварительной системы. Происходит смещение зубов, ухудшение внешнего вида зубного ряда и нарушение дикции. В запущенных случаях внешне меняются контуры лица, кожа становится дряблой и появляются другие признаки старения.
Чтобы получить информацию о ценах и сроках лечения звоните:
+7 (495) 788-48-84
или заполните форму обратной связи:
Причины резорбции
Из-за недостаточной нагрузки в местах отсутствующих зубов костная ткань начинает уменьшаться в объеме. Это особенно выражено при отсутствии фронтальных зубов, так как кость в этой области тонкая и рассасывается очень быстро. При потере других зубов процесс также необратим, если вовремя не заняться протезированием зубов. Длительное отсутствие последних зубов может не только осложнять пережевывание пищи, но и влиять на овал лица из-за сильной атрофии кости. Аналогичное можно сказать и о потере зубов в боковых отделах, из-за чего начинается провисание кожи лица. Даже установка мостов не позволяет избежать резорбции, так как десна по истечении времени начинает проседать. Более того, считается, что протезирование на мостовидных протезах только усугубляет этот процесс.
В некоторых случаях атрофия начинает прогрессировать и после установки имплантата, причем в каждом конкретном случае это индивидуально. У одних людей процесс может начаться по истечении нескольких лет, а у других – спустя месяц после выполненной процедуры. При одномоментной имплантации (вживление корня в лунку удаленного зуба) кость еще не успевает атрофироваться, поэтому с этой точки зрения экспресс-имплантация имеет принципиальное преимущество. Диагностируется резорбция с помощью ортопантомограмм и компьютерной томографии, а ее величину можно определить по глубине десневых карманов. Горизонтальная равномерная резорбция в пределах 1 мм считается нормальным явлением, но при неравномерной или вертикальной резорбции, а также глубоких десневых карманах можно говорить о неблагоприятном течении послеоперационного периода.
Причинами атрофии костной ткани могут стать несколько факторов – от непрофессионально выполненной процедуры до индивидуальных особенностей. На развитие этого процесса влияет, в частности, поверхность имплантата и негерметичность соединения между корнем и абатментом, а также появившаяся микроподвижность. Имеет значение также качество установки ортопедической конструкции и соблюдение пациентом правил гигиены полости рта. Резорбция костной ткани вокруг установленного титанового стержня может привести к таким серьезным последствиям, как потеря имплантата. В нашей клинике имплантацию выполняют опытнейшие хирурги, поэтому врачебные ошибки исключены. Однако полностью застраховаться от резорбции невозможно, поэтому после имплантации следует посещать врача для контроля состояния тканей вокруг имплантата.
Как предотвратить резорбцию костной тканиСамым эффективным способом предотвратить рассасывание костной ткани и восстановить утраченный зуб является своевременно выполненная имплантация. В этом случае в кость вживляется искусственный корень, который и передает ей жевательную нагрузку. Однако при сильной атрофии становится проблематично установить импланты зубов нужной длины и обеспечение его стабильности. По этой причине до процедуры установки имплантата дополнительно выполняется наращивание кости для получения необходимой высоты и плотности. Выполняется это несколькими способами, один из которых – направленная регенерация тканей. Данный метод предполагает использование синтетических или природных костных материалов и специальных мембран. Для верхней челюсти выполняется синус-лифтинг, в процессе которого приподнимается гайморова пазуха и в образовавшуюся полость внедряется костный материал.
Что такое резорбция кости? – Эстетика Москва
Записаться на приёмРассасывание костной ткани – естественный процесс, с которым сталкиваются многие люди. Ежегодно объем челюстной кости уменьшается на 1-2%, но это не считается патологией. При значительной атрофии у пациентов развиваются сопутствующие заболевания, которые часто приводят к осложнениям.
Особенно активно резорбция протекает на фоне удаления одного или нескольких зубов. При отсутствии нагрузки костная ткань подвергается сильной дистрофии, что в ряде случаев приводит к эстетическому дефекту и другим последствиям. Например, имплантация челюсти при полном отсутствии зубов будет весьма затруднительна, поскольку недостаточный объем кости может нарушить процесс приживления штифта. Чтобы операция увенчалась успехом, придется предварительно провести остеопластику.
Этиология и диагностика
Костная ткань обновляется за счет ремоделирования, поэтому процесс резорбции – это неотъемлемая часть жизненного цикла кости. В юном возрасте остеогенез преобладает над резорбцией, что способствует нормальному росту костной ткани. Однако в преклонном возрасте доминируют разрушительные процессы, которые приводят к развитию остеопороза.
Повышенная атрофия кости возникает на фоне заболеваний почек, органов ЖКТ, крови, а также нарушения метаболических процессов, эндокринных, генетических, ревматических болезней. У некоторых пациентов процесс рассасывания ткани протекает более агрессивно на фоне приема медикаментов.
Чтобы диагностировать заболевание и оценить степень дистрофии костной ткани, пациенту назначают комплексное обследование, которое включает:
- Лабораторные исследования с оценкой гормональных показателей и минерального обмена. Самым показательным методом диагностики резорбции являются биохимические маркеры, которые указывают на насыщенность крови минералами и микроэлементами, участвующими в образовании скелета.
- Лучевая диагностика (радиография, остеоденситометрия, рентген). На ранних стадиях дистрофии кости визуальные методы диагностики малоэффективны. Наиболее информативным методом оценки состояния костной ткани на этом этапе считается компьютерная томография.
Всестороннее диагностическое исследование поможет четко определить состояние кости и оценить степень атрофии.
Последствия резорбции
Дефицит кости – это глобальная проблема, которая постепенно усиливается и вызывает необратимые последствия:
- Изменение расположения зубов. Смещение единиц зубного ряда приводит к изменению прикуса, повышению риска развития кариеса, нарушению жевательной функции, проблемам с ЖКТ.
- Изменение формы лица. Сокращение объема кости в корне меняет черты лица. В зависимости от локализации дефекта, у пациентов западают губы, щеки, визуально укорачивается челюсть и т.д. Лицо быстро покрывается морщинами.
- Невозможность имплантации зубов. В 35% случаев без проведения реконструктивной операции по увеличению объема кости имплантация при полном отсутствии зубовневозможна.
Как предотвратить резорбцию?
Своевременное восстановление утраченных зубов – один из наиболее эффективных методов профилактики дистрофии челюстной кости. Имплантация позволяет восстановить эстетику и физиологию зубов, что в свою очередь положительно отражается на состоянии костной ткани. Однако при сильном дефиците костной ткани установка имплантатов часто становится затруднительной. В этом случае для получения нужной высоты и ширины костная ткань подвергается пластике.
Успешные операции по восполнению объема челюстной кости проводят врачи клиники «Эстетика». Мы используем качественные костные трансплантаты с высокой биологической совместимостью. Все манипуляции проводятся при помощи стерильных инструментов, которые проходят тщательную дезинфекцию в автоклаве. В нашей клинике применяется практика малоинвазивного вмешательства, позволяющая провести манипуляции с комфортом для пациента и сократить период восстановления.
Публикуемые на сайте статьи носят информационный характер, и описанные услуги могут не соответствовать перечню услуг, оказываемых в стоматологической клинике. Наличие и стоимость процедур уточняйте у администратора.
Что такое резорбция костной ткани|Стоматология Калининского района
Резорбция вследствие удаления зубов
После удаления зуба или нескольких рядом стоящих зубов на челюсти образуется участок адентии. В зоне адентии начинается процесс атрофии кости. Многие пациенты стоматологических клиник, если бы их заранее предупредили о том, что после установки съемных и несъемных протезов атрофия костной ткани будет продолжаться, они бы выбрали другой способ лечения и протезирования зубов. Резорбция кости, ее еще называют атрофией, убылью кости, дистрофией, процесс необратимый, но его можно предотвратить, если выбрать верную методику протезирования зубов.
В клинике «Нурдент» в Калининском районе стоматологи рекомендуют своим пациентам в самый короткий промежуток времени после удаления зуба начать операцию по имплантации зубов, чтобы процесс резорбции кости не зашел слишком далеко. В нашей стоматологии у метро «Гражданский проспект» работают опытные стоматологи-ортопеды, готовые помочь пациенту принять правильное решение о выборе способа протезирования зубов.
Причина атрофии кости
Организм человека устроен таким образом, что самостоятельно начинает избавляться от тех его частей, которые утратили функциональность. Таким образом, после удаления зуба кость челюсти перестает выполнять свою функцию поддержки зубного корня и начинает рассасываться. Процесс происходит аналогично тому, как атрофируются и убывают мышцы, если нагрузка на них сводится к нулю.
Способы предотвращения дистрофии кости
Чтобы остановить процесс резорбции, необходимо дать организму понять, что корень зуба вернулся на свое место. Это можно сделать единственным способом: провести операцию имплантации зубов, установив на место отсутствующего корня титановый имплантат. Имплантат, заменяя корень зуба, берет на себя его функцию и производит стимуляцию кости челюсти, останавливая резорбцию кости, которая неизбежно начинается после утраты зуба. Имплантаты позволяют восстановить функциональность зуба, обеспечивая естественный процесс пережевывания пищи. Видимая часть зуба заменяется абатментом, который служит опорой для коронки.
Чем опасна резорбция кости фронтальной зоны челюсти
Зона, где находятся резцы, представляет собой очень тонкую кость, дистрофия которой происходит очень быстро. Даже если поставить мостовидный протез, используя в качестве опоры «моста», например, клыки, через некоторое время десна начнет проваливаться из-за убыли кости, и зубы визуально потеряют опору. Если же утраченные резцы восстанавливаются в результате имплантации, заменяющий корень имплантат как будто дает команду организму, что зуб находится на своем месте, и резорбция не нужна.
Атрофия кости боковых зон челюсти
При утрате моляров наблюдается такой косметический дефект, как проваливание кожи лица вследствие убыли костной ткани. Еще одним неприятным осложнением можно считать изменение прикуса: в передней зоне челюсти зубы начинают «разъезжаться», изменяется высота лица за счет уменьшения высоты костей челюстей. Мостовидный съемный протез, установленный в боковой зоне челюсти, не только не останавливает процесс резорбции кости, но и ускоряет его. Это связано с тем, что во время жевания протез давит на десну. Чтобы исключить сильное давления «моста», протезирование нужно проводить при помощи мостовидного протеза, устанавливаемого на имплантаты. Так можно остановить изменение прикуса и исключить риск «проваливания» лица.
Полная адентия
При утрате всех зубов процесс резорбции ускоряется в разы. А кроме того происходит изменение строения челюстей: мышцы несколько изменяют места прикрепления к кости. Начинается неестественное западание губ, появляются морщины. Изменение строения челюстей приводит к нарушению жевательной функции, что негативно сказывается на здоровье всего организма, так как человек не может полноценно питаться. Вследствие нарушения пережевывания пищи, изменяется процесс ее переваривания. Вот такая прямая взаимосвязь между отсутствием зубов и здоровьем человека в целом.
При полной адентии некоторые пациенты выбирают съемные протезы на обе челюсти. Но так как протезы не останавливают процесс резорбции кости и даже ускоряют его, через некоторое время приходится корректировать размер протеза, изменяя его толщину, чтобы таким образом компенсировать утрату костной ткани. Однако, если установить съемный мостовидный протез с опорой на имплантаты, костный гребень десны сохраняется, так как давление «моста» на десны исключается. В отсутствии корней зубов резорбция продолжается, но ее скорость замедляется.
Особенности диагностики и лечения заболеваний, сопровождающихся резорбцией костных структур
Peculiarities of diagnostics and treatment of diseases, accompanied by resorption of bone structures
И. К. Луцкая
д. м. н., профессор, заведующая кафедрой терапевтической стоматологии БелМАПО
А. О. Коржев
врач стоматолог-хирург УЗ «8-я городская клиническая стоматологическая поликлиника» г. Минска
А. А. Есьман
главный врач УЗ «8-я городская клиническая стоматологическая поликлиника» г. Минска
Основной объем работы хирурга-стоматолога на амбулаторном приеме занимают операции удаления зуба. На следующем месте по частоте стоят хирургические вмешательства на пародонте, цистотомия. В настоящее время расширяются показания к установке внутрикостных имплантатов с последующим протезированием. При этом одной из серьезных проблем, с которыми сталкиваются специалисты, является резорбция костной ткани на фоне воспалительного процесса, осложнений ранее выполненного лечения зубов или после оперативного вмешательства [3, 7]. В качестве примера можно рассматривать первичное образование кистозной полости в области корня или вторичное рассасывание альвеолярной кости после удаления зуба.
Одним из наиболее распространенных методов диагностики большинства заболеваний зубов и челюстей человека является рентгенологическое обследование пациента. Достижения стоматологии в последнее десятилетие ознаменовались не только появлением новых способов лечения и профилактики, но и развитием рентгеновской техники, разработкой новых методик рентгенографии [6]. Это закономерно вызвало повышение частоты использования и расширение спектра рентгенологических исследований зубочелюстной системы.
При осложненном кариесе рентгенологические исследования необходимы для определения характера и распространенности поражения периапикальных тканей, осуществляется точная диагностика заболеваний тканей пародонта. При травматических повреждениях, опухолях, опухолеподобных заболеваниях, кистах, деформациях и системных поражениях костей черепа рентгенологическое исследование является ведущим способом первичной диагностики и оценки эффективности лечебных мероприятий, своевременного выявления осложнений [3, 4].
На рентгенограммах кости лицевого скелета, челюстей имеют характерную структуру, так называемый костный рисунок, который отображает особенности функции и анатомического строения. Патологические процессы приводят к изменению костного рисунка, что позволяет врачу-стоматологу диагностировать различные заболевания.
Так, остеопороз — дистрофический процесс, в основе которого лежит уменьшение и замещение костной ткани остеоидным веществом, жировой тканью, кровью. При остеопорозе снижается количество костных балочек в единице объема кости, они истончаются, костномозговые пространства расширяются.
По характеру теней на рентгенограмме остеопороз делят на очаговый и диффузный. Первый представлен отдельными, размером от 1 до 5 мм, очагами разрежения костной ткани с четкими или нечеткими контурами и предшествует секвестрации при остеомиелите кости. Для диффузного остеопороза характерно равномерное разрежение костной ткани, кортикальный слой кости истончен, иногда разволокнен, костномозговые пространства расширены. Такой вид остеопороза встречается после утраты зубов.
Деструкция — разрушение кости и замещение ее патологической тканью (гноем, грануляциями и т. д.). На рентгенограмме очаг деструкции имеет меньшую плотность по сравнению с рядом расположенными неизмененными участками.
Деструктивные изменения костного вещества чаще всего наблюдаются при воспалительных и опухолевых поражениях костей. Разрушение идет, с одной стороны, путем рассасывания костных балок и трабекул в результате непосредственного воздействия патологического процесса (гнойное воспаление, распад, некроз, прорастание опухолевой тканью и др.), а с другой — рефлекторным нейрогуморальным путем. При этом костномозговые пространства сливаются и увеличиваются в объеме.
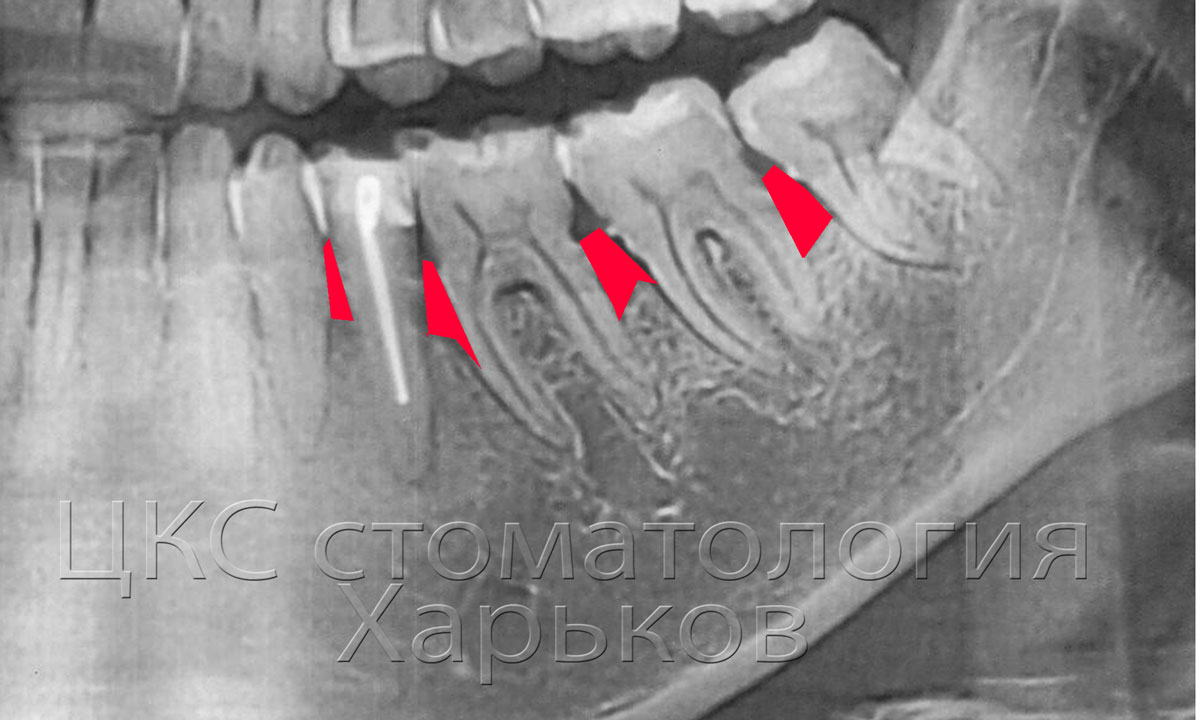
Резорбция — рассасывание костных структур или дентина, в том числе верхушек корней, которое может носить физиологический характер (корни временных зубов) или являться следствием патологического процесса. Если на рентгенограмме в области верхушки корня обнаруживается деструктивный очаг с лучше или хуже очерченными контурами, это может быть обусловлено различными стадиями гранулирующего, гранулематозного и фиброзного периодонтита. Рентгеновское изображение кисты, находящейся в процессе формирования, вначале может не отличаться от других стадий развития хронического периодонтита. Дальнейшее формирование кисты приводит к увеличению размеров. При рентгенологическом исследовании в области верхушки корня зуба обнаруживается очаг просветления, имеющий шаровидную форму. Границы этой полости гладкие и четко очерченные. Нередко вокруг полости образуется тонкий склеротический ободок.
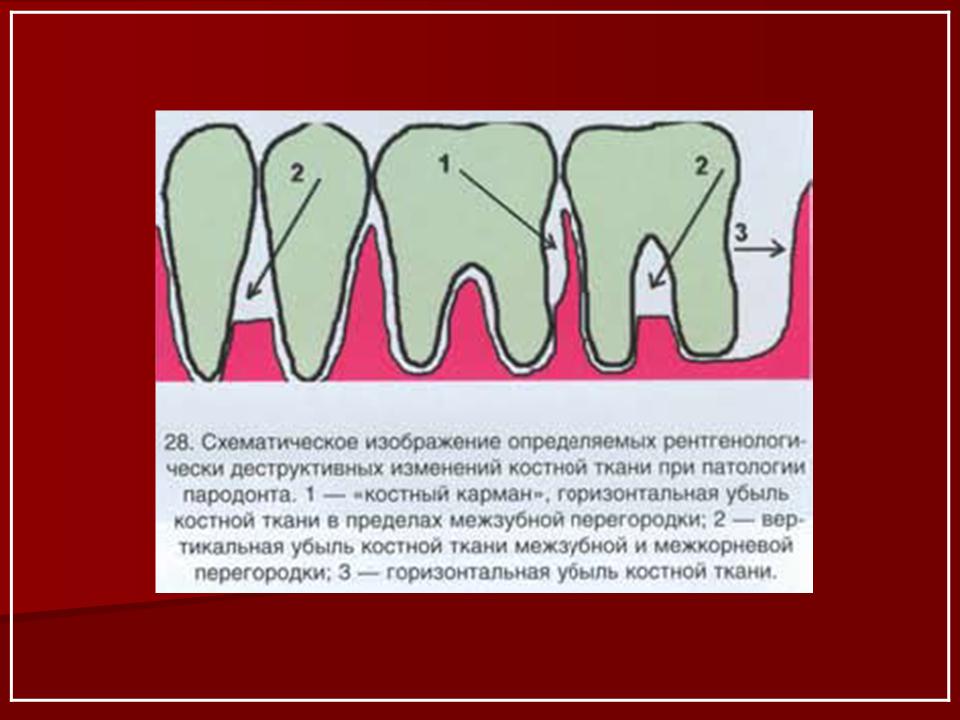
При тяжелом течении пародонтита на рентгенограмме определяются значительные по площади участки просветления, характеризующие убыль костной ткани более 1/2 длины корня у многих зубов, иногда полное рассасывание межзубной перегородки и выраженные изменения в области фуркации корней. Вертикальная резорбция приводит к образованию глубоких костных карманов вдоль зубного ряда [3, 6].
Среди оперативных методов лечения особое место занимает реконструктивная хирургия с использованием остеозамещающих материалов, которые способствуют восстановлению костной ткани и активизируют процессы регенерации тканей живого организма [1, 2, 5].
Репаративная регенерация костной ткани как биологический процесс генетически предрасположенна, процесс нельзя ускорить [5]. Однако существуют факторы регенерации, на которые можно оказывать оптимизирующее воздействие, поэтому возрастает роль средств, обладающих положительным влиянием на остеогенез. Термин «направленная регенерация кости», предложенный Д. Басером, определяет принцип создания благоприятных условий для развития костных клеток между дефектом кости и окружающими мягкими тканями для предотвращения проникновения в область остеорепарации эпителия. По данным литературы, при обеспечении наиболее благоприятных условий особого внимания заслуживают средства, способствующие образованию костной ткани и ее обызвествлению. С этой целью используют барьерные мембраны в сочетании с остеопластическим материалом, что должно обеспечивать реализацию тех способностей, которыми изначально обладает костная ткань [5, 7].
Большой интерес вызывают кальцийфосфатные соединения (гидроксиапатит), как материал, наиболее близкий по составу костной ткани, минеральному компоненту и твердым тканям зуба.
В настоящее время выпуск препаратов на основе гидроксиапатита освоен многими производителями: в России («Остим-100», «Колапол», «Гидроксиапол» и «Коллапан»), в Республике Беларусь («КАФАМ», гель гидроксиапатита). Материалы применяются с различными типами антибиотиков и антисептиков, не требуют специального инструментария и оборудования, изготавливаются в различных формах (блоки, пластины, гранулы, порошки, суспензии). Все типы гидроксиапатита используются при хирургическом лечении различных стоматологических заболеваний.
Средство на основе нанокристаллического гидроксиапатита (кальция фосфата) предназначено для имплантации в костную ткань с целью активации остеорепаративных процессов, обладает повышенной способностью трансформироваться в биологических средах в ионы кальция и фосфаты, что обеспечивает лучшее усвоение указанных ионов непосредственно в «зоне интереса» — костной ране (зона между отломками при переломах, костный дефект, секвестральная полость и т. д.).
Кальций снижает проницаемость клеточных мембран и сосудистой стенки, предотвращает развитие воспалительных реакций. Ионы кальция участвуют в передаче нервных импульсов, в свертывании крови и других физиологических процессах.
Гидроксиапатит способствует оптимизации заживления костной раны, формированию функционально и структурно полноценного остеорегенерата по типу первичного заживления костной раны. Применение препарата позволяет уменьшить длительность болевого периода у пациентов после операции и способствует скорейшей ликвидации отека мягких тканей в этой зоне. Гидроксиапатит характеризуется низкой растворимостью в биологических средах и медленным поступлением ионов кальция в межуточную среду и кровь.
Применение в стоматологии:
- при открытом (осложненном) переломе челюстной кости — непосредственно в костную рану в объеме, адекватном межотломковому пространству;
- при образовании костных дефектов челюстных костей после удаления доброкачественных новообразований — непосредственно в костную рану в объеме, адекватном костному дефекту;
- при образовании вертикальных костных дефектов в области альвеолы челюстной кости при проведении радикальных операций на тканях пародонта — после удаления из костного кармана патологических тканей, обработки костного кармана перед зашиванием операционной раны;
- при хроническом посттравматическом остеомиелите челюстей после удаления секвестров в условиях иммобилизации — непосредственно в секвестральную полость (полость дефекта) в объеме, адекватном костному дефекту.
- заполнение костных дефектов после оперативного вмешательства по поводу удаления зуба, цистэктомии, резекции верхушки корня (рис. 1, 2).
Рис. 1. Радикулярная киста верхней челюсти. КЛКТ-исследование.
Рис. 2. Рентгенограмма моляра после резекции верхушки корня.
Примером препаратов на основе гидроксиапатита может служить «Коллапан» — препарат, применяемый для восстановления костной ткани, профилактики и лечения гнойных осложнений. Состоит из гидроксилапатита и коллагена. Полностью замещается костной тканью, сохраняет антимикробную активность в ране до 20 суток, в течение которых происходит равномерное выделение антибиотика в костной полости [2].
Выпускается в виде гранул, геля, пластин: различный вид материала обусловлен удобством заполнения костных дефектов различной формы и расположения.
Выбор вида препарата зависит от возбудителя заболевания. Наличие в материале антимикробных средств различного спектра действия позволяет целенаправленно выбрать вид «Коллапана», соответствующий возбудителю заболевания, что значительно повышает эффективность лечения.
«Коллапан» не вызывает отторжения, нагноения, аллергических реакций. Противопоказанием к применению является индивидуальная непереносимость антибиотика, входящего в состав препарата.
В зависимости от формы заполняемого дефекта возможно как изолированное, так и сочетанное применение гранул, пластин, геля. Пластины легко режутся ножницами, скальпелем. Гель вводится при необходимости создания более полного контакта гранул и пластин с костной тканью. Применяют при пародонтите, удалении зуба, резекции верхушки корня, дентальной имплантации, периимплантитах, софт-синус-лифтинге, хронических периодонтитах, перфорациях зоны бифуркации, альвеолитах.
Клинический случай № 1
Операция удаления зубов с предварительным иссечением эпителиального края десны.
При помощи глазного скальпеля производили разрезы вдоль маргинальной десны с вестибулярной и оральной поверхности таким образом, чтобы со стороны костных карманов разрез проходил ниже маргинальной части десны на 1—2 мм; со стороны сохранившейся альвеолярной кости разрез выполнялся максимально близко к краю десны.
Вглубь тканей разрез выполнялся под углом от края десны до уровня дна зубодесневого кармана и распространялся вплоть до цемента корня, что позволяло произвести иссечение эпителия вдоль края десны, патологических грануляций в кармане и поддесневых зубных отложений.
Осуществлялся гемостаз, и сразу же выполнялась операция удаления подвижных зубов. При наложении щипцов захватывались ткани, иссеченные с оральной и язычной сторон зуба (рис. 3, 4). Костный дефект заполнялся препаратом, содержащим остеопластическую основу и отвечающим основным требованиям: химически устойчив в физиологической среде организма, проявляет стойкость к окислению, не допускает накопления вредных продуктов взаимодействия, не вызывает гальваноэлектрических явлений. Указанным требованиям в значительной степени удовлетворяют препараты, содержащие гидроксиапатит [Са10(РО4)6(ОН)2] с соотношением Са/Р 1,67, который является аналогом неорганической составляющей костной и зубной тканей организма.
Рис. 3. Лунка удаленного зуба заполнена остеопластическим материалом.
Рис. 4. Раневая поверхность после удаления группы зубов.
Рана ушивалась таким образом, чтобы более подвижный лоскут перекрывал лунку зуба. После завершения регенерации в челюстную кость были установлены имплантаты (рис. 5, 6).
Рис. 5. Внутрикостные имплантаты.
Рис. 6. Нормальная структура кости в области имплантатов. Рентгенограмма.
Клинический случай № 2
Органосберегающая операция с цементотомией при локализованном пародонтите.
Осуществлялось обезболивание соответствующего участка челюсти, выполнялся разрез в межзубном пространстве параллельно основанию сосочка между проксимальными сторонами зубов. Рассечение межзубных мягких тканей производили на участке зубного ряда, превышающем область намеченного вмешательства на 1—2 зуба с каждой стороны, и дополняли разрезом, позволяющим углубить преддверие полости рта. Затем поочередно с каждой стороны отслаивали лоскуты с обеих сторон альвеолярного отростка и отводили на расстояние, обеспечивающее свободное манипулирование в операционном поле.
Удаление грануляций и вегетации эпителия скальпелем начинали с апикальных частей поверхности лоскутов. Далее приступали к удалению грануляций, прилежащих к зубу и альвеолярной кости, инструментами для снятия зубного камня и малыми кюретажными ложками. Острые костные выступы на альвеолярном отростке сошлифовывали алмазной головкой.
Обработку корней недепульпированных зубов проводили, соскабливая острыми инструментами (экскаватор, различные по форме острые крючки) поверхностные отложения зубного камня вместе с грануляциями и некротизированными тканями на поверхности цемента. Корни депульпированных зубов подвергали цементотомии удлиненным бором с затупленной и отполированной торцевой частью, удерживая его под различными углами относительно поверхности корня зуба.
Рану тщательно промывали растворами антисептиков. Костные карманы заполняли препаратом гидроксиапатита с коллагеном. Швы накладывали из кетгута с удлиненным сроком рассасывания. Даны рекомендации по уходу за раной. Осуществляется послеоперационное наблюдение.
Клинический случай № 3
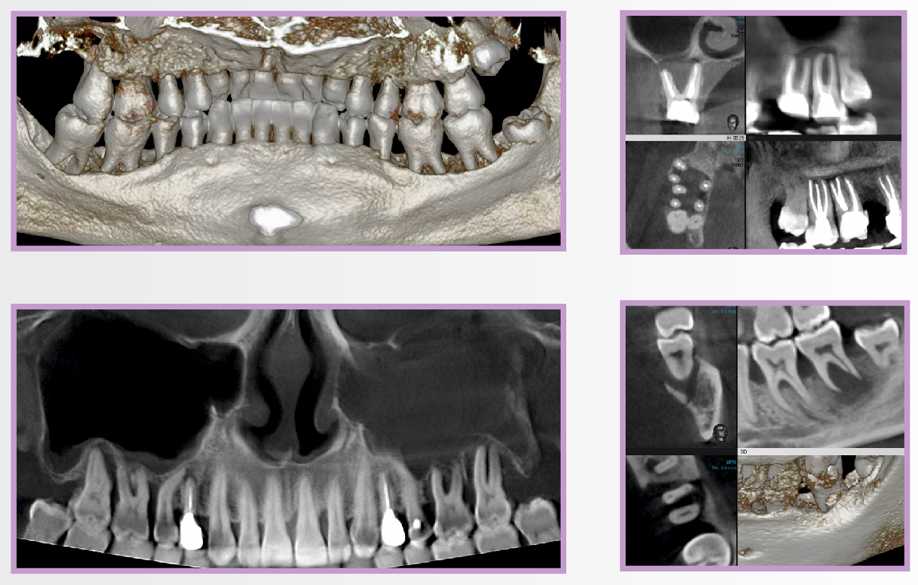
Пациент Ш., 34 лет. Диагноз: радикулярная киста верхней челюсти слева в области зубов 22 и 23 (рис. 7). Под местной анестезией проведено удаление зубов с цистэктомией (рис. 8). Тщательно обработаны стенки полости, выполнен гемостаз (рис. 9). Полость кисты рыхло заполнена препаратом на основе гидроксиапатита. Рана ушита кетгутом, сделаны назначения для выполнения в домашних условиях. Послеоперационный период протекает без осложнений.
Рис. 7. КЛКТ-снимок. Киста в области верхней челюсти слева.
Рис. 8. Удалены зубы. Сделана цистэктомия.
Рис. 9. Гемостаз после операции цистэктомии.
Заключение
Воспалительные процессы в челюстно-лицевой области нередко сопровождаются деструкцией костной ткани, выражающейся рассасыванием костных балочек и замещением их продуктами патологического распада или вновь образованной грануляционной тканью. Диагностика подобных изменений осуществляется (или уточняется) на основании рентгенологического исследования костей лицевого черепа. На рентгеновском снимке обнаруживаются участки просветления, соответствующие определенной клинической картине. Эффективность лечения заболеваний, проявляющихся резорбцией костных структур, существенно повышается при местном использовании препаратов, обладающих остеотропным воздействием, прежде всего, на основе гидроксиапатита.
Сведения об авторах/Литература- Луцкая Ирина Константиновна, д. м. н., профессор, заведующая кафедрой терапевтической стоматологии БелМАПО, Беларусь, Минск
д. м. н., профессор, заведующая кафедрой терапевтической стоматологии БелМАПО, Беларусь, Минск
Lutskaya I.K., dms, professor, Head of the Department of Therapeutic Dentistry Belorussian Medical Academy of Postgraduate Education, Belarus, Minsk
Коржев Алексей Олегович, врач стоматолог-хирург, УЗ «8-я городская клиническая стоматологическая поликлиника» г. Минска, Беларусь, Минск
Korzhev A. O., 8th city clinical dental clinic, Belarus, Minsk
Есьман Андрей Алексеевич, главный врач, УЗ «8-я городская клиническая стоматологическая поликлиника» г. Минска, Беларусь, Минск
Esman A.A., 8th city clinical dental clinic, Belarus, Minsk
УДК 616.716-003.95-07-08
220040, Минск, ул. Сурганова, 70—71
Тел. +375 29 631-65-28
e-mail: [email protected]
Аннотация. В статье приводятся сведения, характеризующие рентгенологическую картину заболеваний, сопровождающихся деструкцией альвеолярной кости. Особенности патологического процесса проявляются специфическими изменениями структуры, что отражается на рентгеновском снимке и позволяет уточнить клинический диагноз. Оперативное лечение выявленных заболеваний ставит целью исключение этиотропных факторов. Эффективность регенерации костных структур можно существенно повысить, заполняя дефекты кости остеотропластическим препаратом на основе гидроксиапатита кальция.
Annotation. The article provides information characterizing x-ray picture of the diseases accompanied by destruction of the alveolar bone. Features of a pathological process manifested specific changes in the structure, which is reflected in the x-ray and allows us to Refine the clinical diagnosis. Surgical treatment of identified diseases aims to the exclusion of causal factors. The efficiency of regeneration of bone structures can be considerably increased by filling the bone defects osteuropaeischen a drug on the basis of gidroksiapatit calcium.
Ключевые слова: рентгенодиагностика; деструкция альвеолярной кости; остеопластический материал.
Key words: x-ray diagnostics; destruction of the alveolar bone; osteoplastic material.
Литература
1. Безруков В. М., Григорьян А. С. Гидрокисапатит как субстрат для костной пластики: Теоретические и практические аспекты проблемы // Стоматология. — 1996. — № 5. — С. 7—12.
2. Козлов В. С., Туманова А. С., Труханов Е. Ф. Применение коллапана при хирургическом лечении пародонтита // www. medznate. ru/docs/index780. html, 2013.
3. Кулаков А. А. Клинико-лабораторное обследование в предоперационной подготовке к внутрикостной дентальной имплантации у больных остеопорозом / А. А. Кулаков, М. С. Седова, М. В. Гунько // Материалы XIII Международной конференции челюстно-лицевых хирургов и стоматологов «Новые технологии в стоматологии». — Санкт-Петербург, 2008. — С. 125—126.
4. Луцкая И. К. Имплантация одиночного зуба во фронтальном отделе верхней челюсти / И. К. Луцкая, Т. Л. Шевела // Дентальная имплантология и хирургия. — 2014. — № 3. — С. 63—65.
5. Параскевич В. Л. Дентальная имплантология. Основы теории и практики / В. Л. Параскевич. — Минск: Юнипресс, 2002. — 368 с.
6. Ружило-Калиновска И., Ружило Т. К. Трехмерная томография в стоматологической практике. Перевод с польск. — Львов: ГалДент, 2012. — 584 с.
7. Wortche R. An alternative method for sinus floor elevation //EDI Jornal. — 2013. — № 1. — Vol. 9. — P. 80—85.
Ранняя биохимическая диагностика остеопороза
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Остеопороз метаболическое заболевание скелета, протекающее длительно и поражающее значительную часть населения, особенно, старших возрастных групп. Помимо заболеваний сердца, инсульта, диабета и онкологических заболеваний, остеопороз одно из наиболее важных, с которыми приходится сталкиваться в клинической практике. Наиболее полная статистика по этой проблеме собрана в США. Ежегодно фиксируется 1,5 млн. переломов, связанных с остеопорозом, из них 700 тыс. переломов позвоночника, 250 тыс. переломов шейки бедра, 250 тыс. переломов дистального отдела лучевой кости и 300 тыс. переломов в других частях скелета. Риск переломов позвоночника, шейки бедра и дистального отдела лучевой кости составляет 40% для белых женщин и 15% для белых мужчин в возрасте 50 лет и старше. До 50% больных с переломом шейки бедра не могут обходиться без посторонней помощи, а от 15 до 20% больных умирают в течении 1-го года. Количество остеопоретических переломов в мире увеличивается и с 1,7 млн. в 1990 г. возрастёт до 6,3 млн. в 2050 г.
В связи с этим остеопороз становится важной социально-экономической проблемой. По мнению ряда исследователей, это заболевание, особенно в развитых странах, приобрело характер «безмолвной эпидемии». В России эта проблема изучается в нескольких научных центрах, несколькими научными группами. Проблема исследуется в сфере гинекологии, травматологии, эндокринологии, ревматологии, нефрологии. Литературы по этой теме на русском языке пока крайне мало, и клинические вопросы пока мало изучены.
Данное заболевание характеризуется прогрессирующим снижением костной массы в единице объёма кости по отношению к нормальному показателю у лиц соответствующего пола и возраста, нарушением микроархетектоники костной ткани, приводящим к повышенной хрупкости костей и увеличению риска их переломов от минимальной травмы и даже без таковой. В кости постоянно идут процессы костеообразования и костеразрушения, которые тесно сопряжены между собой по времени и месту происходящих событий, что определяет понятие единицы ремоделирования кости. Снижение костной массы является результатом рассогласования процессов резорбции и формирования костной ткани, которые в норме должны быть сбалансированы.
Гормональные факторы патогенеза остеопорозаВитамин D и его активные метаболиты являются компонентами гормональной системы, регулирующей фосфорно-кальциевый обмен, и участвуют, с одной стороны, в минерализации костной ткани, с другой – в поддержании гомеостаза кальция. Биологическое действие активных метаболитов витамина D заключается, главным образом, в стимуляции кишечной абсорбции кальция и фосфора, активации обмена и усилении экскреции кальция с мочой.
Глюкокортикоиды. На остеобластах находятся цитоплазматические глюкокортикоидные рецепторы опосредующие прямое действие ГК на кость.
Тироксин оказывает прямое воздействие на образование хряща во взаимодействии с ИРФ-1.
Эстрогены играют важную роль в формировании скелета и в предотвращении потерь костной массы. Они предотвращают резорбцию костной ткани путём подавления активности остеокластов.
Андрогены играют важную роль в костном метаболизме как у женщин, так и мужчин. Механизм действия андрогенов на костную ткань не вполне ясен. Однако известно, что их влияние на другие ткани-мишени опосредовано ростовыми факторами.
Соматотропный гормон. Действие СТГ связано с продукцией в костной ткани таких местных факторов как ИРФ-1, трансформирующий ростовой фактор в костный морфогенетический белок и другие. СТГ оказывает стимулирующий эффект на пролифирацию хондроцитов внутри ростовой пластинки.
Инсулин стимулирует синтез костного матрикса и образование хряща
Большое значение для ремоделирования костной ткани имеют простагландины и цитокины. Среди простогландинов важнейший простогландин Е2.
Первоначальный, но временный эффект ПГЕ2 ингибирование активности остеокластов. Среди системных гормонов стимулирующее действие на ПГЕ2 оказывает ПТГ, а ГК являются ингибиторами скелетного ПГЕ2.
Методы измерения костной тканиДля клиницистов важно, чтобы измерения предоставляли информацию, с помощью которой можно помочь пациентам (например, сократить количество переломов). За последние несколько десятилетий было разработано много методов, позволяющих с высокой степенью точности измерять костную массу количественно в различных участках скелета (фотонная или рентгеновская денситометрия, компьютерная томография, абсорциометрия).
Полезную информацию об обмене костной ткани позволяют получить некоторые инвазивные методы. Гистоморфологический анализ гребня подвздошной кости, даёт возможность получить сведения о скорости образования костной ткани на клеточном и тканевом уровне, однако информации о величине костной резорбции недостаточно. Кроме того, исследование обмена костной ткани ограничивается небольшой областью губчатого вещества и внутренней поверхностью кортикального слоя, что не всегда отражает происходящее в других отделах скелета.
Недостатки денситометрии
- Диагностика остеопороза возможна только при частичной потере костной массы.
- Не позволяет прогнозировать уровень потери костной массы.
- Оценка изменения плотности костной ткани возможна только через 1,5 – 2 года после назначения терапии.
- Отсутствие возможности быстрой коррекции терапии остеопороза.
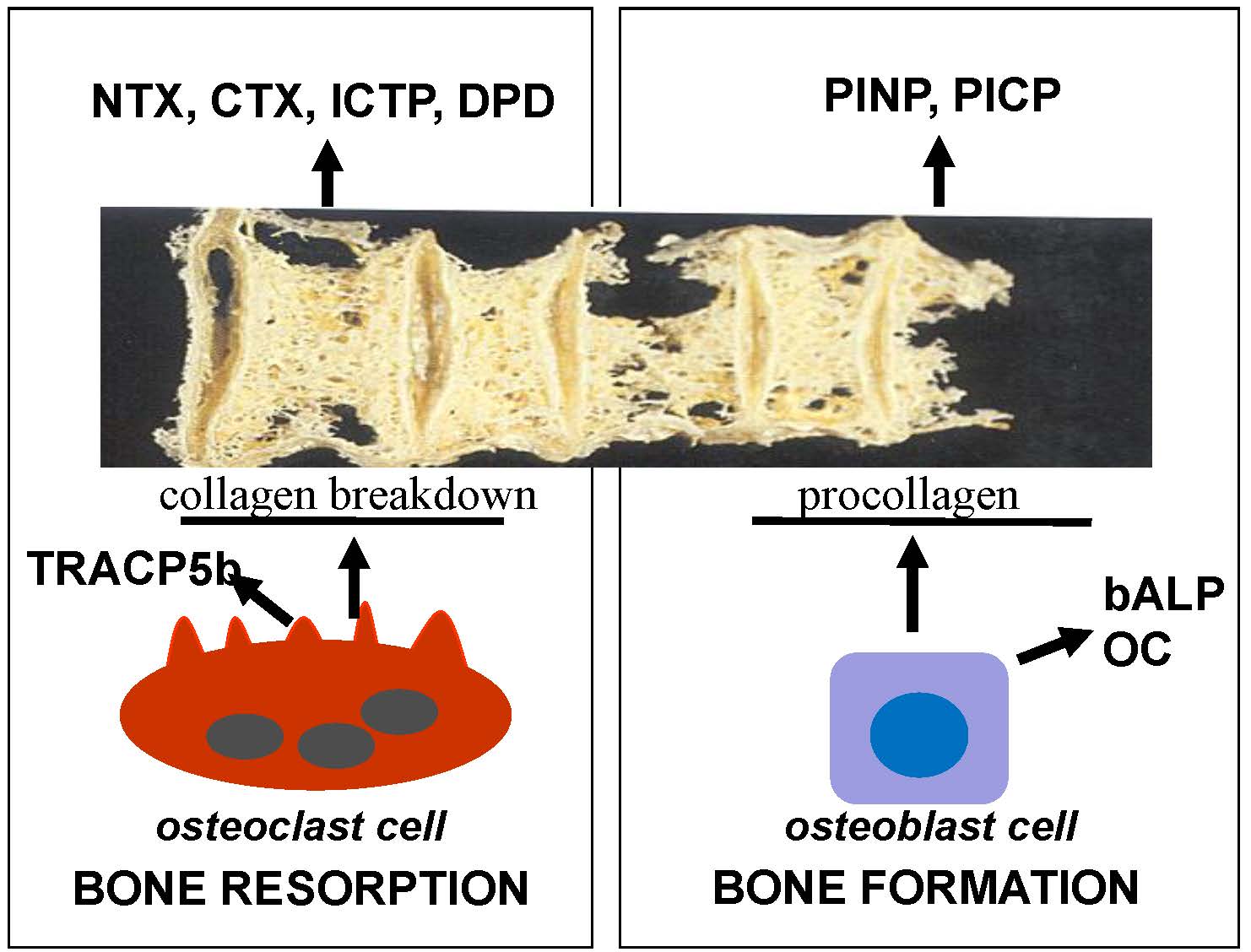
Скорость образования или разрушения матрикса костной ткани может оцениваться либо при измерении активности специфических ферментов костеобразующих или костеразрушающих клеток, таких как щёлочная и кислая фосфатаза, либо путём определения компонентов поступающих в кровоток во время синтеза или резорбции кости. Хотя эти показатели разделяются на маркёры синтеза и резорбции кости, следует учитывать, что в патологических условиях, когда процессы перестройки костной ткани сопряжены и изменены в одном направлении, любой из указанных маркёров будет отражать суммарную скорость метаболизма кости. Биохимические маркёры невозможно разделить в зависимости от изменений обмена в разных отделах костей, т. е. в губчатом или компактном веществе. Они отражают итоговые изменения резорбции и костеобразования, направленные в ту или иную сторону. Можно предполагать, что преобладание резорбции костной ткани над её синтезом, устанавливаемое при сравнении значений какого-нибудь маркёра резорбции и маркёра костеобразования будет в действительности соответствовать такому дисбалансу.
Биохимические маркёры ремоделирования кости
Щёлочная фосфатаза костного происхождения содержится в мембране остеобластов. В качестве показателя ремоделирования чаще всего используется общая активность щёлочной фосфатазы в сыворотке, но этому показателю свойственна низкая чувствительность и специфичность. Так как причины существенного повышения сывороточного уровня щёлочной фосфатазы могут быть различными. Например, у пожилых пациентов это может быть следствием дефекта минерализации костной ткани или влиянием одного из многих лекарственных препаратов, которым свойственно повышать активность печеночного изофермента.
Остеокальцин, также называемый костным gla-протеином, синтезируется преимущественно остеобластами и включается во внеклеточный матрикс костной ткани. Часть этого белка проникает в кровоток, где может измеряться иммунными методами.
Установлено, что при большинстве состояний, характеризующихся сопряженностью резорбции и синтеза костной ткани, остеокальцин может считаться адекватным маркёром скорости ремоделирования кости, а в тех ситуациях, когда резорбция и синтез костной ткани разобщены – специфическим маркёром костеобразования.
Биохимические маркёры костной резорбцииОпределение натощак кальция в утренней порции мочи (соотнесенного с экскрецией креатинина), является самым дешёвым методом оценки резорбции кости. Этот метод полезен для определения значительно усиленной резорбции, малочувствителен.
Деоксипиридонолин (ДПИД) является перекрёстной пиридиновой связью, присущей зрелому коллагену и не подвергающейся дальнейшим метаболическим превращениям. Он выводится с мочой в свободной форме (около 40%) и в связанном с пептидами виде (60%). Определение Дпид в моче имеет ряд преимуществ.
Это:
- высокая специфичность для обмена костной ткани;
- отсутствие метаболических превращений до выведения с мочой;
- возможность проводить исследования без предварительных диетических ограничений.
Проведённые наблюдения за терапией основными видами групп препаратов, позволили сделать следующие выводы:
- повышение уровня щёлочной фосфатазы и остеокальцина в сыворотке крови часто отмечается при лечении пациентов с остеопорозом фторидами. Определение этих маркёров рекомендовано для контроля за стимулирующим воздействием фторидов на костеобразование;
- антирезорбционные препараты, такие как эстрогены и бифосфонаты, приводят при остеопорозе, который развился после менопаузы, к значительному снижению концентрации маркёров резорбции и синтеза костной ткани, вплоть до пременопазуального уровня.
Такая динамика биохимических маркёров соответствовала замедлению потери костной ткани, установленному с помощью остеоденситометрии к 9 мес. лечения.
Основная цель применения биохимических маркёров состоит в оценке костного метаболизма, что особенно важно для терапии, так как пациенты с остеопорозом и высоким уровнем метаболизма кости лучше реагируют на такие активные антирезорбтивные препараты, как эстрогены и кальцитонин. В том случае, если показатели костного метаболизма соответствуют нижней трети нормального диапазона или ещё ниже, существенный лечебный эффект маловероятен.
Биохимические маркёры используются для решения вопроса о необходимости лекарственной терапии у женщин после менопаузы: чем выше значения костного метаболизма и чем ниже величина костной плотности по сравнению с нормальными значениями, тем больше необходимость назначения лекарственной терапии. Определение активности костного метаболизма, возможно, позволит врачу корректировать назначаемую терапию, до подтверждения диагноза денситометрическими методами.
Результаты многих клинических испытаний, позволяют считать, что маркёры костного метаболизма могут использоваться для прогнозирования действия антирезорбционной терапии на массу костной ткани. Расчёты, основывающиеся, с одной стороны на точности измерения массы костной ткани путём двухэнергетической рентгеновской абсорциометрии поясничного отдела позвоночника, с другой, на ожидаемых изменениях этого показателя под влиянием лечения, показывают, что для эффективности терапии у отдельно взятого пациента может потребоваться наблюдение в течении до 2-х лет. Повторное определение уровня костных маркёров позволяет сократить этот срок до 3-х месяцев.
Определение уровня биохимических маркёров резорбции и ремоделирования кости позволяет:
- при профилактическом обследовании выявить пациентов с метаболическими нарушениями процессов ремоделирования и резорбции костной ткани;
- оценить и прогнозировать уровень потери костной массы;
- дать оценку эффективности назначенной терапии уже через 2 – 3 месяца;
- выбрать наиболее эффективный препарат и определить оптимальный уровень его дозировки индивидуально для каждого пациента;
- быстро оценить эффективность проводимой терапии и существенно сократить материальные и временные затраты пациента на лечение.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Резорбция костной ткани – факторы усиления процесса
Содержимое
Костная ткань получает нагрузку постоянно – жевание и другие процессы сохраняют тонус твердых тканей, удерживающих зубы. Когда зуб отсутствует, нагрузка в зоне дефекта сводится к минимуму, за счет чего ость расслабляется, теряет плотность, объем. Установить имплант в такую кость не всегда представляется возможным.
Что такое атрофия костной ткани
Кость – живая структура, которая постоянно меняется. Около четверти структуры кости составляют органические соединения – белки, коллаген и прочие. Остальная часть – гидроксиапатиты, которые отвечают за жесткость кости. В зависимости от сочетания этих элементов кость может быть губчатой – легкой и пористой – и компактной – плотной и прочной. В нормальном состоянии процессы в разрушения и образования новой ткани идут непрерывно. Если система нарушается – нарушается и баланс процессов.
Атрофия в большинстве случаев начинается после удаления зуба. Любые ткани в организме поддерживают свое нормальное состояние за счет активного использования. Части, не участвующие в работе, атрофируются – это свойство организма. В первый год после удаления зуба объем твердой ткани сокращается на четверть.
Причины убыли костной ткани
Расслабление, потеря объема костной ткани происходит не только после удаления зуба. Для этого есть несколько других причин:
- Воспаление десен и других структур, окружающих зубы. Плотно прилегающая десна защищает зуб от проникновения инфекции в пришеечной зоне. Если структура тканей нарушена воспалением, они становятся уязвимыми для патологических изменений.
- Кисты, воспалительные процессы в области корней или пазух верхней челюсти.
- Остеопороз.
- Травмирование.
- Врожденные особенности анатомического строения.
Резорбция кости и имплантация
Недостаточный объем, искажение структуры кости – серьезная проблема для нормальной имплантации. Корень должен устанавливаться в плотную кость, чтобы прочно зафиксироваться и прижиться в тканях правильно. Если убыль кости незначительна, установить имплант возможно, главное, чтобы его размер соответствовал ситуации. Если же резорбция значительна, для имплантации потребуется восстановление объема за счет реконструкции челюсти.
Как предотвратить атрофию кости
Так как атрофия в большинстве случаев начинается после потери зуба, основной метод ее предотвращения – незамедлительное протезирование. Это можно сделать тремя способами:
- Установить мостовидный протез.
- Установить съемный протез.
- Провести имплантацию и установить коронку на имплант.
Два первый метода позволяют восстановить процесс жевания и эстетику, но они не позволяют возобновить нагрузку на кость. Только корневой имплант, вживленный в твердую ткань, позволяет правильно распределять нагрузку, тем самым обеспечивая здоровье кости.
Если из-за атрофии имплантация невозможна, пациенту показано восстановление объема костной ткани. На верхней челюсти такая операция называется синус-лифтинг. Проводится методом поднятия мембраны гайморовой пазухи и введения в образовавшееся пространство специального костнозамещающего материала. Остеопластика может проводиться двумя способами – открытым и закрытым. Открытый проводится с разрезом в боковой части челюсти. При закрытом материал вводится через прокол, без разрезов и швов.
Имплантация может проводиться после стабилизации и приживления костного материала – через несколько месяцев после операции. Дополнение объема кости также может быть проведено одновременно с имплантацией.
Костная резорбция – обзор
Костная резорбция: действие остеокластов и протеолитические ферменты
Костная резорбция включает в себя как растворение костных минералов, так и разрушение органического костного матрикса. Остеокласты очень специализированы для выполнения обеих этих функций. 130 После активации зрелых многоядерных остеокластов клетки прочно прикрепляются к поверхности кости с помощью специализированных подосом, богатых актином (актиновое кольцо), посредством реорганизации цитоскелета и клеточной поляризации. 149-151 Внутри этих плотно закрытых зон адгезии к минерализованному матрице остеокласты образуют извитые ворсинчатые мембраны, называемые «взъерошенными границами», которые существенно увеличивают площадь поверхности клеточной мембраны, обращенную к лакуне резорбции (лакуна Хаушипа) . Через эти взъерошенные мембраны остеокласты выделяют большое количество соляной кислоты (с участием протонного насоса вакуолярной H + -АТФазы), опосредуя подкисление компартмента между клеткой и поверхностью кости, а также множество ферментов, таких как лизосомальные катепсины, фосфатаза TRAP (тартрат-устойчивая кислая фосфатаза) и протеолитические ММП (матриксные металлопротеиназы) (см. ниже).Кислотность окружающей среды приводит к растворению минеральной фазы (кристаллический гидроксиапатит), активации литических ферментов и расщеплению органических матричных соединений (см. Рис. 60-5). Механизм уплотнения позволяет локализовать растворение и разрушение минерализованного костного матрикса, одновременно защищая соседние клетки от повреждений. 152,153 В процессе резорбции при растворении гидроксиапатита высвобождаются большие количества растворимого кальция, фосфата и бикарбоната.Удаление этих ионов необходимо (например, для поддержания кислого pH в лакуне резорбции) и включает в себя везикулярные пути и прямой перенос ионов через различные ионообменники, каналы и насосы. Продукты распада органического матрикса после ферментативного переваривания транслируются через клетку для секреции на базолатеральной мембране. 152,153
Эти сложные процессы рекрутирования остеокластов, поляризации на поверхности кости и экспорта кислоты и ферментов управляются многими факторами, включая RANKL, 154-156 , а также опосредованной интегрином передачи сигналов от костного матрикса. сам. 157,158 Последний, который, в частности, представлен интегрином αvβ3 в остеокластах, был предположительно важен для функционирования остеокластов на основании открытия, что ингибирование передачи сигналов через этот интегрин αvβ3 ингибирует опосредованную остеокластами резорбцию кости in vitro и на моделях животных. остеопороз и злокачественный остеолиз. 158 Интегрины представляют собой гетеродимерные рецепторы клеточной поверхности, состоящие из α и β субъединицы, которые опосредуют взаимодействия клетка-матрикс и, следовательно, адгезию.Интегрин αvβ3 среди различных интегринов, наиболее высоко экспрессируемых в остеокластах, распознает содержащие RGD (Arg-Gly-Asp) матричные белки, такие как витронектин, остеопонтин и костный сиалопротеин. Некоторые компоненты сигнального пути интегрина αvβ3 локализуются в зоне уплотнения активно резорбирующихся остеокластов и играют роль в связывании адгезии матрикса остеокластов с организацией цитоскелета, поляризацией клеток и активацией резорбции кости. После активации интегрин αvβ3 стимулирует внутриклеточный сигнальный комплекс, в котором участвуют тирозинкиназы c-Src и Syk.Важность αvβ3, c-Src и Syk в активности остеокластов подчеркивается развитием остеопетроза у мышей, дефицитных по каждому из этих генов, из-за отсутствия резорбции кости. Эти данные делают каждую из этих молекул кандидатом в терапевтические мишени для блокирования резорбции остеокластической кости. Доклинические данные показали, что лекарственные средства, нацеленные на интегрин αvβ3 (пептиды и непептидные малые молекулы), были способны успешно блокировать остеолиз и рост опухоли на животных моделях метастазов в кости, вероятно, путем ингибирования как опосредованной остеокластами резорбции кости, так и прямого воздействия на раковые клетки. 159 Продолжаются клинические испытания антагонистов интегрина и ингибирования c-Src киназы для лечения остеопороза. 115 147 157 159
Многие молекулы, которые важны для функции остеокластов in vitro, такие как β3 интегрин, c-Src, катепсин K, карбоангидраза II, TRAP и несколько белков ионных каналов, вызывают остеопетротический фенотип при удалении у мышей или изменено у людей. Отсутствие этих генов не влияет на дифференцировку в морфологически нормальные остеокласты; однако остеокласты не функционируют и не способны эффективно резорбировать кость. 81,147 Например, катепсин К, ключевой фермент в переваривании костного матрикса за счет его активности в расщеплении коллагена типа I, высоко экспрессируется активированными остеокластами и секретируется в лакуну резорбции. 152,153 Его делеция у мышей привела к остеопетрозу, 160,161 и мутации в гене катепсина К человека вызывают пикнодизостоз. 162 Были разработаны высокоселективные и сильнодействующие ингибиторы катепсина K (такие как Odanacatib и ONO-5334), которые в настоящее время проходят испытания в крупных клинических испытаниях III фазы, учитывая многообещающие более ранние результаты, указывающие на их полезность в качестве антирезорбтивных агентов для лечения остеопороза. в качестве их потенциального терапевтического использования для уменьшения остеолиза, вызванного раком груди, и уменьшения бремени опухолей скелета. 115,147,159,163-165
Помимо катепсина К, несколько групп протеолитических ферментов участвуют в деградации органических компонентов (коллагенов и протеогликанов) матриксов костей и хрящей после растворения минерала. 166-168 Одним из них является семейство ММП, которое включает более 25 членов, включая секретируемые коллагеназы, стромелизины, желатиназы и ММП мембранного типа (МТ). 167-169 ММП синтезируются как латентные проферменты, которые при протеолитической активации могут разрушать многочисленные компоненты внеклеточного матрикса.Как таковые, они участвуют в развитии, росте и восстановлении тканей, а также в патологических состояниях, связанных с чрезмерной деградацией матрикса, таких как ревматоидный артрит, остеоартрит и метастазирование опухоли. 166,169,170 Несколько MMP, включая MMP9 и MMP14 (также известные как MT1-MMP ), высоко экспрессируются в остеокластах / хондрокластах, но они также продуцируются многими другими типами клеток. Обе эти молекулы играют роль в процессе резорбции хряща, связанном с инвазией остеокластов во время эндохондральной оссификации. 109,111,171-173 ММП и протеолитические ферменты, содержащие дезинтегрин и домен металлопротеазы (ADAM), также, возможно, влияют на остеокластогенез как таковой, модулируя биодоступность и представление RANKL через протеолитическое расщепление его трансмембранной формы до растворимого RANKL. 174,175
Наконец, после ограниченного периода резорбтивной активности, остеокласт, как полагают, умирает в результате апоптоза (см. Ниже), 176 и резорбированная область хряща или кости в условиях развития, роста и кости здоровье, эффективно замещается вновь образованной костью под действием остеобластов.
Что такое резорбция кости? – Все о здоровье челюсти I Центр хирургии полости рта и лица на Аляске
Понимание врожденной резорбции в нашем стоматологическом здоровье важно, потому что это дает лучшее представление о том, зачем нам нужны зубы или протезирование.
В области гигиены полости рта всегда стандартом является сохранение естественного зуба, если мы можем, но если мы не можем, удаление зубов и протезирование зубов – зубные протезы и зубные имплантаты – являются наилучшей практикой. И хотя люди часто думают, что протезирование зубов может быть связано только с эстетикой, на самом деле это тоже структурная вещь.
И все это относится к резорбции кости!
В Центре хирургии полости рта и лица на Аляске мы знаем о резорбции кости и о том, как она влияет на структуру и функцию ваших зубов и челюсти. Узнайте больше о резорбции костной ткани в сегодняшнем посте.
Роль резорбции костной ткани в здоровье зубов
Резорбция костей – это именно то, на что это похоже – это разрушение и реабсорбция костей обратно в тело. Это может показаться странным процессом для нашего тела, но на самом деле это естественно и необходимо.
Например, когда мы моложе и начинаем терять молочные зубы, резорбция кости помогает разрушить любую оставшуюся кость, чтобы освободить место для наших постоянных взрослых зубов.
В то время как резорбция кости происходит по всему телу во всех костях, потому что наш организм находится в постоянном состоянии ремоделирования костей, резорбция кости и ее отношение к здоровью зубов может выглядеть немного иначе.
Типичный процесс включает разрушение поврежденной или ослабленной костной ткани с помощью остеокластов – клеток, разрушающих кость. Как только кость удаляется, мы начинаем строить новую кость.
Когда это происходит с одним зубом во рту, резорбция больше связана с изменениями в корне зуба.
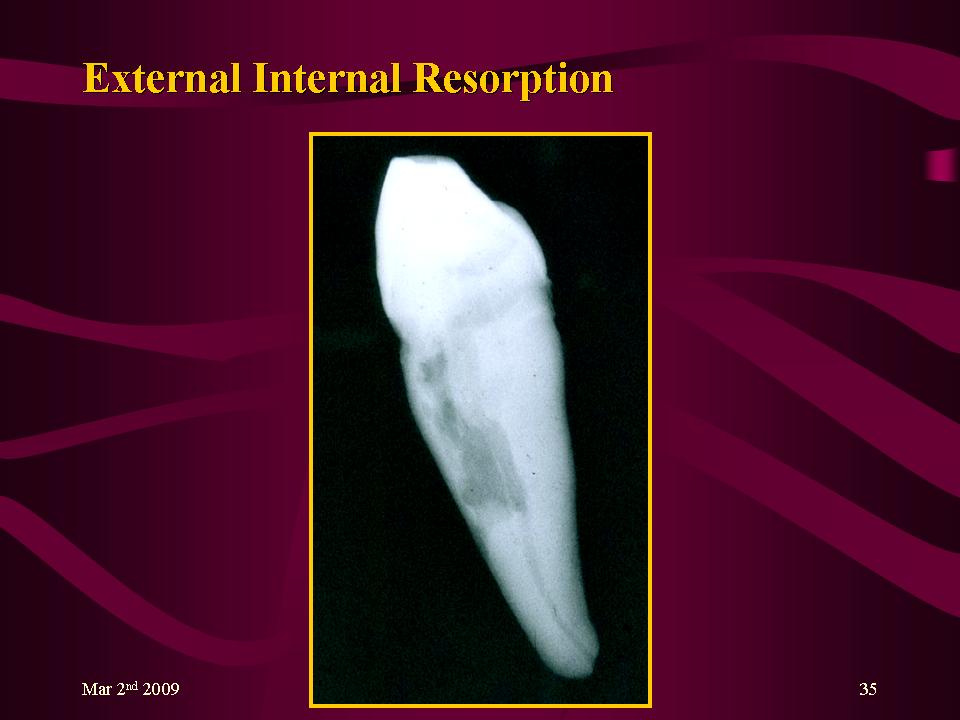
Два участка стоматологической резорбции
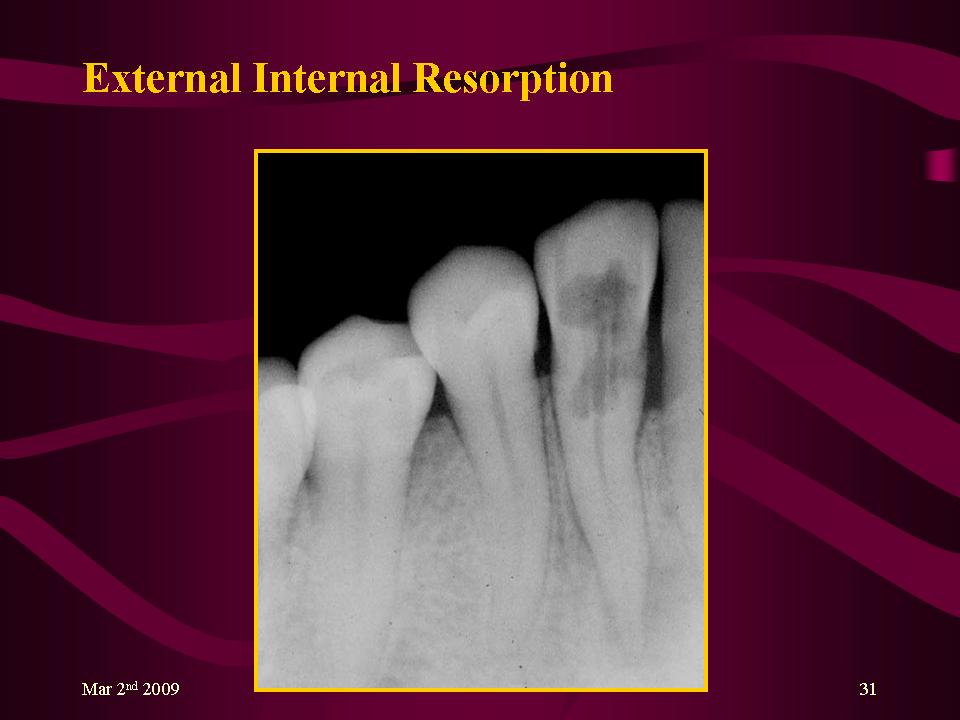
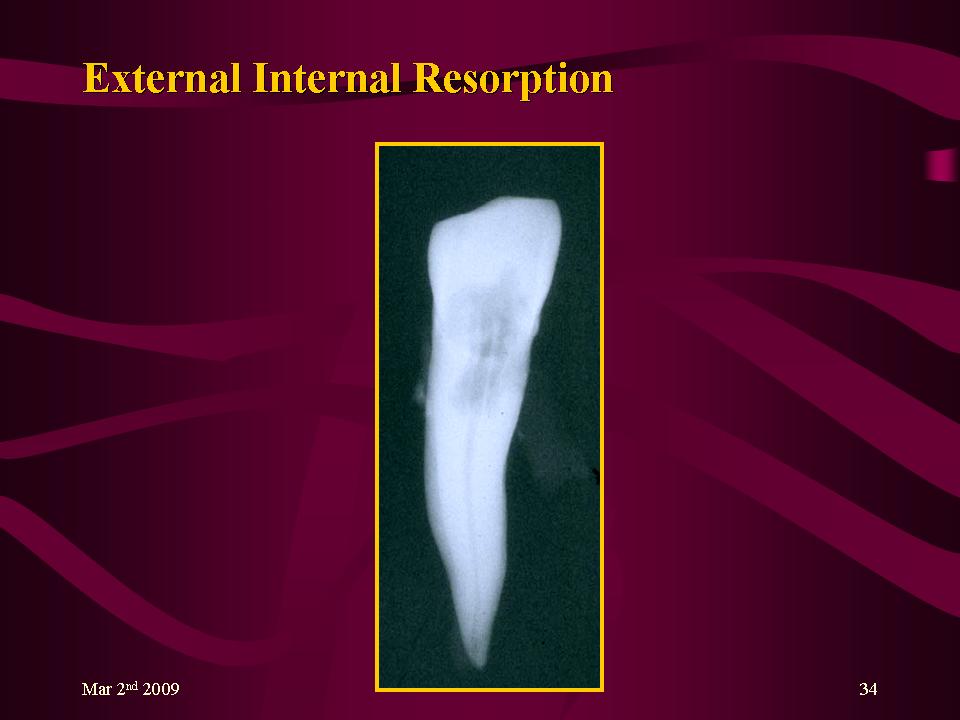
Мы знаем, что резорбция может происходить в корне, но это может происходить как внутри, так и снаружи.
Резорбция внешней кости – Развивается на внешней стороне зуба в месте соединения зуба с костью челюсти. Признаком возможной резорбции внешней кости являются розовые пятна вокруг зуба на деснах.
Резорбция внутренней кости – Это место резорбции кости находится внутри зуба и может возникнуть в результате хронического воспаления пульпы зуба.
Как лечить резорбцию костной ткани в этих областях?
Хотя и то, и другое поддается лечению и лечится на ранней стадии, внутреннюю резорбцию вылечить легче. Разрушение костей происходит при травме или раздражении на месте и обычно смягчается с помощью корневого канала или другой челюстно-лицевой хирургии – ваш хирург извлечет часть поврежденного корня, что должно остановить резорбцию кости на этом этапе.
Когда дело доходит до резорбции внешней кости, она более сложна и может привести к удалению корневого канала или зуба. Если ваш зуб все же необходимо удалить, вы можете поговорить с хирургом-стоматологом о вариантах протезирования зубов.
Почему происходит резорбция кости при потере или удалении зубов?
Кости укрепляются за счет ударов и физических воздействий, а для вашей челюстной кости это означает силу, которую ваши зубы прикладывают к ней – даже жевание и кусание создают воздействие, которое укрепляет кость во рту.
Когда кости или, в данном случае, зубы теряются, челюстная кость и окружающие зубы теряют свою силу, что сигнализирует вашему телу о производстве остеокластов для разрушения кости челюсти. И хотя новая кость все еще создается, это происходит медленнее, чем разрушение кости.
Вот почему потеря или удаление зуба связаны как с потерей костной массы, так и с резорбцией кости. Было показано, что примерно 25% костной ткани теряется через год после потери или удаления зуба и только после этого продолжает ухудшаться.
К другим проблемам со здоровьем зубов, влияющим на резорбцию кости, относятся пародонтит (заболевание десен) и остеопороз.
Стоматологические последствия резорбции костей и потери челюстной кости
Если резорбцию кости не лечить, она не исчезнет, а будет только прогрессировать, что затрудняет установку зубных протезов или зубных имплантатов, чем дольше вы ждете.
Это также приводит к изменениям лица, когда губы и щеки опускаются и смещаются со временем.
Как лечится резорбция кости?
Лечение костной резорбции зависит от причины разрушения костей, поэтому важно, чтобы вы проконсультировались со стоматологом, чтобы получить разъяснения по поводу состояния вашего зуба или челюстной кости. Для большинства лечение резорбции кости – это установка зубного протеза для повторного введения стимула. Зубные имплантаты – отличный способ стимулировать кость и остановить резорбцию.
Решите проблему резорбции костей вместе с нами!
От резорбции костной ткани у корня зуба до потери челюстной кости в результате отсутствия зубов – мы здесь, чтобы предоставить лучшие решения и методы лечения резорбции кости для здоровой, функциональной и красивой улыбки.
Для получения дополнительной информации о нашем зубном протезировании, включая зубные имплантаты, запишитесь на консультацию сегодня!
Костная резорбция и почему это плохо – Ly Denture Clinic
Костная резорбция – это процесс, при котором остеокласты разрушают кость и высвобождают минералы, что приводит к переносу кальция из костной жидкости в кровь. Остеокласты – это многоядерные клетки, которые содержат множество митохондрий и лизосом. Это клетки, отвечающие за резорбцию кости.Проще говоря, твоя кость тает. Это прозвучало страшнее, чем я имел в виду. Резорбция костей нормальная, и наши тела находятся в постоянном процессе моделирования. Кость резорбируется остеокластами и откладывается остеобластами в процессе, называемом оссификацией. Фактически, окостенение – это основа работы брекетов. Брекеты используют давление, чтобы контролировать процесс окостенения, и в течение длительного периода времени мы можем заставить ваше тело перемещать зубы, сломав кость, удерживающую зубы, и воссоздав кость в том направлении, в котором мы хотим, чтобы зубы двигались.
Наличие естественных корней зубов играет важную роль в поддержании здоровой костной массы в кости челюсти. Когда естественные зубы теряются, действительно проблемы возникают из-за потери корней. К сожалению, это вызывает больше проблем у людей, не считая щели в вашей улыбке. Отсутствие зубов приводит к потере стимуляции роста кости и увеличению скорости резорбции кости. Со временем это приводит к уменьшению высоты и ширины кости. По мере продолжения рассасывания гребень десен сглаживается.Дополнительное давление зубных протезов на десны фактически увеличивает скорость резорбции. Для тех, кто спит в зубных протезах, это давление 24/7 еще больше ускоряет рассасывание. Отсюда дряблость черт лица и «постаревший вид».
Еще одно соображение для тех, кто долгое время носит зубные протезы, заключается в том, что протезы со временем неизбежно расшатываются. Когда протезы изготавливаются впервые, они сначала могут чувствовать себя в безопасности; однако по мере рассасывания временно может помочь перебазировка.По мере продолжения потери костной массы, перебрасывание будет длиться реже каждый раз. Это связано с тем, что линия десны сжимается, а контуры, по которым она подогнана, меняются. Независимо от количества клея или пасты для зубных протезов, этот сдвиг в основании означает, что протез начнет двигаться во время еды и потенциально может вызвать неприятное скольжение.
Через год после удаления естественных зубов владельцы зубных протезов могут потерять 25% костной ткани. Через три года почти 60% кости может резорбироваться.Кусать становится труднее. Натуральные зубы имеют силу прикуса 250 фунтов. в то время как средний владелец зубного протеза имеет около 5 фунтов. силы. Общие признаки потери костной массы включают глубокие морщины вокруг рта с опущенными уголками рта. Челюсти могли образоваться из-за отслоения лицевых мышц по мере уменьшения костной массы. Ваш рот может выглядеть сжатым внутрь, а подбородок более заостренным.
К счастью, достижения в стоматологии теперь предлагают предложения по лечению резорбции кости. В протезах с опорой на имплантаты используются хирургически установленные винты, имитирующие утраченные корни зубов.Винты соединятся с костью и будут стимулировать образование кости так же, как и ваши естественные зубы; замедление процесса резорбции костной ткани.
Резорбция кости должна быть ключевым фактором при изучении того, какой путь выбрать с точки зрения типичных съемных протезов и протезов с фиксацией на имплантатах. После того, как выбор сделан, потерю костной массы можно замедлить и смягчить, но полностью изменить ее в будущем невозможно.
СвязанныеКостный метаболизм: цикл роста и резорбции костей
Костный метаболизм – это непрерывный цикл роста и резорбции костей, который тщательно регулируется динамическими отношениями между остеокластами, остеобластами и множеством гормональных и регулирующих воздействий.Относительные уровни этих сигнальных молекул определяют, наступит ли здоровый, сбалансированный метаболизм костей. Нарушение этого хрупкого равновесия, при котором резорбция превышает рост, может ослабить архитектуру скелета и подвергнуть человека риску развития хронических и изнурительных заболеваний, таких как остеопороз.
По мере того, как мы продолжаем лучше разбираться в тонкостях метаболизма костей и задействованных ключевых регуляторах, мы можем получить более глубокое понимание механизмов, лежащих в основе других заболеваний, связанных с костями.Портфель тестов ALPCO на метаболизм костной ткани служит мощным инструментом для изучения патологий, связанных с костями, и может помочь в разработке новых целевых терапевтических средств.
- Остеопороз
- Остеопетроз
- Болезнь Педжета
- Ревматоидный артрит
- Рак и метастазы в кости
- Потеря костной массы, вызванная иммобилизацией
- Хроническая болезнь почек
Информационные видео
Введение в биологию костей
Видео производства Amgen
Роль остеобластов и остеокластов в ремоделировании костей
Видео производства Amgen
Роль OPG и sRANKL в постменопаузальном остеопорозе
Видео производства Amgen
Склеростин: новый регулятор цикла роста и резорбции костей
Склеростин, белковый продукт гена SOST, ингибирует активность остеобластов посредством антагонизма сигнального пути Wnt и играет ключевую роль в цикле роста и резорбции костей.Отчеты показывают, что экспрессия и / или уровни циркулирующего склеростина повышаются при остеопорозе, вызванной иммобилизацией потере костной массы, ревматоидном артрите, множественной миеломе и метастазах в кости, что делает его терапевтической мишенью для исследований в области костей и рака. 1,2,3 Есть признаки того, что уровни склеростина также повышаются при хроническом заболевании почек, что также указывает на важность исследования почечной недостаточности. 4,5
Растущее количество доказательств проливает свет на новую роль склеростина во взаимодействии между диабетом, ожирением и метаболизмом костей.По мере того как население продолжает стареть, растет число хронических заболеваний, таких как ожирение, диабет 2 типа и остеопороз. Ряд недавних отчетов показал, что уровни склеростина повышены, а маркеры метаболизма костной ткани уменьшены при диабете 2 типа. 6,7,8,9 Диабет 2 типа связан с повышенным риском переломов, и кажется, что путь передачи сигналов Wnt может быть непосредственно задействован, потенциально на уровне секреции инсулина бета-клетками поджелудочной железы.
Видео производства Amgen
Гормоны репродуктивной функции и роста
Костный метаболизм регулируется комплексом гормональных влияний и факторов роста, которые способствуют коммуникации между остеокластами и остеобластами и оказывают глубокое влияние на скелет.Ключевыми участниками оси гипоталамус-гипофиз-гонад являются репродуктивные гормоны (эстроген, прогестерон и тестостерон), в то время как ось гормона роста / фактора роста инсулина оказывает прямое влияние на расширение хряща, моделирование и ремоделирование костей.
1. Рей Дж. П., Эллис Д. Л.. Модуляторы Wnt в биотехнологической отрасли. Динамика развития. Март 2010 г .; Том 239 № 3: 102-114.
2. Gaudio et al. Повышенный уровень склеростина в сыворотке крови, связанный с маркерами образования и резорбции костной ткани, у пациентов с потерей костной массы, вызванной иммобилизацией.J Clin Endocrinol Metabolism. Май 2010 г .; Том 95 № 5: 2248-2253.
3. Colucci S et al. Клетки миеломы подавляют остеобласты за счет секреции склеростина. Рак крови. Июнь 2011 г .; Том 1 № 6: e27.
4. Drüeke TB & Lafage-Proust. Склеростин: еще один игрок в почечно-костной болезни? Clin J Am Soc Nephrology. Апр 2011 г .; Том 6, № 4: 700-703.
5. Cejka D et al. Склеростин и Диккопф-1 при почечной остеодистрофии. Clin J Am Soc Nephrology. Апр 2011 г .; Том 6 № 4: 877-882.
6. Gaudio A, Privitera F, Battaglia K, Torrisi V, Sidoti MH, Pulvirenti I, Canzonieri E, Tringali G, Fiore CE. 2012 Уровни склеростина связаны с подавлением передачи сигналов Wnt / β-катенина и снижением метаболизма костной ткани при сахарном диабете 2 типа. J Clin Endocrinol Metab. 97 (10): 3744-50.
7. Гарсия-Мартин А., Розас-Морено П., Рейес-Гарсия Р., Моралес-Сантана С., Гарсия-Фонтана Б., Гарсия-Сальседо Дж. А., Муньос-Торрес М. 2012 Уровень склеростина в крови повышен у пациентов с типом 2 сахарный диабет.J Clin Endocrinol Metab. 97 (1): 234-41.
8. Вестергаард П. 2009 Костный метаболизм при диабете 2 типа и роль тиазолидиндионов. Curr Opin Endocrinol Diabetes Obes. 16 (2): 125-31
9. Starup-Linde J. 2013 Диабет, биохимические маркеры обмена костной ткани, контроль диабета и кости. Front Endocrinol (Lausanne) 4 (21): 1-17.
Старение и менопауза перепрограммируют предшественников остеокластов для агрессивной резорбции кости
Boyle, W. J., Simonet, W.С. и Лейси, Д. Л. Дифференциация и активация остеокластов. Nature 423 , 337–342 (2003).
CAS Статья Google Scholar
Кацимбри П. Биология нормального ремоделирования костей. евро. J. Уход за раком. 26 , e12740 (2017).
Google Scholar
Ховард Г. А., Боттемиллер Б. Л., Тернер Р.Т., Рейдер, Дж. И. и Бэйлинк, Д. Дж. Паратироидный гормон стимулирует образование и резорбцию костей в культуре органов: данные о механизме сцепления. Proc. Natl Acad. Sci. 78 , 3204–3208 (1981).
CAS PubMed Google Scholar
Парфитт А.М., Трэверс Р., Раух Ф. и Глорье Ф. Х. Структурные и клеточные изменения во время роста костей у здоровых детей. Кость 27 , 487–494 (2000).
CAS PubMed Google Scholar
Риггс Б. Л., Хосла С. и Мелтон Л. Дж. Половые стероиды и построение и сохранение скелета взрослого человека. Endocr. Ред. 23 , 279–302 (2002).
CAS PubMed Google Scholar
Парфитт А.М. Взаимосвязь между поверхностью, объемом и толщиной губчатой кости подвздошной кости при старении и при остеопорозе.Последствия для микроанатомических и клеточных механизмов потери костной массы. J. Clin. Вкладывать деньги. 72 , 1396–1409 (1983).
CAS PubMed PubMed Central Google Scholar
Джульет, Э., Компстон, Майкл, Р. и МакКланг, У. Д. Л. Остеопороз. Ланцет 393 , 364–376 (2019).
Google Scholar
Чин, К.Y. Связь между фолликулостимулирующим гормоном и здоровьем костей: альтернативное объяснение потери костной массы помимо эстрогена? Int J. Med Sci. 15 , 1373–1383 (2018).
CAS PubMed PubMed Central Google Scholar
Randolph, J. F. et al. Изменение фолликулостимулирующего гормона и эстрадиола в период менопаузы: влияние возраста в последний менструальный период. J. Clin.Эндокринол. Метаб. 96 , 746–754 (2011).
CAS PubMed Google Scholar
Wang, J. et al. Фолликулостимулирующий гормон увеличивает риск постменопаузального остеопороза, стимулируя дифференцировку остеокластов. PLoS One 10 , e0134986 (2015).
PubMed PubMed Central Google Scholar
Риггс, Б.Л. Механизмы эстрогеновой регуляции резорбции костной ткани. J. Clin. Вкладывать деньги. 106 , 1203–1204 (2000).
CAS PubMed PubMed Central Google Scholar
Хосла С., Оурслер М. Дж. И Монро Д. Г. Эстроген и скелет. Trends Endocrinol. Метаб. 23 , 576–581 (2012).
CAS PubMed PubMed Central Google Scholar
Истелл Р. и Хэннон Р. А. Биомаркеры здоровья костей и риска остеопороза. Proc. Nutr. Soc. 67 , 157–162 (2008).
PubMed Google Scholar
Kushida, K., Takahashi, M., Kawana, K. & Inoue, T. Сравнение маркеров образования и резорбции костной ткани у пациентов в пременопаузе и постменопаузе, а также у пациентов с остеопорозом. J. Clin. Эндокринол. Метаб. 80 , 2447–2450 (1995).
CAS PubMed Google Scholar
Егбали-Фатуречи, Г. и др. Роль лиганда RANK в обеспечении повышенной резорбции кости у женщин в раннем постменопаузе. J. Clin. Вкладывать деньги. 111 , 1221–1230 (2003).
CAS PubMed PubMed Central Google Scholar
Cao, J. J. et al. Старение увеличивает индуцированный стромальными / остеобластическими клетками остеокластогенез и изменяет пул предшественников остеокластов у мышей. J. Bone Мин. Res. 20 , 1659–1668 (2005).
CAS Google Scholar
Krum, S.A. et al. Эстроген защищает кость, индуцируя лиганд Fas в остеобластах для регулирования выживания остеокластов. EMBO J. 27 , 535–545 (2008).
CAS PubMed PubMed Central Google Scholar
Mano, H. et al. Зрелые остеокласты млекопитающих как клетки-мишени эстрогена. Biochem Biophys. Res Commun. 223 , 637–642 (1996).
CAS PubMed Google Scholar
Фуруяма Н. и Фудзисава Ю. Регулирование синтеза коллагенолитической цистеиновой протеазы эстрогеном в остеокластах. Стероиды 65 , 371–378 (2000).
CAS PubMed Google Scholar
Parikka, V. et al.Эстроген уменьшает глубину ямок резорбции за счет нарушения активности деградации органического костного матрикса зрелых остеокластов. Эндокринология 142 , 5371–5378 (2001).
CAS PubMed Google Scholar
Sørensen, M. G. et al. Характеристика остеокластов, полученных из моноцитов CD14 +, выделенных из периферической крови. J. Bone Мин. Метаб. 25 , 36–45 (2007).
Google Scholar
Хенриксен К., Карсдал М. А., Тейлор А., Тош Д. и Коксон Ф. П. Создание человеческих остеокластов из периферической крови. Methods Mol. Биол. 816 , 159–175 (2012).
CAS PubMed Google Scholar
Марино С., Логан Дж. Г., Меллис Д. и Капулли М. Получение и культура остеокластов. Bonekey Rep. 3 , 570 (2014).
CAS PubMed PubMed Central Google Scholar
Michelsen, J. et al. Референсные интервалы для сывороточных концентраций трех маркеров обновления костной ткани для мужчин и женщин. Кость 57 , 399–404 (2013).
CAS PubMed Google Scholar
Minisola, S. et al. Гендерные различия сывороточных маркеров резорбции кости у здоровых субъектов и пациентов с нарушениями, влияющими на кости. Остеопорос. Int. 13 , 171–175 (2002).
CAS PubMed Google Scholar
Wang, J. & Stern, P.H. Специфичные для пола эффекты эстрогена и андрогена на экспрессию генов в остеокластах, происходящих из моноцитов человека. J. Cell Biochem. 112 , 3714–3721 (2011).
CAS PubMed Google Scholar
Саламанна, Ф., Джардино, Р. и Фини, М. Спонтанный остеокластогенез: гипотеза для скрининга и диагностики остеопороза, не связанного с полом. Med Hypotheses 109 , 70–72 (2017).
CAS PubMed Google Scholar
Jevon, M. et al. Гендерные и возрастные различия в образовании остеокластов из циркулирующих предшественников. J. Endocrinol. 172 , 673–681 (2002).
CAS PubMed Google Scholar
Merrild, D. M. H. et al. Остеокласты, образующие ямки и канавки: важное различие. Bone Res. 3 , 15032 (2015).
CAS PubMed PubMed Central Google Scholar
Chung, P. L. et al. Влияние возраста на регуляцию дифференцировки остеокластов человека. J. Cell Biochem. 115 , 1412–1419 (2014).
CAS PubMed PubMed Central Google Scholar
Koshihara, Y. et al. Остеокластогенный потенциал клеток костного мозга увеличивается с возрастом у пожилых женщин с переломами. мех. Aging Dev. 123 , 1321–1331 (2002).
PubMed Google Scholar
Perkins, S. L., Gibbons, R., Kling, S. & Kahn, A. J. Возрастная потеря костной массы у мышей связана с увеличением пула предшественников остеокластов. Кость 15 , 65–72 (1994).
CAS PubMed Google Scholar
Salamanna, F.и другие. Метод in vitro для скрининга и мониторинга остеопороза, вызванного недостаточностью эстрогена, путем воздействия на периферические циркулирующие моноциты. Эйдж (Омаха). 37 , 9819 (2015).
Google Scholar
D’Amelio, P. et al. Спонтанное образование остеокластов из мононуклеарных клеток периферической крови при постменопаузальном остеопорозе. FASEB J. 19 , 410–412 (2004).
PubMed Google Scholar
Zampieri, M. et al. Реконфигурация метилирования ДНК при старении. мех. Aging Dev. 151 , 60–70 (2015).
CAS PubMed Google Scholar
Пал, С. и Тайлер, Дж. К. Эпигенетика и старение. Sci. Adv. 2 , e1600584 (2016).
PubMed PubMed Central Google Scholar
Левин, М. Э.и другие. Менопауза ускоряет биологическое старение. Proc. Natl Acad. Sci. 113 , 9327–9332 (2016).
CAS PubMed Google Scholar
Ulrich, C.M. et al. Метаболические, гормональные и иммунологические ассоциации с глобальным метилированием ДНК у женщин в постменопаузе. Эпигенетика 7 , 1020–1028 (2012).
CAS PubMed PubMed Central Google Scholar
Bahl, A. et al. Заместительная гормональная терапия, связанная с метилированием ДНК лейкоцитов и экспрессией генов, связана с внутрипарными различиями в ожирении и массе кости. Twin Res Hum. Genet. 18 , 647–661 (2015).
PubMed Google Scholar
Friso, S. et al. Заместительная терапия эстрогенами снижает общий уровень гомоцистеина в плазме и усиливает метилирование геномной ДНК у женщин в постменопаузе. руб. J. Nutr. 97 , 617–621 (2007).
CAS PubMed Google Scholar
Morris, J. A. et al. Связь метилирования ДНК в цельной крови с минеральной плотностью костей на уровне всего эпигенома. J. Bone Мин. Res. 32 , 1644–1650 (2017).
CAS Google Scholar
Ghayor, C. & Weber, F. E. Эпигенетическая регуляция ремоделирования кости и ее влияние на остеопороз. Int J. Mol. Sci. 17 , e1446 (2016).
PubMed Google Scholar
Reppe, S. et al. Отчетливые профили метилирования ДНК в костях и крови у женщин с остеопорозом и здоровых женщин в постменопаузе. Эпигенетика 12 , 674–687 (2017).
PubMed PubMed Central Google Scholar
Guo, Y. et al. Интеграция эпигеномных элементов и GWAS позволяет идентифицировать ген BDNF, влияющий на минеральную плотность костной ткани и риск остеопоротических переломов. Sci. Отчет 6 , 30558 (2016).
CAS PubMed PubMed Central Google Scholar
Søe, K. & Delaissé, J. M. Глюкокортикоиды поддерживают человеческие остеокласты в активном режиме цикла их резорбции. J. Bone Мин. Res. 25 , 2184–2192 (2010).
Google Scholar
Соэ, К., Меррилд, Д. М. Х.И Делэссе, Дж. М. Управление остеокластом через баланс деминерализации-коллагенолиза. Кость 56 , 191–198 (2013).
PubMed Google Scholar
de la Rica, L., Rodríguez-Ubreva, J. & García, M. Islam ABMMK, Urquiza JM, Hernando H, et al. Гены-мишени PU.1 подвергаются Tet2-сопряженному деметилированию и DNMT3b-опосредованному метилированию при дифференцировке моноцитов в остеокласты. Genome Biol. 14 , R99 (2013).
PubMed PubMed Central Google Scholar
Чиу, Ю. Х. и Ритчлин, К. Т. DC-STAMP: ключевой регулятор в дифференцировке остеокластов. J. Cell Physiol. 231 , 2402–2407 (2016).
CAS PubMed PubMed Central Google Scholar
Courtial, N. et al. Tal1 регулирует дифференцировку остеокластов посредством подавления главного регулятора слияния клеток DC-STAMP. FASEB J. 26 , 523–532 (2011).
PubMed Google Scholar
Saftig, P. et al. Нарушение резорбции остеокластической кости приводит к остеопетрозу у мышей с дефицитом катепсина К. Proc. Natl Acad. Sci. США. 95 , 13453–13458 (1998).
CAS PubMed Google Scholar
Gelb, B.D. et al. Катепсин K: выделение и характеристика кДНК и геномной последовательности мыши, гомолога гена пикнодизостоза человека. Biochem Mol. Med. 59 , 200–206 (1996).
CAS PubMed Google Scholar
Garnero, P. et al. коллагенолитическая активность катепсина К уникальна среди протеиназ млекопитающих. J. Biol. Chem. 273 , 32347–32352 (1989).
Google Scholar
Xiao, Y. et al. Идентификация общего происхождения остеокластов, макрофагов и дендритных клеток в гемопоэзе человека. Stem Cell Rep. 4 , 984–994 (2015).
CAS Google Scholar
Гейссманн, Ф., Юнг, С. и Литтман, Д. Р. Моноциты крови состоят из двух основных подгрупп с различными миграционными свойствами. Иммунитет 19 , 71–82 (2003).
CAS PubMed Google Scholar
Аренсон, Э. Б., Эпштейн, М. Б. и Сигер, Р.C. Объемная и функциональная неоднородность моноцитов человека. J. Clin. Вкладывать деньги. 65 , 613–618 (1980).
PubMed PubMed Central Google Scholar
Seidler, S., Zimmermann, H. W., Bartneck, M., Trautwein, C. & Tacke, F. Возрастные изменения субпопуляций моноцитов и связанных с моноцитами хемокиновых путей у здоровых взрослых. BMC Immunol. 11 , 30 (2010).
PubMed PubMed Central Google Scholar
Petitprez, V. et al. Моноциты CD14 + CD16 +, а не моноциты CD14 + CD51 / 61 +, являются потенциальным цитологическим маркером циркулирующих предшественников остеокластов при множественной миеломе. Предварительное исследование. Int J. Lab Hematol. 37 , 29–35 (2015).
CAS PubMed Google Scholar
He, X. et al. Идентификация и характеристика микроРНК путем секвенирования с высокой пропускной способностью в мезенхимальных стволовых клетках и костной ткани мышей с возрастным остеопорозом. PLoS One 8 , e71895 (2013).
CAS PubMed PubMed Central Google Scholar
Noren Hooten, N. et al. Возрастные изменения уровня микроРНК в сыворотке крови. Aging (Олбани, штат Нью-Йорк). 5 , 725–740 (2013).
PubMed Google Scholar
Jevon, M. et al. Формирование остеокластов из циркулирующих предшественников при остеопорозе. Сканд. J. Rheumatol. 32 , 95–100 (2003).
CAS PubMed Google Scholar
Mosekilde, L. Последствия процесса ремоделирования структуры губчатой кости позвонка: исследование с помощью сканирующей электронной микроскопии (разобщение ненагруженных структур). Костяной шахтер. 10 , 13–35 (1990).
CAS PubMed Google Scholar
Rumpler, M. et al. Остеокласты на кости и дентине in vitro: механизм образования следов и сравнение поведения резорбции. Calcif. Tissue Int. 93 , 526–539 (2013).
CAS PubMed PubMed Central Google Scholar
Gentzsch, C., Delling, G. & Kaiser, E. Микроструктурная классификация лакун резорбции и перфораций в проксимальных отделах бедра человека. Calcif. Tissue Int. 72 , 698–709 (2003).
CAS PubMed Google Scholar
Søe, K. & Delaissé, J.-M. Промежуток времени показывает, что остеокласты могут перемещаться по поверхности кости при резорбции. J. Cell Sci. 130 , 2026–2035 (2017).
PubMed PubMed Central Google Scholar
Lotinun, S. et al. Специфичная для остеокластов делеция катепсина K стимулирует S1P-зависимое образование кости. J. Clin. Вкладывать деньги. 123 , 666–681 (2013).
CAS PubMed PubMed Central Google Scholar
Дженсен, П. Р., Андерсен, Т. Л., Пеннипакер, Б. Л., Дуонг, Л. Т. и Делессе, Дж. М. Ингибиторы резорбции костной ткани Оданакатиб и Алендронат по-разному влияют на постостеокластические события у кроликов после овариэктомии. Calcif. Tissue Int. 94 , 212–222 (2014).
CAS PubMed Google Scholar
Fuller, K. et al. Ингибиторы катепсина К предотвращают деградацию матриксного фактора роста остеокластами человека. Кость 42 , 200–211 (2008).
CAS PubMed Google Scholar
Abdelgawad, M. E. et al. Запускает ли коллаген рекрутирование остеобластов в освободившиеся лакуны резорбции кости во время ремоделирования кости? Кость 67 , 181–188 (2014).
CAS PubMed Google Scholar
Panwar, P. et al. Эктостерический ингибитор катепсина k подавляет резорбцию кости у мышей, подвергшихся овариэктомии. J. Bone Мин. Res. 32 , 2415–2430 (2017).
CAS Google Scholar
Xie, H. et al. PDGF-BB, секретируемый преостеокластами, индуцирует ангиогенез во время связывания с остеогенезом. Нат. Med. 20 , 1270–1278 (2014).
CAS PubMed PubMed Central Google Scholar
Leung, P., Pickarski, M., Zhuo, Y., Masarachia, P.J. и Duong, L.T. Влияние ингибитора катепсина K odanacatib на резорбцию остеокластической кости и перемещение пузырьков. Кость 49 , 623–635 (2011).
CAS PubMed Google Scholar
Panwar, P. et al. Новый подход к ингибированию резорбции костей: ингибиторы экзосайтов против катепсина К. Br. J. Pharmacol. 173 , 396–410 (2016).
CAS PubMed Google Scholar
Пайпер К., Бойд А. и Джонс С. Дж. Взаимосвязь между количеством ядер остеокласта и его способностью к резорбции in vitro. Анат. Эмбриол. 186 , 291–299 (1992).
CAS PubMed Google Scholar
Møller, A. M. J., Delaissé, J. M. & Søe, K. Слияние остеокластов: промежуток времени показывает участие CD47 и синцитина-1 на разных стадиях ядерности. J. Cell Physiol. 232 , 1396–1403 (2017).
PubMed Google Scholar
Møller, A. M. J. et al. Септины являются важнейшими регуляторами резорбции остеокластической кости. Sci. Отчет 8 , 13016 (2018).
PubMed PubMed Central Google Scholar
Mulari, M. T. K., Qu, Q., Härkönen, P. L. & Väänänen, H.K. Остеобластоподобные клетки завершают резорбцию остеокластов кости и формируют новый минерализованный костный матрикс in vitro. Calcif. Tissue Int. 75 , 253–261 (2004).
CAS PubMed Google Scholar
Søe, K. et al. Участие человеческого эндогенного ретровирусного синцитина-1 в слиянии человеческих остеокластов. Кость 48 , 837–846 (2011).
PubMed Google Scholar
Что такое резорбция костей и как она влияет на мои зубы?
Как резорбция может повлиять на здоровье зубов
Как бы то ни было, резорбция связана с разрушением и поглощением костей телом.Как ни странно, наши тела естественным образом делают это, чтобы помочь удалить любую ненужную костную ткань в определенных областях нашего тела . В детстве именно это разрушает кость, оставленную нашими молочными зубами, и уступает место постоянным взрослым зубам. Этот процесс также приводит к переносу кальция в кровоток.
Вам также может понравиться: «Сколько кальция вам действительно нужно?»Резорбция костей и ее роль в здоровье зубов
Резорбция кости может происходить в нескольких частях тела, поскольку тело находится в постоянном состоянии ремоделирования кости.Этот процесс в основном означает, что организм разрушает ослабленную или поврежденную костную ткань с помощью остеокластов, которые по сути являются клетками, которые разрушают эту ткань. Как только стареющая костная ткань удаляется, образуется новая костная ткань, и этот процесс продолжается до нашей взрослой жизни.
Это не всегда так, когда речь идет о здоровье зубов и резорбции челюстной кости. В стоматологии резорбция обычно относится к изменениям, происходящим в корне зуба, которые не связаны исключительно с переломом, кариесом или пародонтитом .
Вам также может понравиться: «Пародонтит и сердечно-сосудистые заболевания»Где происходит резорбция?
Резорбция корня может развиваться в двух областях зуба, внутри или снаружи. Внешняя резорбция, как следует из названия, начинается на внешней стороне зуба, в области, напоминающей шею, где корень соединяется с костью челюсти. Вокруг этой области могут образоваться розовые пятна, которые, если их не лечить, могут серьезно повредить зуб на всем его протяжении до корня.
Внутренняя резорбция начинается внутри зуба и не так сложна или разрушительна, как резорбция наружного корня, если ее вовремя лечить должным образом. Внутренняя резорбция может развиться из-за хронического воспаления зубного нерва, известного как пульпа, и обычно является бессимптомным заболеванием, поэтому крайне важно уделять больше внимания стоматологической помощи, включая регулярные посещения стоматолога.
Как обычно лечат рассасывание корня?
Внутренняя резорбция определенно является более управляемой из двух, хотя и то и другое можно эффективно лечить, если выявить ее на достаточно ранней стадии.Когда в зубе начинает происходить разрушение кости, это обычно вызвано раздражением или травмой. Самый распространенный способ лечения – это операция на корневых каналах или небольшая хирургия пародонта. По сути, ваш стоматолог извлечет поврежденную ткань и пульпу, что должно остановить дальнейшее развитие резорбции.
Вам также может понравиться: «Лечение корневых каналов: добраться до« корня »лечения корневых каналов»Наружная резорбция корня обычно представляет собой гораздо более сложную процедуру для лечения, хотя ее можно успешно лечить, если повреждение не слишком обширно.В зависимости от уровня резорбции и ваших уникальных стоматологических потребностей ваш стоматолог может порекомендовать ряд процедур. Они могут варьироваться от хирургии пародонта, корневого канала, удаления поврежденной ткани или области или химической обработки до поверхности корня и окружающих областей. Однако, если внешняя резорбция слишком развита, возможно, потребуется удалить зуб. Если это произойдет, вы можете обсудить со своим стоматологом возможность установки зубного имплантата вместо утраченного зуба.
Предотвращение рассасывания корней и других заболеваний
Лучший способ предотвратить развитие инфекций и проблем, таких как рассасывание корней во рту, – это соблюдение специальной стоматологической процедуры. Доктор Бофилс рекомендует каждому пациенту чистить зубы зубной нитью и щеткой каждый день не реже двух раз в день, использовать жидкость для полоскания рта, избегать употребления вредных продуктов и регулярно проходить осмотры, чистки и рентген. Если вы или ваш близкий страдаете от зубной боли или инфекции, такой как резорбция корня, не стесняйтесь обращаться в наш офис. Мы обслуживаем ряд условий, в том числе круглосуточную неотложную стоматологическую помощь.
Все дело в костях
Кость – это живая, растущая ткань, которая играет важную роль, включая структурную поддержку тела. Здесь также сохраняется запас кальция в организме. Кость накапливается в течение первых двух десятилетий нашей жизни, достигая пика костной массы в возрасте 18-25 лет. Годы до достижения максимальной костной массы являются критическими годами для наращивания плотности костей, так как это поможет определить здоровье костей в последующие годы.
Части кости
Хотя есть две формы костей (плоские, встречаются в черепе и позвонках, и трубчатые, такие как кости рук и ног), все они в основном имеют одинаковую структуру. Кортикальная кость – это твердая внешняя часть кости. В этой части кости содержится одно вещество – гидроксиапатит, состоящий из минералов, включая кальций. Прочность и плотность костей в первую очередь обусловлены гидроксиапатитом. Еще одно вещество в кортикальном слое кости – коллаген, белок, отвечающий за обеспечение гибкого каркаса кости.
Трабекулярная кость – это внутренняя часть кости, имеющая сотовый вид. Хотя эта область также способствует прочности костей, эта часть кости более мягкая и менее плотная. Открытые пространства в губчатой кости заполнены тканью костного мозга с клетками, которые производят кровь.
Надкостница – это тонкая мембрана, которая покрывает внешнюю кость и содержит нервы, которые будут ощущать боль в костях. Кровеносные сосуды входят в кости через надкостницу, снабжая кости кровью.
Реконструкция
Чтобы поддерживать максимальную костную массу, кости постоянно проходят процесс, известный как «ремоделирование». Это непрерывный процесс разрушения кости и повторного образования новой кости для поддержания минеральной плотности костной ткани (МПК) и восстановления поврежденной кости.
Клетки остеокласта отвечают за разрыв старой кости путем микроскопического удаления небольших участков кости с поверхности. Эти большие клетки выходят из костного мозга на поверхность кости.Этот процесс высвобождает кальций и другие минералы в систему и известен как резорбция.
Оставленные отверстия заполнены новой костью остеобластами , другим типом клеток костного мозга. Чтобы полностью реформировать каждую кость в организме, требуется около 10 лет. Qsteoblasts выстилают поверхность новой кости и контролируют движение кальция в кость и из нее. Они также реагируют на гормональные сигналы, активируя остеокласты. Остеобласты работают немного медленнее, чем остеокласты, то есть новая кость образуется немного медленнее, чем удаляется старая кость.Остеобласты используют доступный кальций из кровотока для создания новой кости.
Некоторые остеобласты застревают в новой кости и становятся остеоцитами , которые отправляют длинные ответвления, чтобы соединиться друг с другом и посылать сообщения для прямой активности ремоделирования. Остеоциты также являются резервуарами для кальция. Считается, что остеоциты могут ощущать повышенную нагрузку на кости и инициировать активность остеобластов, тем самым увеличивая плотность костей. И наоборот, они также могут ощущать снижение нагрузки и увеличивать активность остеокластов, тем самым ослабляя кость.Это указывает на аргумент в пользу того, что упражнения с весовой нагрузкой являются частью построения крепких костей.
Гормоны играют роль в определении того, когда кости проходят резорбцию или формирование. К ним относятся паратироидный гормон (ПТГ) и кальцитонин. Когда уровень кальция в крови низкий, паращитовидная железа активируется для высвобождения ПТГ, который стимулирует остеокласты к удалению кости, высвобождая таким образом кальций в кровоток. При достаточном количестве кальция в системе щитовидная железа выделяет гормон кальцитонин, который замедляет резорбцию костей.Таким образом, важность наличия достаточного количества кальция в кровотоке для поддержания плотности костей.

