Подагрический артрит диагностика – лечение, симптомы, диета, фото, причины
Диагностика подагрического артрита
Рентгенологические проявления при подагре впервые описаны G. Huber в 1896 г. Позднее было проведено множество исследований, которые показали, что на ранней стадии болезни не существует каких-либо характерных изменений. Затем на рентгенограммах появляются признаки деструкции костей и хряща, обусловленные отложением кристаллов урата натрия в субхондральной кости.

Рентгенологическая картина подагрического артрита стоп ног

Рентгенологическая картина подагрического артрита правой ноги
Существует несколько классификаций рентгенологических изменений при подагре. Так, Е. Кавеноки-Минц выделяет три стадии хронического подагрического артрита (1987):
- I – крупные кисты в субхондральной кости и в более глубоких слоях. Иногда уплотнение мягких тканей;
- II – крупные кисты вблизи сустава и мелкие эрозии на суставных поверхностях, постоянное уплотнение околосуставных мягких тканей, иногда с кальцификатами;
- III – большие эрозии, но менее чем на 1/3 суставной поверхности, остеолиз эпифиза, значительное уплотнение мягких тканей с отложением извести.
Более поздней является классификация, предложенная М. Cohen, В. Emmerson (1994), согласно которой к основным рентгенологическим признакам при подагре относят следующие:
- в мягких тканях – уплотнения;
- эксцентрическая затемненность, обусловленная тофусами;
- кости (суставы) – суставная поверхность отчетливо представлена;
- юкстаартикулярный остеопороз отсутствует;
- эрозии (пробойник, краевой склероз).
Таким образом, представленные классификации значительно отличаются и нуждаются в унификации ряда рентгенологических признаков при подагре.
Инструментальные и лабораторные исследования.
В клиническом анализе крови во время острых приступов подагры у больных выявляют лейкоцитоз с нейтрофильным сдвигом влево и увеличение СОЭ.
В сыворотке крови определяется повышенное содержание мочевой кислоты: у мужчин более 7 мг % (0,42 ммоль/л), у женщин – 6 мг % (0,36 ммоль/л). Исследование экскреции мочевой кислоты должно проводиться после 3-дневной диеты, исключающей пурины (мясо, бульоны, рыбу, птицу, бобовые, чай, кофе, какао, алкоголь, пиво). Определяют объем суточной мочи, рН, концентрацию мочевой кислоты и креатинина в моче и сыворотке крови. В норме экскретируется 300-600 мг (1,8-3,6 ммоль/л) мочевой кислоты за сутки.
В содержимом тофусов обнаруживают кристаллы мочевой кислоты. Следует иметь в виду, что при гистологическом исследовании ткани тофусов не следует фиксировать их формалином во избежание растворения кристаллов уратов.
Типичными являются внутрикостные кистевидные образования различных размеров, обусловленные тофусами. Хронический подагрический артрит может сопровождаться деструкцией хряща (сужение суставной щели) и развитием краевых костных эрозий. Характерный признак – «симптом пробойника» – краевые костные или кистевидные образования правильной формы с четкими, иногда склерозированными контурами, с течением времени выраженная деструкция образуется не только в субхондральном участке кости, но и в эпифизе и даже в диафизе, образуя внутрисуставной остеолиз. Рентгенологически наиболее выраженная патология наблюдается в суставах стоп (в первую очередь, в суставах большого пальца). Редко, но могут встречаться рентгенологические изменения в плечевых, тазобедренных, крестцово-подвздошных суставах и позвоночнике. Костные изменения при подагре редко уменьшаются на фоне проводимой специфической терапии.
Исследование синовиальной жидкости.
Существующая в настоящее время литература о составе синовиальной жидкости у больных подагрой свидетельствует о значимости ее исследования для диагностики суставных заболеваний. По мнению многих исследователей, обнаружение кристаллов уратов в синовиальной жидкости и особенно в лейкоцитах является специфичным для подагры. Диагностическое значение имеет обнаружение игольчатых кристаллов уратов, расположенных внутриклеточно и двоякопреломляющих свет при исследовании с помощью поляризационного микроскопа. Пороговая концентрация кристаллов уратов в синовиальной жидкости, еще доступная для идентификации, составляет около 10 мкг/мл.
Чувствительность этого теста колеблется в пределах 85-97%.
Другим важным для острого приступа подагры показателем синовиальной жидкости является ее клеточный состав, главным образом количество лейкоцитов, которое достигает следующих значений: от 10 • 109 до 60 • 109/л, с преобладанием нейтрофилов.
Болезни суставов
В.И. Мазуров
medbe.ru
Диагностика подагрического артрита | Барскова В.Г.
Подагра – системное тофусное заболевание, характеризующееся отложением в различных тканях кристаллов моноурата натрия (МУН) и развивающимся в связи с этим микрокристаллическим воспалением у лиц с гиперурикемией (ГУ), обусловленной внешнесредовыми и/или генетическими факторами. Подагра является наиболее частым артритом у мужчин среднего возраста, однако достаточно часто она начала встречаться как у женщин, так и у молодых мужчин (до 30 лет).
К основным клиническим проявлениям подагры относят поражение суставов в виде рецидивирующих атак острого артрита или хронического артрита и образование депозитов кристаллов МУН (тофусов) в различных тканях и органах, чаще всего в суставах, почках, околосуставных частях костной ткани и коже, чаще также над суставами.
В течении подагры выделяют три периода: острый подагрический артрит, межприступный период и интермиттирующий подагрической артрит, а также хроническую подагру.
Острый подагрический артрит
Острый подагрический артрит начинается внезапно, с резких болей (как правило, в одном суставе), припухлости и гиперемии, которые нарастают в течение нескольких часов. Такие характеристики, как покраснение и припухлость сустава, которые вместе с болью достигают своего пика в первые 12 ч артрита, являются важными диагностическими признаками острой подагры (табл. 1). Внимание: при хронической подагре эти признаки могут быть не столь выражены из–за наличия длительного воспаления в суставе!
Длительность атаки поначалу варьирует от 1 до 10 дней. Наиболее частые провокационные факторы артрита: прием алкоголя, переедание, травма, хирургические процедуры, прием лекарственных препаратов, способствующих развитию ГУ (диуретики и антикоагулянты). У 70–90% больных первая подагрическая атака проявляется поражением ПЛФ сустава первого пальца стопы (рис. 1).
Межприступная подагра
и рецидивирующий подагрический артрит
Для подагры типичны межприступные периоды, когда клинические признаки артрита отсутствуют и больного ничего не беспокоит. Длительность таких «светлых промежутков» различна, зависит от приверженности больного к диете, способности отказаться от алкоголя и снизить вес, а также от терапии сопутствующих заболеваний (прием препаратов, обладающих различным действием на МК) и т.д. У 60–80% больных повторный приступ развивается уже в течение первого года. Указание на наличие типичных острых приступов в анамнезе является важным в диагностике подагры (см. ниже критерии диагноза Wallace и Nijmegen Score). При дальнейшем отсутствии антигиперурикемической терапии (АГУТ) характерно сокращение продолжительности бессимптомного периода с учащением и удлинением приступов артрита.
Хроническая подагра
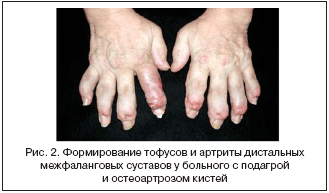
Диагностируется при развитии стойкого поражения суставов, которое обычно представлено олиго– или полиартритом, на фоне которого продолжают возникать острые вспышки классического подагрического артрита. За хронический артрит при подагре принимаются воспалительные явления в суставах более 3 мес. При хроническом артрите вовлекаются не только суставы нижних, но и верхних конечностей. Особенно часто артриты таких локализаций развиваются у женщин и у пожилых людей с остеоартрозом дистальных и проксимальных межфаланговых суставов (т.н. узлов Гебердена и Бушара). В случае формирования тофусов диагноз становится практически очевидным (рис. 2).
Тофусы
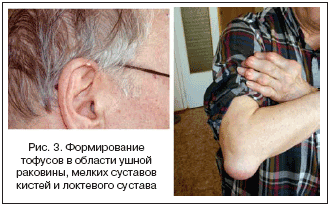
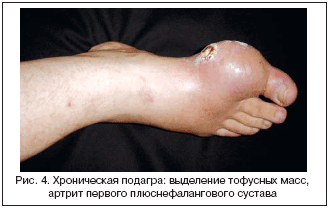
Тофусы являются депозитами кристаллов МУН различных размеров. Излюбленными органами–мишенями являются структуры сустава, и прежде всего хрящ и субхондральная кость, а также почки и кожа. Показано также образование тофусов практически во всех органах и тканях. Образование тофусов является облигатным процессом для подагры. В суставах они могут обнаруживаться уже после первого эпизода артрита. Видимые депозиты кристаллов МУН (как правило, подкожные) являются атрибутом хронического течения болезни, хотя скорость их формирования крайне вариабельна: как через 2 мес., так через 25 лет после начала болезни. Подкожные тофусы обычно локализуются в области пальцев кистей и стоп, коленных суставов, на локтях и ушных раковинах, но могут образовываться практически на любых участках тела и внутренних органах (рис. 3). Иногда наблюдается изъязвление кожи над тофусами со спонтанным выделением содержимого в виде пастообразной белой массы. Это может ошибочно трактоваться как гнойное отделяемое и приводить к необоснованным хирургическим вмешательствам (рис. 4).
Диагностика
Для диагностики подагрического артрита в 1975 г. Американской ассоциацией ревматологов (ААР) были рекомендованы критерии, которые в дальнейшем легли в основу классификационных критериев подагры, одобренных ВОЗ в 2002 г.
Нами был проведен ретроспективный анализ причин поздней диагностики подагры, который показал, что у 60% больных второй типичный приступ артрита развивается в течение первого года. Соответственно, такое количество больных уже в ранние сроки набирают достаточное количество критериев болезни. Таким образом, говоря про причины поздней диагностики, мы не можем ссылаться на неприспособленность критериев для ранней диагностики.
Тем не менее врачам общей практики необходимо помнить, что диагноз достоверной подагры выставляется только при наличии кристаллов моноурата натрия в синовиальной жидкости. В остальных случаях выставляется диагноз вероятной подагры.
Внимание: ключевой момент диагностики – выявление кристаллов моноурата натрия (МУН) в синовиальной жидкости
Выявление кристаллов МУН является ключевым моментом в постановке диагноза подагры.
Кристаллы МУН определяются в синовиальной жидкости, полученной как во время приступа артрита, так и в межприступный период.
Синовиальную жидкость на исследование можно получать из сустава, даже если он никогда не воспалялся. Проще всего получить синовиальную жидкость из крупного сустава, который легко пунктировать, например коленный.
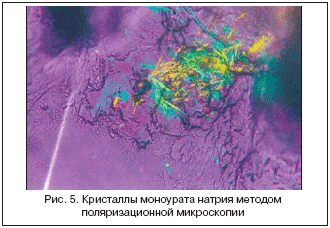
Необходимо помнить, что при типичных проявлениях подагры – интермиттирующее воспаление 1–го плюснефалангового сустава и гиперурикемия – клинический диагноз достаточно аккуратен, но не является определенным без подтверждения наличия кристаллов МУН. Именно демонстрация кристаллов МУН в синовиальной жидкости, или в содержимом тофуса, или в любом другом биологическом материале позволяет поставить определенный диагноз подагры (рис. 5).
Рутинный поиск кристаллов рекомендуется проводить у всех больных с недифференцированным артритом.
Диагностическая ценность гиперурикемии невелика – она является не фактором исключения или подтверждения подагры, а лишь маркером нарушения пуринового обмена. У многих людей с гиперурикемией не развивается подагра. Наоборот, во время острой атаки артрита у больных подагрой сывороточный уровень МК может быть нормальным, хотя и редко длительно держится на нормальном уровне.
Рентгенологическое исследование суставов помогает в проведении дифференциального диагноза в ряде случаев, также может демонстрировать типичные признаки хронической подагры и помочь в выявление внутрикостных тофусов, но бесполезно в ранней диагностике подагры (рис. 6).
Пунктирование сустава
в межприступный период
Длительное время считалось, что исследование синовиальной жидкости следует проводить исключительно во время приступа артрита из воспаленного сустава. Эти заблуждения были вызваны прежде всего теми исследованиями на животных и человеке, которые показали, что внутрисуставное введение кристаллов вызывало типичный приступ острого артрита, свойственного подагре. Логично было бы предположить, что, только впервые или вновь попадая в сустав, они вызывают воспаление, а в течение межприступного периода синовиальная жидкость должна быть от них свободна.
Однако постепенно стали накапливаться данные, что кристаллы МУН могут выявляться как из невоспаленных, но пораженных в течение болезни суставов, так и никогда не вовлекавшихся суставов. Так, в исследовании E. Pascual у 36 из 37 больных подагрой, не получающих уратснижающей терапии, кристаллы МУН были идентифицированы из жидкости, полученной при пункции невоспаленного, но пораженного ранее коленного сустава. Кроме того, в 26% случаях (у 7 из 37 больных) кристаллы МУН выявлялись из суставов, никогда ранее не вовлеченных в патологический процесс.
Технические особенности пункции: проще всего получить синовиальную жидкость из крупного сустава, который легко пунктировать, например коленного. Для исследования достаточно получить одну каплю синовиальной жидкости на предметное стекло.
В действительности, исследования синовиальной жидкости (СЖ) сосредоточены на коленном суставе, потому что: (а) это сустав поражается почти при всех артропатиях; (б) это крупнейший синовиальной сустав и (с) это самый простой сустав для аспирации.
Техника пункции бессимптомных коленных и первых плюснефаланговых суставов просты и с исключениями могут быть выполнены лишь с небольшим дискомфортом для пациента. Бессимптомные, но минимально воспаленные суставы обычно содержат увеличенное количество СЖ, что позволяет ее извлечь при пункции.
Коленный сустав
Для пункции коленного сустава используются шприцы 1 или 2 мл, которые в отличие от шприцов большего объема, производят малый вакуум, который может уменьшить вероятность того, что синовиальная оболочка будет втянута в конические и окклюзионные иглы. Синие и оранжевые иглы (диаметр 0,4–0,6 мм) предпочтительней, чем зеленые (диаметр 0,8 мм), хотя иглы большей длины могут быть необходимы для пункции коленных суставов у более крупных и имеющих избыточный вес лиц. Пункция осуществляется через медиальный подход (рис. 7). Он может находиться на уровне проксимальной точки коленной чашечки, если указывать вниз примерно на 30 и медиально, на месте ниже центра коленной чашечки. В качестве альтернативы: более поперечный подход может располагаться ниже медианы коленной чашечки, на месте медиальной лунки или желоба, вновь направленный поставить под иглой центр коленной чашечки. Прежде чем прокалывать кожу, переместите коленную чашечку из стороны в сторону, чтобы найти выпуклость в средней ямочке. После этого стабилизируйте коленную чашечку с одной стороны и массажируйте, в свою очередь, медиальную и латеральную ямочки, чтобы переместить небольшое количество синовиальной жидкости из одного заворота в другой.
Первый плюснефаланговый сустав
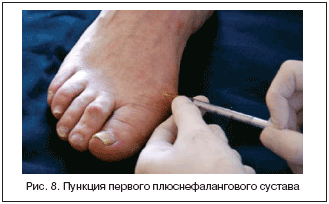
Это исследование может быть проведено на медиальной поверхности с использованием оранжевой иглы и шприцем 1 мл. Для этого нужно определить среднюю линию и немного размять ноги (рис. 8), это откроет среднюю линию, делая ее более ощутимой и легко видной. Вставьте иглу в верхнюю сторону совместной линии ниже разгибателей сухожилий. Если среднюю линию нелегко определить, то нужно пальпировать дистальный метафиз первой плюсневой кости и вставить иглу дистальней этого ориентира, переместить ее немного, если встречается костное сопротивление.
В случае отсутствия возможности выполнения световой или поляризационной микроскопии необходимо ориентироваться на типичные клинические признаки болезни, которые суммированы во второй части классификационных критериев. Недавно также был предложен счет Неймеген (табл. 2). У больных с итоговой суммой баллов <4 вероятность подагры равна 2%, между 4–8 баллами – 31%, больше 8 балов – 80%.
Хотелось бы подчеркнуть, что диагноз подагры правомочен без выявления кристаллов, однако вероятность ошибки в данном случае остается достаточно высокой. Представляется более адекватным решением введение в стандарты ревматологии обследование синовиальной жидкости на кристаллы, чем внедрение различных шкал. Тем более что из всего спектра показателей, которые обычно исследуются в синовиальной жидкости, выявление кристаллов и окраска по Грамму являются практически единственными показателями, которые имеют реальное диагностическое значение.
Показания для госпитализации
в ревматологическое
и терапевтическое отделения
Артрит, длящийся более 3 нед., несмотря на адекватное лечение НПВП.
Лечение артрита и подбор АГУ–терапии у больных с тяжелой сопутствующей патологией (сахарным диабетом, артериальной гипертензией, ишемической болезнью сердца, хроническими сердечной и почечной недостаточностью), а также пожилых больных.
Важно: при подозрении на септический артрит больного берется посев синовиальной жидкости и крови, начинается терапия ex juvantibus, и он срочно переводится в гнойную хирургию, не дожидаясь результата исследования на культуру.





Порекомендуйте статью вашим коллегам
www.rmj.ru
Дифференциальная диагностика подагрического артрита и методы его купирования | Барскова В.Г., Насонова В.А.
Подагра – системное тофусное заболевание, развивающееся в связи с воспалением в органах и системах в местах отложения кристаллов моноурата натрия у людей с гиперурикемией (ГУ), обусловленной внешнесредовыми и/или генетическими факторами (В.А. Насонова, В.Г. Барскова, 2003). Подагрический артрит был хорошо известен еще врачам античного периода, наиболее яркое описание симптоматики острого подагрического приступа принадлежит английскому врачу Сиденгаму. Окончательно выделил подагру как самостоятельную болезнь другой клиницист – Гарро, который отделил хронический подагрический артрит от ревматоидного.
Неоднократные описания в литературе позволили сформировать взгляд на классический подагрический артрит, как на острое, внезапно начинающееся, как правило, ночью или под утро, болезненное поражение плюснефалангового сустава (ПФС) первого пальца стопы. Артрит ПФС не является прерогативой исключительно подагры, тем не менее наличие таких типичных признаков, как выраженные гиперемия и припухлость, сочетающиеся с острой болезненностью, заставляет думать именно о подагрическом артрите. Обычно удается выявить наличие провоцирующих факторов, которые хорошо известны: прием алкоголя, обильное потребление мяса и жирной пищи, посещение бани (гиповолемия), операции, микротравмы, связанные с длительными нагрузками на стопу или, наоборот, вынужденным положением (перелеты в самолете, нахождение за рулем и т.д). Сочетание артрита с повышенным уровнем в крови мочевой кислоты (гиперурикемией) облегчает диагностику. Безусловно, что с течением болезни, особенно при отсутствии адекватной противоподагрической терапии, подразумевающей и коррекцию гиперурикемии и противовоспалительную терапию, могут вовлекаться все новые суставы, вплоть до полиартикулярного поражения. Тем не менее даже на этой стадии сочетание «регулярно обостряющегося» суставного синдрома с типичными экстраартикулярными признаками (подкожные, внутрикостные, почечные и т.д. тофусы) делает диагностику достаточно простой. Несмотря на значительно меньшие затруднения ревматолога при диагностике подагры по сравнению с остальными артритами, диагноз, по нашим наблюдениям, ставится в среднем на 7–8 год болезни. По мнению J. Talbott, диагностика подагры «должна бы быть рутинной, но на самом деле таковой не является».
Перед тем как обсуждать дифференциальную диагностику подагры, хотелось бы еще раз напомнить и перечислить те объективные трудности, которые хорошо известны ревматологам, имеющим опыт по наблюдению за такими пациентами. Во–первых, это особенности течения болезни. Так, артрит при подагре достаточно долго имеет доброкачественный характер даже без лечения. Единичные атаки, хотя и болезненные, быстро купируются нестероидными противовоспалительными препаратами (НПВП) или анальгетиками. Обычно при расспросе больных выясняется, что единожды прописанный врачом препарат принимается при каждом обострении до тех пор, пока не перестает быть эффективным, либо частые обострения артрита нарушают трудоспособность, либо возникающие побочные эффекты препаратов лимитируют дальнейший их прием и т.д. Во–вторых, имеют значение характерологические особенности больных, которые демонстрируют крайне низкий уровень послушания врачу и приверженности систематическому лечению. Очевидно, это обусловлено половым диморфизмом болезни: подагрой страдают в основном мужчины социально активного возраста (45–50 лет). Наконец, излишняя алкоголизация этих больных общеизвестна и указывается не только как причина усугубления гиперурикемии, но и как причина неэффективности аллопуринола: этанол затрудняет метаболизм аллопуринола в активные формы.
Говоря о проведении дифференциального диагноза подагры, нельзя не остановиться на современных классификационных критериях подагры, рекомендованных для использования ВОЗ в 2000 году (табл. 1). Классификационные критерии состоят как бы из двух частей – достоверных критериев подагры как болезни и клинико–лабораторно–рентгенологических признаков, способствующих раскрытию подагрического характера артрита. Таким образом, критерии помогают устанавливать не только достоверный диагноз подагры как тофусной болезни, но одновременно распознавать острый подагрический артрит в самом начале болезни.


Проведение дифференциальной диагностики с другой микрокристаллической артропатией, пирофосфатной артропатией (ПАП) обусловлено тем, что в том и другом случаях поражаются люди среднего и пожилого возраста, однако чаще ПАП – удел женского пола. Описано обнаружение обоих видов кристаллов у одного и того же больного. Провоцирующим фактором также может явиться травма. В 90% случаев ПАП наиболее поражаемыми суставами являются коленные, плечевые и мелкие суставы кистей. Если с подагрой ассоциируется артрит ПФС первого пальца, то с ПАП – артрит коленного сустава. Примечательно, но начало подагры с артрита коленных суставов не является казуистикой, особенно при наличии предыдущих травм, и, наоборот, псевдоподагра (вовлечение ПФС при ПАП) встречается у 2 из 50 больных. Вовлечение мелких суставов кистей при подагре наблюдается чаще на поздней стадии болезни. Плечевые же суставы при подагре можно считать суставами исключения даже на поздних стадиях болезни.
При наличии клинических предпосылок для проведения дифференциации ПАП с подагрой ключевым моментом является поляризационная микроскопия синовиальной жидкости, при которой оба вида кристаллов хорошо визуализируются. В более поздних стадиях ПАП характерные рентгенологические изменения также могут явиться абсолютным диагностическим признаком, описываемым, как тонкая плотная «бисероподобная» линия, лежащая параллельно кортикальному слою. Также выявляется кальцификация хряща менисков.
Воспалительные эпизоды в суставах, в меньшей степени напоминающие подагру, но также вовлекающие в процесс ПФС первого пальца могут отмечаться при остром кальцифицирующем периартрите. Депозиты аморфных гидроксиаппатитов, формирующиеся в острой стадии в связках или суставной капсуле, могут в дальнейшем исчезать. Атаки артрита тем не менее могут повторяться. Чаще кальцифицирующий периартрит встречается у женщин либо у пациентов с уремией, находящихся на гемодиализе. Наиболее часто поражаемые суставы в основном крупные: плечевые, тазобедренные, коленные.
Проведение дифференциального диагноза с ревматоидным артритом актуально в двух случаях. В случае моноартикулярного начала ревматоидного артрита изолированное поражение коленного и локтевого сустава может потребовать проведения дифференциального диагноза с подагрой. Как правило, больших трудностей эта клиническая ситуация не представляет. Во–первых, получение значительного количества синовиальной жидкости из крупного сустава позволит выполнить не только поляризационную микроскопию в целях поиска кристаллов, но и полноценного анализа, включающего ревматоидный фактор. Дополнительным критерием при недоступности анализа синовиальной жидкости может явиться критерий ex juvantibus: назначение НПВП или глюкокортикоидов внутрисуставно полностью купирует подагрический артрита (в отличие от ревматоидного).
Наиболее часто встречается ситуация обратная, когда позднюю полиартикулярную подагру с вовлечением мелких суставов кистей путают с ревматоидным артритом. Тем не менее если для ревматоидного артрита характерным является симметричный характер поражения с воспалением проксимальных межфаланговых суставов, вовлечением лучезапястных суставов, шейного отдела позвоночника, височно–челюстного сустава, то для подагры – тенденция к преимущественному поражению суставов нижних конечностей, а в случае вовлечения суставов кистей, к несимметричному артриту остается даже в поздней стадии болезни. Значительно реже, практически в единичных случаях хронической подагры наблюдается ульнарная девиация и амиотрофия кисти. Узелки, образующиеся в обоих случаях, могут быть не различимы при пальпации, хотя ревматоидные более напряженные и болезненные, чем подагрические. Рентгенологическое исследование может значительно помочь в диагностическом поиске, выявляя либо краевые эрозии, либо симптом «пробойника», который, как правило, в случае хронической полиартикулярной подагры значительно более ожидаем, чем на ранней стадии. Лабораторные тесты, морфологическое исследование узелков, определение ревматоидного фактора и уровня мочевой кислоты могут окончательно разрешить диагностические трудности. Сочетание двух болезней – ревматоидного артрита и подагры – считается казуистическим в связи с фактом ингибирования кристаллообразования ревматоидной синовиальной жидкостью.
Дегенеративные болезни суставов и подагра чаще сочетаются у одного больного (особенно пожилого), что требует проведения дифференциальной диагностики. Узлы Бушара или Гебердена не столько симулируют тофусное поражение пальцев, сколько вовлекаются в микрокристаллическое воспаление у пожилых больных. При изолированном остеоартрозе осмотр и исследование синовиальной жидкости выявляют минимальные воспалительные явления. Синовиальная жидкость может содержать отличные от моноурата натрия кристаллы – жидкие кристаллы липидов и пирофосфаты.
Дифференциальная диагностика подагры с псориатической артропатией может представлять реальные трудности. С одной стороны, при псориатической артропатии могут вовлекаться любые суставы, но более характерным является поражение дистальных межфаланговых суставов, что облегчает дифференциальную диагностику с подагрой. С другой стороны, на поздних стадиях деформация суставов может напоминать тофусную деформацию при подагре, тогда же рентгенологические изменения могут быть сходными (за исключением формирования классической картины «карандаша в стакане» и «пробойника»). Но главный признак, заставляющий проводить диагностический поиск – это гиперурикемия, которая нередко сопровождает псориатическую артропатию и часто ассоциируется с активностью кожных проявлений. Необходимо помнить, что даже при наличии кожного псориаза, окончательное решение может быть принято только после исследования синовиальной жидкости на кристаллы. В нашей практике встречалось сочетания кожного псориаза и подагры, подтвержденной выявлением кристаллов. В частности, мы наблюдали больного с хроническим артритом суставов нижних конечностей (коленных, голеностопных, ПФС первых пальцев) и распространенным кожным псориазом. Гиперурикемия, вовлечение ПФС и интермиттирующий характер артрита по началу болезни поставили под сомнение диагноз псориатической артропатии. В синовиальной жидкости, полученной при пункции плюснефалангового сустава, были выявлены кристаллы моноурата натрия. Интересно, но после того, как была проведена противоподагрическая терапия и подобрана доза аллопуринола, у больного отмечалась стойкая ремиссия в течение последующего года наблюдения не только в отношении артрита, но и псориатических высыпаний.
Достаточно актуальным является дифференциальный диагноз подагры с анкилозирующим спондилоартритом (АС). Наличие таких признаков, как мужской пол, частое вовлечение суставов нижних конечностей, моноартикулярное поражение, внезапность возникновения артрита, может симулировать подагру. Однако признаки, отличающие подагру от АС, являются достаточно яркими, хорошо описываются больными и делают клиническую картину АС хорошо узнаваемой: боли в позвоночнике со скованностью и ограничением движения, уменьшение экскурсии грудной клетки, ночные боли в нижней части спины с иррадиацией в ягодичные мышцы. Рентгенологическое исследование при этом выявляет картину сакроилеита. Почти у 90% больных определяется HLA–B27. Признаком, отличающим артрит при АС от подагрического, является его большая длительность (от нескольких недель, до нескольких месяцев) и не такой яркий терапевтический эффект НПВП, как при подагре.
Дифференциальный диагноз с синдромом Рейтера также обусловлен поражением в основном лиц мужского пола, вовлечением суставов нижних конечностей, преимущественно крупных, хотя могут вовлекаться и мелкие суставы стопы, симулируя острый подагрический артрит. Другие признаки из триады симптомокомплекса Рейтера – уретрит и конъюнктивит, предшествующие артриту – легко выявляются анамнестически. Опять–таки течение артрита склонно к более затяжному варианту, чем при подагре.
В любом случае данные анамнеза, особенно правильная их трактовка (табл. 3 и 4), и исследование синовиальной жидкости могут значительно облегчить проведение дифференциального диагноза.


В настоящее время нестероидные противовоспалительные препараты (НПВП) являются наиболее широко применяемой группой выбора, пришедшей на смену колхицину, в терапии острого приступа подагры. Для успешного и безопасного применения неселективных НПВП необходимо помнить, что, помимо влияния на желудочно–кишечный тракт (НПВП–гастропатия), они могут быть причиной функциональных повреждений почек, а также вызывать нежелательные подъемы артериального давления, что приобретает особое значение у больных подагрой, заведомо скомпрометированных высокой частотой гипертензии и нефропатии. В длительных наблюдениях за больными подагрой было показано, что именно НПВП, наряду с такими факторами, как артериальная гипертензия и сахарный диабет, имеют значение в формировании хронической почечной недостаточности.
Диклофенак натрия и индометацин в дозах до 200 мг в сутки достаточно длительное время являются наиболее часто применяемыми препаратами. В последнее время появились данные о высокой эффективности диклофенака калиевой соли (Раптен рапид) при подагрическом артрите. По данным Шостак Н.А., препарат показал высокую эффективность и переносимость в терапевтических дозах, побочные эффекты не были отмечены ни у одного больного, что свидетельствует о хорошей переносимости терапевтических доз Раптена рапида. К концу недели приема Раптена рапида значительное снижение интенсивности болевого синдрома отмечалось у 80% обследованных больных. Удовлетворительные показатели индекса функциональной недостаточности наблюдались к концу 7–дневного курса лечения у 86% больных.
Особые надежды в последнее время возлагаются на селективные ингибиторы ЦОГ–2. Получены данные, говорящие о высокой эффективности и безопасности нимесулида в виде растворимой гранулированной формы в саше в общепринятой дозе – 200 мг (100 мг два раза в день).
Хороший эффект применения глюкокортикоидов (ГК) при остром приступе известен давно, считается безопасным методом и показан при невозможности применения НПВП или колхицина из–за непереносимости препаратов, наличия почечной недостаточности, язвенного поражения ЖКТ. ГК применяются различными способами: наиболее популярно – внутрисуставное введение их, однако частота парентерального применения также неуклонно увеличивается. Эффект от их введения бывает быстрым и стойким, даже при применении единичных внутримышечных доз или внутривенном введении. Но, безусловно, по нашим наблюдениям, ГК являются препаратами выбора при полиартикулярном хроническом подагрическом артрите. В этих случаях можно рекомендовать внутривенное введение метипреда в дозах 250–500 мг однократно или двукратно в зависимости от количества вовлеченных в процесс суставов. Такая тактика обеспечивает быстрый и стойкий противовоспалительный ответ, сочетающийся с урикозурическим эффектом и хорошей переносимостью.
Подводя итог, хотелось бы подчеркнуть, что тщательный сбор анамнеза, внимательный осмотр больного при знании диагностических критериев не только подагры, но и вообще основных ревматических болезней, сопровождающихся поражением суставов, диагноз подагры в подавляющем большинстве случаев не вызывает затруднений. Что касается лечения приступа подагрического артрита, то знание особенностей препаратов выбора и их противопоказаний обеспечивает быстрое и безопасное его купирование.
www.rmj.ru
Диагностика и лечение подагрического артрита | #02/07
Подагра — системное тофусное заболевание, характеризующееся отложением в различных тканях кристаллов моноурата натрия и развивающееся в связи с этим воспалением у лиц с гиперурикемией, обусловленной внешнесредовыми и/или генетическими факторами.
К сожалению, заболеваемость подагрой растет и происходит это одновременно с такими болезнями, как ожирение, артериальная гипертензия, метаболический синдром, алкоголизм. Для ревматологов, врачей общей практики, а также других специальностей, в частности травматологов, ортопедов и т. д., сталкивающихся в своей работе с пациентами с подагрой, первоочередными задачами являются диагноз и адекватное купирование острой атаки артрита.
Диагностика
Диагностика подагры очевидна, в силу ярких, запоминающихся черт артрита, и в то же время не всегда проста. Прежде чем говорить о трудностях диагностики, отметим очевидные факты, благодаря которым с той или иной степенью достоверности можно судить о диагнозе. В настоящее время наиболее распространены классификационные критерии Валласа, приведенные ниже. Необходимо четко представлять себе, что независимым и достаточным признаком для диагностики подагры является выявление кристаллов моноурата натрия в наиболее доступных для исследования средах — синовиальной жидкости или тофусе (критерий А и В). Общепризнанно, что формирование кристаллов моноурата натрия составляет патогенетическую суть болезни, этот феномен уникален и облигатен, соответственно только этот критерий обеспечивает абсолютную достоверность диагноза подагры.
Классификационные критерии диагностики подагры (S.Wallace с соавт., 1972).
А. Наличие характерных кристаллов моноурата натрия в синовиальной жидкости.
В. Подтвержденный тофус (химическим анализом или поляризационной микроскопией).
С. Наличие 6 из 12 клинических, лабораторных и рентгенологических признаков.
- Максимальное воспаление сустава в первый день заболевания.
- Наличие более чем одной атаки артрита.
- Моноартрит.
- Покраснение суставов.
- Боль и воспаление плюснефалангового сустава первого пальца.
- Асимметричное воспаление плюснефалангового сустава.
- Одностороннее поражение тарзальных суставов.
- Подозрение на тофусы.
- Гиперурикемия.
- Асимметричное воспаление суставов.
- Субкортикальные кисты без эрозий при рентгенологическом исследовании.
- Отсутствие микроорганизмов в культуре синовиальной жидкости.
Поразительно, но в нашей стране поляризационная микроскопия используется крайне редко, и это несмотря на широкое производство поляризационных микроскопов отечественным производителем. Неудивительно, что диагноз подагры выставляется в нашей стране на 6–8-й год, когда уродующие пациента признаки болезни уже налицо. Для сравнения: для ревматологов европейских стран и США поляризационные микроскопы настолько же доступны, как, например, линейка визуально аналоговой шкалы (ВАШ), при этом исследование синовиальной жидкости проводится докторами самостоятельно, непосредственно после пункции сустава.
Что же делать, если микроскопа все-таки нет? Знание и применение признаков, представленных в группе С, позволяет рано заподозрить наличие острого подагрического артрита. Практическое их применение показало, что уже при втором приступе характерного артрита можно с большой степенью уверенности говорить о подагре у большинства больных. Тем не менее и литературные данные, и наш собственный клинический опыт говорят о том, что полагаться исключительно на клинические критерии не всегда правомерно, так как именно при впервые возникшем суставном синдроме могут иметь место диагностические ошибки.
Хотелось бы подчеркнуть, что такие лабораторные методы, как определение уровня мочевой кислоты и выполнение рентгенологического исследования суставов, не являются самостоятельными критериями подагры. Гиперурикемия сопровождает многие состояния и может протекать у большинства больных бессимптомно, никогда не переходя в подагру. При этом исследование уровня мочевой кислоты показало, что уровень сывороточной мочевой кислоты снижается во время приступа острого артрита, что связано с повышенным ее выведением почками в этот момент, поэтому исследование в момент активного артрита неинформативно.
Часто абсолютно неадекватно и по непонятным причинам между гиперурикемией и подагрой ставится знак равенства. Парадоксально, но, казалось бы, это должно приводить к гипердиагностике, на самом же деле диагноз подагры в нашей стране оказывается отсрочен на 6–8 лет.
Выявление рентгенологических симптомов подагрического артрита, а именно наличие рентгеннегативных тофусов (располагающихся внутрикостно, внутрисуставно или параартикулярно), является не только поздним признаком, но и отличается высокой субъективностью, зависит от опыта чтения врачом рентгенограмм и мало помогает ранней диагностике, свидетельствуя лишь о наличии тофусной, обычно поздней стадии болезни.
Классический подагрический артрит неоднократно описывался в литературе как острая, внезапно начинающаяся, как правило, в ночные или утренние часы, боль в области плюснефалангового сустава первого пальца стопы. Артрит плюснефалангового сустава не является прерогативой исключительно подагры, тем не менее наличие таких типичных признаков, как выраженные гиперемия и припухлость в сочетании с резкой болезненностью, заставляет клиницистов думать именно о подагрическом артрите. Характерно наличие провоцирующих факторов: прием алкоголя, обильное потребление мясной и жирной пищи, посещение бани (гиповолемия), операции, микротравмы, связанные с длительной нагрузкой на стопу или вынужденным положением (нахождение за рулем, в самолете и др.).
Диагностика впервые возникшего артрита первого плюснефалангового сустава может быть осложнена, так как похожая клиническая картина наблюдается при инфекции мягких тканей, бурсите большого пальца стопы, остеоартрозе, саркоидозе, псориатическом артрите, псевдоподагре и других состояниях. Наибольшее сходство с подагрой по остроте воспалительных проявлений имеют септический и, особенно, травматический артриты, хотя частота встречаемости их значительно ниже по сравнению с подагрой. Выяснение провоцирующего фактора может лишь частично помочь в постановке правильного диагноза, так как в обоих случаях зачастую наблюдается хронологическая связь с травмой, чем и объясняется тот факт, что пациенты часто обращаются в первую очередь к травматологу или хирургу. Рентгенологическое исследование дистальных отделов стоп на данном этапе имеет значение только для выявления переломов. Уровень мочевой кислоты в момент приступа, как мы уже указывали, может не превышать лабораторную норму. В данном случае практически единственным методом для верификации диагноза является пункция пораженного сустава. В классических случаях в пользу травматического артрита будет свидетельствовать выявление гемартроза. Для определения кристаллов моноурата натрия достаточно получить минимальное количество жидкости (не более капли) для создания отпечатка на стекле. Дополнительным фактом, свидетельствующим в пользу подагрического артрита, может быть довольно быстрое купирование последнего приемом противовоспалительных препаратов.
Лечение подагрического артрита
Известны три основные линии, использующиеся для лечения подагрического артрита: колхицин, нестероидные противовоспалительные препараты (НПВП) и глюкокортикостероиды. Трудности выбора обусловлены как индивидуальными особенностями больного, так и гетерогенностью собственно заболевания, протекающего с поражением многих органов и систем организма, в результате чего происходит изменение фармакодинамики препаратов, приводящее к накоплению побочных эффектов. На современном этапе терапия НПВП занимает первое место в лечении как острого приступа, так и хронического подагрического артрита. Считается, что при раннем назначении НПВП выбор препарата не имеет значения. В немногочисленных рандомизированных исследованиях свидетельств каких-либо преимуществ одних НПВП перед другими, если препараты назначаются в первые 48 ч от появления симптомов артрита, получено не было.
Тем не менее в клинической практике часто возникают ситуации, когда мы можем констатировать неэффективность принимаемых пациентом НПВП. Несколько лет назад мы начали целую серию исследований, посвященных эффективности гранулированной формы нимесулида (нимесил®) при подагрическом воспалении. Первым толчком к такой работе явилось открытое контролируемое исследование по эффективности и безопасности нимесила® при остром и хроническом подагрическом артрите. В исследование были включены 56 больных в возрасте от 35 до 79 лет. Особенностью подбора пациентов для исследования явилось включение в него больных с хроническим артритом (14 больных), полиартритом (7 больных), предварительно безуспешно лечившихся другими НПВП (23 пациента), т. е. речь идет о том контингенте больных, который обычно исключается из исследований по изучению эффективности НПВП при подагре. Это и понятно, так как возможное отсутствие эффекта или его недостаточная выраженность могут в большей степени относиться к тяжести самой болезни, чем к действенности препарата.
Длительность терапии нимесилом® зависела от динамики клинических проявлений и определялась врачом. Учитывая мнение экспертов, больным рекомендовался прием препарата до полного стихания симптомов артрита и далее еще в течение нескольких дней, в нашем исследовании суммарный курс составлял не меньше 14 дней. Тем не менее 4 человека самостоятельно прекратили прием препарата на 2–4-й день вследствие полного купирования артрита. Для профилактики быстро наступающего в дальнейшем обострения у больных с затяжными рецидивами или хроническим течением артрита, которые составили большинство включенных в исследование, нами был рекомендован 2-недельный прием препарата. При сохранении воспалительных явлений лечение продлевалось еще на 1 нед. После окончания исследования мы выявили те факторы, которые повлияли на длительность терапии. Ими оказались: длительно сохраняющийся артрит (более 1 мес), большее количество пораженных суставов (более 3), длительное течение болезни (более 10 лет) и высокая частота приступов за год (более 4–5). Таким образом, эти признаки могут использоваться для прогнозирования длительности курса у конкретного больного.
Динамическое наблюдение показало быстрое наступление эффекта. Так, на 5-й день терапии отмечалось уменьшение воспалительных и болевых явлений не менее чем в 2 раза. У всех больных с острым артритом к 14-му дню и, что еще важнее, у всех больных с хроническим артритом к 21-му дню было достигнуто полное купирование симптомов заболевания.
Следующим этапом явилось изучение безопасности препарата у данного контингента больных. Пациенты с подагрой в принципе могут рассматриваться как группа лиц с высоким риском развития гепатотоксических реакций. Прием алкоголя, алиментарные нарушения, метаболические расстройства, характерные для больных с подагрой, оказывают негативное влияние на состояние печени. Наличие исходного повреждения гепатоцитов подтверждалось повышением аминотрансфераз (аланинаминотрансфераза (АЛТ) у 25%, аспартатаминотрансфераза (АСТ) у 15% больных), причем у некоторых больных уровень АЛТ был в 2–2,5 раза выше нормы. Повышение γ-глутамилтрансферазы отмечалось у 50% больных. Использование нимесила® не привело к появлению отрицательной динамики биохимических показателей, характеризующих состояние гепатоцитов, за исключением одного случая, когда у больного имело место исходное повышение уровня АЛТ. Напротив, у ряда больных отмечалось снижение уровня АЛТ, АСТ и g-глутамилтрансферазы, что, вероятно, явилось следствием разъяснительной беседы, проводимой врачами, перехода на диетическое питание и отказа от приема алкоголя.
Оценка функции почек у больных подагрой при применении НПВП имеет не меньшее значение. Во-первых, поражение почек часто наблюдается у больных с подагрой. Генез поражения обусловлен рядом причин: собственно гиперурикемией и образованием тофусов, возрастом, сосудистыми факторами риска, в частности гипертриглицеридемией и гипертензией. Во-вторых, хорошо известно влияние НПВП на почечную функцию, особенно у пожилых больных. Динамический контроль уровня креатинина и мочевины в сыворотке и скорости клубочковой фильтрации не выявил значимых изменений у пациентов с подагрой, принимающих нимесил®. Хотя при сочетании подагры с диабетом 2 типа у двух пожилых больных отмечалось клинически значимое, но обратимое в дальнейшем снижение скорости клубочковой фильтрации.
При оценке безопасности применения нимесила® у больных с подагрическим артритом следовало, в частности, оценить влияние на артериальное давление (АД). При применении ручного метода измерения АД в каждый визит, мы не отметили какой-либо существенной динамики АД. Применение суточного мониторирования АД (СМАД) показало, что у больных артериальной гипертензии, получающих нимесил®, изменение средних значений систолического и диастолического АД было недостоверным и составило 2–5 мм рт. ст., незначительно менялись показатели вариабельности, достоверно улучшался суточный профиль АД. У трети больных отмечалось повышенное АД, максимально до 200/130 мм рт. ст., все эти пациенты получали гипотензивную терапию (ингибиторы ангиотензинпревращающего фермента и β-адреноблокаторы). При двухнедельном приеме препарата у таких больных показатели СМАД не изменились, а по некоторым значениям даже снизились. Достоверно уменьшилось систолическое АД (на 16 мм рт. ст.), диастолическое АД (на 8 мм рт. ст.), нормализовался суточный ритм. Возможно, это частично связано со значительным уменьшением болевого синдрома.
Побочные эффекты, потребовавшие отмены препарата, отмечались у 3 больных: у 1 — аллергическая реакция в виде кожной сыпи, у 1 — отек лица и голеней, у 1 больного развился гипертонический криз, однако однозначно связать это с действием нимесила® не представлялось возможным, так как больной самостоятельно отменил прием антигипертензивных препаратов.
Недавно нами было закончено рандомизированное контролируемое исследование по сравнению скорости наступления противовоспалительного и анальгетического эффекта различных форм нимесулида и диклофенака при подагрическом артрите. В исследование были включены 90 больных подагрой с рандомизированным выделением трех групп (по 30 больных в каждой). Пациенты 1-й группы получали гранулированный нимесулид (нимесил®) по 100 мг дважды в день, 2-й — таблетированный нимесулид (апонил) также по 100 мг 2 раза в сутки, 3-й — диклофенак по 75 мг 2 раза в сутки. Длительность приема препаратов составляла 7 дней.
Оценка скорости наступления анальгетического эффекта в течение первых 3 ч показала явное преимущество нимесулидов перед диклофенаком в целом (рис.). Тем не менее лишь больные, принимавшие гранулированный нимесулид, отметили уменьшение боли на 20-й минуте.
| Рисунок. Количество больных, отметивших уменьшение боли после приема первой дозы препарата, в каждой группе |
К 40-й минуте подавляющее большинство больных, а к 1-му и 3-му часу все пациенты, принимавшие гранулированный нимесулид, отмечали уменьшение боли той или иной выраженности. Во 2-й группе треть больных отметила уменьшение боли к концу первого часа и две трети — через 3 ч. В 3-й группе пациенты указывали на какое-либо уменьшение боли только к 3-му часу. Достоверное снижение боли по ВАШ к концу первого часа отмечалось также только у больных 1-й группы. Таким образом, в течение первых 3 ч после приема первой дозы наиболее значимая положительная динамика отмечалась только в группе пациентов, принимавших гранулированную форму нимесулида.
Оценка дальнейшей семидневной динамики боли и воспаления в трех группах вновь продемонстрировала существенную разницу между воздействием как нимесулида и диклофенака, так и различных форм нимесулидов. Эта разница отмечалась при сравнении выраженности боли по ВАШ, индекса припухлости и суставного индекса (данные не приводятся). В итоге, в течение 7 дней терапии приступ подагрического артрита удалось купировать у 24 больных, принимавших гранулированный нимесулид (80%), у 11 больных, принимавших таблетированный нимесулид (36%) и у 4 пациентов, принимавших диклофенак (13%).
Переносимость препаратов в целом была хорошей. Одна пациентка из 1-й группы указала на развитие отеков лица, 3 пациентки 2-й группы отметили головную боль и головокружение. Пять пациентов 3-й группы указали на боли в эпигастрии (n = 1) и головную боль (n = 4). Отмены препаратов не потребовалось.
Таким образом, данное исследование показало преимущество нимесулидов перед диклофенаком в отношении скорости наступления противовоспалительного и анальгетического эффекта при подагрическом артрите. Тем не менее только при применении гранулированной формы нимесулида анальгетический эффект отмечался у большинства больных уже в течение первого часа. Несмотря на равную эффективность таблетированной и гранулированной форм на 2–4-й день терапии, преимущество последней при дальнейшем наблюдении становится очевидным, о чем также говорит больший процент больных, у которых в течение 7 дней достигнуто полное купирование артрита.
Таким образом, наши данные свидетельствуют о перспективности применения нимесулидов при подагрическом артрите.
В. Г. Барскова, кандидат медицинских наук
Институт ревматологии РАМН, Москва
www.lvrach.ru
Подагра и подагрический артрит: причины, симптомы, диагностика, лечение
Подагрический артрит — это заболевание, связанное с нарушением обмена веществ в организме, при котором соли мочевой кислоты (ураты), откладываются в суставах. Это весьма неприятная, но, к счастью, легко поддающаяся лечению болезнь.
В наше время подагрический артрит встречается относительно не часто, в то время как само слово «подагра» нам приходится слышать едва ли не каждый день. К примеру, многие старенькие бабушки называют «подагрой» артрозы стопы или большого пальца ноги. В действительности заболевание, хотя и поражает все те же большие пальцы ног, по большей части является уделом мужчин. У женщин данный вид артрита встречается значительно реже и проявляет себя менее остро и «агрессивно». Связано это с тем, что на концентрацию мочевой кислоты существенно влияют мужские половые гормоны, которых женщины, по понятным причинам, лишены.
Расположенные в статье фото подагрического артрита позволят ознакомиться с течением болезни более подробно, в т. ч. со стадией острого подагрического артрита.
Подагрический артрит: причины
Подагра связана, прежде всего, с нарушением обмена веществ в организме, а пища (в частности, мясная пища), употребляемая в избытке, только усугубляет течение подагрического артрита, причиной возникновения при этом не является, как считают многие.
Предрасполагающие факторы заболевания:
- систематическое переедание мясной пищи,
- злоупотребление алкоголем,
- гипертония, заболевания почек,
- ожирение, малоподвижный или сидячий образ жизни,
- отягощенная наследственность,
- переохлаждение,
- прием некоторых лекарств.
При некоторых заболеваниях подагрический артрит может носить вторичный характер, к примеру, при пороках сердца (врожденных и приобретенных), интоксикации свинцом, некоторых видах лейкоза, приеме мочегонных средств, рибоксина, аспирина и т. д.
 |  |
Подагрический артрит: симптомы
Мочевая кислота – это нормальный продукт жизнедеятельности в крови. Высокий уровень мочевой кислоты связан с подагрой – видом болезненного артрита и воспаления, который в половине случаев поражает основание большого пальца ноги.
Уже некоторое время известно, что уровень мочевой кислоты повышен зачастую и у людей с высоким кровяным давлением, избыточным весом, а также с заболеваниями почек.
В клетках мочевая кислота функционирует и как антиоксидант, и как прооксидант. Поэтому, если вы слишком уменьшите ее уровень, вы утратите ее антиоксидантные свойства. Но если уровень мочевой кислоты слишком высок, это может увеличить содержание вредных веществ в клетках, а также там, где она выступает про-оксидантом.
Когда метаболические процессы, контролирующие количество мочевой кислоты в крови, не в состоянии эффективно выполнять свою работу, возникает подагра. Скованность и припухлость – результат избытка кислотообразующих кристаллов мочевой кислоты в суставах, а боль при этом состоянии вызвана воспалительной реакцией вашего организма на кристаллы.
Симптомы подагры могут быть мучительными. Она, вообще, считается одной из самых болезненных форм артрита. Чаще всего подагра поражает сначала большой палец ноги – при этом страдающие от нее люди говорят, что чувствуют, будто палец обжигает огнем или пронзает раскаленной кочергой.
Симптомы подагры проходят обычно в течение 3-10 дней, а следующий приступ может повториться через несколько месяцев или даже лет, если вообще повторится. Но, зачастую, подагра становится пожизненной проблемой, приступы которой происходят с нарастающей частотой и тяжестью. Со временем это может навсегда повредить суставы и прилегающие к ним области, особенно если не принимать меры, чтобы снизить уровень мочевой кислоты.
Подагра поражает две системы в организме – мочевыделительную и опорно-двигательную. Больше всего страдают суставы – именно они начинают беспокоить в первую очередь. Примечательно, что на начальной стадии заболевания симптомы подагрического артрита в виде болей могут возникать нерегулярно и проявляться раз в 2-3 месяца. У женщин симптомы обычно проявляются мягче, а приступы проходят менее болезненно. Поражаются, как правило, суставы больших пальцев ног, голеностопные, коленные и локтевые. Реже страдают межфаланговые и лучезапястные суставы пальцев рук. Пораженный участок припухает, кожа над ним приобретает багровую окраску. После первого приступа подагрического артрита, симптомы за 3-4 дня могут исчезнуть. Однако подагра будет продолжать разрушать ткани организма. Со временем боли начнут усиливаться, а перерывы между приступами – сокращаться.
Могут возникать также специфические скопления кристаллов солей под кожей (тофусы). Они имеют вид узелков беловатого окраса и располагаются в области ушных раковин или суставов. С развитием болезни усиливается скопление уратов в почках. Это ведет к развитию мочекаменной болезни и почечной недостаточности. Если вовремя не заняться этим вопросом, болезнь разовьется в острый подагрический артрит, вылечить который уже значительно труднее.
ВАЖНО
Если возникает подозрение на подагру, необходимо выполнить биохимический анализ крови, а также рентген кистей рук и ног. Диагноз подтверждается, если имеют место характерные поражения суставов, а также повышенное содержание мочевой кислоты в крови. Анализы крови необходимо выполнять в периоды острых приступов болезни и между ними.
Подагрический артрит: лечение
Лечение подагрического артрита должно осуществляться под наблюдением врача и со сдачей (периодической) анализов мочи и крови. Оно включает в себя, прежде всего, медикаментозную терапию, диету, а также использование противоподагрических препаратов, способствующих выведению уратов и мочевой кислоты из организма. Кроме того, при подагрическом артрите показано питание полноценное и правильное, употребление витаминов, а также хороший и полноценный отдых.
Диета при подагрическом артрите по сути своей достаточно щадящая, т. к. попросту не допускает употребление вредных продуктов, которые способствуют развитию болезни.
В наше время большую популярность приобрело лечение подагрического артрита народными средствами, Такое лечение, как правило, включает в себя различные средства, выращенные “на грядке”. Приведем несколько наиболее действенных продуктов:
- луковые отвары;
- сало;
- яблоки;
- лечение активированным углем;
- лечебный компресс из рыбы;
- лечение йодом и другие методы лечения подагрического артрита народными средствами.
Диета при подагре
В традиционных подходах к лечению подагры, как правило, применяются такие препараты, как:
- аллопуринол, который снижает количество мочевой кислоты, вырабатываемой организмом
- колхицин, который блокирует воспаление, вызванное кристаллами мочевой кислоты
- нестероидные противовоспалительные препараты (НПВП)
Эти препараты могут быть эффективными в краткосрочной перспективе, но вместе с тем, они чреваты очень опасными долгосрочными побочными эффектами. Поскольку зачастую подагра – состояние пожизненное, в конечном итоге, вы можете находиться на этих препаратах в течение очень длительного периода времени, что может нанести огромный вред вашему здоровью.
Всякий раз, когда мы говорим о снижении воспаления, я прошу вас помнить о том, что рацион питания – это ваш приоритет номер один. Это особенно актуально при подагре, ведь известно, что мясо и богатые пуринами продукты могут повысить уровень мочевой кислоты. Но еще более важен тот факт, что один из основных путей увеличения уровня мочевой кислоты – употребление большого количества фруктозы!
Если у вас подагра, тщательно ограничьте употребление фруктозы
Мочевая кислота – это побочный продукт метаболизма фруктозы. Фруктоза, как правило, создает мочевую кислоту в течение нескольких минут после употребления.
Фруктоза, которая является одним из главных источников калорий в рационе США, вызывает ожирение, сахарный диабет, а также ряд других распространенных заболеваний, в том числе:
- Подагру
- Высокое артериальное давление
- Высокий уровень холестерина и триглицеридов
- Болезни почек и жировую дистрофию печени
- Болезни сердца
Как оказалось, основным компонентом всех этих заболеваний является повышенный уровень мочевой кислоты, а более поздние исследования показывают, что фруктоза – ЕДИНСТВЕННЫЙ вид сахара, способный повышать уровень мочевой кислоты!
Фруктоза очень отличается от других сахаров, поскольку ее метаболизм проходит по очень специфическим путям, отличным от глюкозы, например, и мочевая кислота образуется именно в результате этого специфического метаболического действия. Согласно исследованиям д-ра Джонсона, при достижении уровня в организме >5,5 мг/дл, именно мочевая кислота является основным виновником проблем со здоровьем.
На этом уровне мочевая кислота связана с повышенным риском развития высокого артериального давления, а также сахарного диабета, ожирения и заболевания почек. Идеальный уровень мочевой кислоты – от 3 до 5,5 мг/дл.
Связь между потреблением фруктозы и повышением уровня мочевой кислоты является настолько надежной, что показатель мочевой кислоты в крови используется в качестве маркера токсичности фруктозы.
Сейчас я рекомендую включать анализ на уровень мочевой кислоты в регулярный анализ крови.
Что интересно и не так часто отмечается, диеты с низким содержанием углеводов, которые направляют в сторону питательного кетоза, тоже могут стать причиной высокого уровня мочевой кислоты. Пока неясно, способно ли повышение уровня мочевой кислоты таким путем вызвать тот же ущерб, что и повышенное потребление фруктозы. После обсуждения с д-ром Джонсоном я пришел к выводу, что при таком сценарии оно безвредно.
Исследование объединяет подагру и богатые фруктозой напитки
Если вы все еще не убедились в том, что фруктоза может увеличить риск развития подагры, рассмотрите исследование JAMA, проведенное в 2010 г. Анализ показал, что у женщин, которые ежедневно пьют более двух банок газированной воды, более чем в два раза выше шансы на развитие подагры, по сравнению с женщинами, которые редко пьют газированную воду. Ежедневное употребление 350 мл или более апельсинового сока имеет примерно тот же эффект. Кроме того, как сообщает CNN:
«У женщин, которые пьют одну банку газированной воды или 180 мл апельсинового сока в день, риск выше на 74 и 41 процентов, соответственно, по сравнению с женщинами, которые редко пьют эти напитки. «Виновником, по-видимому, является фруктоза», – говорит ведущий автор исследования, доктор медицинских наук Хён Чхве, профессор медицины Медицинской школы Бостонского университета».
Аналогичное исследование, проведенное среди мужчин, также показало, что у тех, которые ежедневно пьют два или более сладких безалкогольных напитка, на 85 процентов выше риск подагры, чем у тех, кто пьет меньше одного напитка в месяц. Риск значительно увеличен у мужчин, которые пьют пять-шесть порций сладких безалкогольных напитков в неделю. Кроме того, повышают риск фруктовый сок и богатые фруктозой фрукты, такие как апельсины и яблоки.
В качестве общего правила, я рекомендую ограничить общее потребление фруктозы до примерно 25 г в день в среднем, включая фруктозу из фруктов. Но если у вас резистентность к инсулину, сердечно-сосудистые заболевания, рак, высокое артериальное давление или повышенный уровень мочевой кислоты, возможно, лучше сократить его до 15 граммов или даже меньше.
Для тех, кто особенно чувствителен к фруктозе, д-р Джонсон разработал программу, которая помогает оптимизировать уровень мочевой кислоты. Ключевым этапом этой программы является полный отказ от фруктозы, пока ее уровень не достигнет идеального диапазона 3-5,5 мг/дл.
Приведенная ниже таблица взята из книги д-ра Джонсона «The Sugar Fix», в которой содержится более полная информация о содержании фруктозы в распространенных продуктах питания. Можете использовать ее, чтобы сократить фруктозу в своем рационе:
|
|
Что изменить в жизни, чтобы справиться с подагрой или предупредить ее возникновение
Ограничение фруктозы в вашем рационе – одна из самых важных мер лечения и профилактики подагры, а в моем плане питания вы найдете простые рекомендации, как это сделать.
Вам понадобится отказаться от газированной воды, фруктовых соков и других подслащенных напитков, поскольку они являются основным источником избыточной фруктозы. Вместо этого пейте много чистой воды, так как жидкость помогает вывести мочевую кислоту из организма. К другим важным советам относятся:
- Ограничьте употребление алкоголя, особенно пива: подагра быстрее возникнет, если вы пьете слишком много алкоголя, но пиво, в частности, может быть особенно проблематичным. Оказывается, что дрожжи и все то, из чего готовят пиво, вместе делают из этого напитка еще один мощный триггер мочевой кислоты.
Хотя это мнение еще новое, экспериментальные исследования подтверждают выводы д-ра Джонсона, поэтому употребление пива – это то, чему обязательно нужно уделить внимание, если вы контролируете свой вес и стараетесь укрепить здоровье. - Ешьте пироги с вишней в умеренном количестве: в вишнях содержатся мощные соединения, такие как антоцианы и биофлавоноиды, которые, как известно, борются с воспалением и помогают снизить уровень мочевой кислоты. Если есть вишни из-за их терапевтической ценности, то в 10 ягодах черешни или 1 стакане вишни содержится около 4 граммов фруктозы, поэтому не забудьте учесть это в общем ежедневном употреблении фруктозы
- Избегайте соевого молока: есть данные исследований, показывающие, что оно может увеличить уровень мочевой кислоты примерно на 10 процентов.
- Подумайте о лекарственных травах: некоторые травы и специи, в том числе, имбирь, корица, и ашвагандха, продемонстрировали способность действенно облегчать симптомы подагры и связанного с ней воспаления.
- Ешьте больше продуктов, богатых калием: иногда у людей страдающих подагрой, наблюдается дефицит калия, а препараты цитрата калия, которые, как известно, подщелачивают мочу, помогут организму вывести мочевую кислоту.Правильный баланс калия как внутри, так и снаружи клеток имеет решающее значение для правильной работы организма, но если вы употребляете продукты питания с высокой степенью обработки (именно они зачастую связаны с подагрой), вы не получаете достаточно калия. Он широко распространен в овощах и фруктах, но ниже я привожу ряд его наиболее полезных источников.
Если вы захотите принимать добавки, рассмотрите бикарбонат калия, который, вероятно, является, наилучшим источником калия в качестве добавки.
Мангольд (960 мг калия в 200 г) | Авокадо (874 мг в 200 г) | Шпинат (838 мг в 200 г) |
Шампиньоны «кремини» (635 мг в 150 г) | Брокколи (505 мг в 1 стакане) | Брюссельская капуста (494 мг в 200 г) |
Сельдерей (344 мг в 200 г) | Латук (324 мг в 400 г) |
Внимание! информация на сайте не является медицинским диагнозом, или руководством к действию и предназначена только для ознакомления.
doclvs.ru
70. Подагра. Клиническая картина. Диагностические критерии подагры (острый подагрический артрит, образование тофусов, особенности поражения почек и т.Д.).
Подагра — метаболическое заболевание с нарушением пуринового обмена и накоплением мочевой кислоты в организме, протекающее с повторными приступами острого артрита, кристаллиндуцированнымисиновитами, отложением уратов в тканях.Подагра чаще развивается в течение пятого десятилетия жизни.
В преморбидном периоде имеется только гиперурикемия, протекающая бессимптомно.Бессимптомна я гиперурикемия наблюдается у 8-14% взрослого населения. Она еще не считается подагрой. В интермиттирующем периоде имеет место чередование острых приступов артрита с бессимптомными межприступными промежутками. Для хронической подагры характерны тофусы, хронический подагрический артрит,из внесуставных проявлений подагры наиболее часто встречается поражение почек (у 50-75% больных).Начало заболевания имеет 7 вариантов
1. Типичны йострый приступ (классический) наблюдается в 50-80%случаев. Возникает чаще всего среди полного здоровья,внезапно, У части больных возможныпродромальные явления в виде слабости, повышеннойутомляемости, субфебрилитета, головных болей, артралгии.Провоцируют приступ жирная пища, алкоголь,переохлаждение, травма.Приступ начинается внезапно, чаще ночью, появляются резчайшие боли в I плюснефаланговом суставе (большомпальце стопы), сустав быстро припухает, кожа над нимкраснеет, затем становится синевато-багровой, горячей,температура тела повышается до 38-39*, кожа над суставомблестит, напряжена, функция сустава нарушена, больной
обездвижен.Первые приступы подагры, как правило, длятся 3-10 дней,затем боли исчезают, кожа становится нормальной, отек исчезает, функция сустава восстанавливается полностью. Следующий приступ наступает через какое-товремя (иногда через месяцы, даже годы), но с течением времени светлыепромежутки укорачиваются. Во время приступа увеличены СОЭ, уровень в крови сиаловых кислот, фибрина,серомукоида, появляется С-реактивный протеин.Для первого приступа подагры у мужчин характерны моноартрит и преимущественное поражение суставов стопы(суставов большого пальца,плюснефаланговых, предплюсневых и др.). Менее типично воспаление локтевых, лучезапястных суставов и очень редко поражаются плечевые, грудинно-ключичные, тазобедренные суставы. У женщин нередко можетнаблюдаться олиго- или полиартрит и более часто во времяпервого приступа вовлекаются суставы кисти (у Узбольных).
В некоторых случаях первым признаком болезни могут бытьпоражения суставов плюсны, голеностопного, коленного, луче-запястного, реже — мелкихсуставовкисти.
2. Подострая форма может протекать в виде моноартрита типичной локализации в суставах большого пальца, но с незначительной болью и умеренными экссудативнымиявлениями. Возможен подострый моно-, олигоартрит крупных и средних суставов у молодых людей.
3. Ревматоидноподобный вариант характеризуется первичным поражением мелких суставов кистей, лучезапястных суставов или моно-, олигоартритом при затяжном течении приступа.
4. Псевдофлегмонозная форма проявляется моноартритом любой локализации с резко выраженными воспалительными явлениями в области сустава и окружающих тканей с высокойтемпературой тела, ознобом, лейкоцитозом, увеличением СОЭ— т. е. клиникасходна с клинической картиной флегмоны илиострого инфекционного артрита.
5. Подагра, протекающая по типу инфекционно-аллергического полиартрита (в 5% случаев) может дебютировать какмигрирующий полиартрит с быстрым обратным развитием воспалительных явлений, что напоминает инфекционно-аллергическийполиартрит.
6. Малосимптомная форма.Отмечается лишь небольшая боль, изредка с легкой гиперемией кожи в области пораженного сустава.
7. Пгриартритическая форма — с локализацией процесса всухожилиях и бурсах (чаще всего в пяточном сухожилии с егоуплотнением и утолщением) при интактных суставах.
Римские диагностические критерии (1963)
1. Содержание мочевой кислоты в крови, превышающее 0.42 ммоль/л (7 мг%) у мужчин и 0.36 ммоль/л (6 мг%) уженщин.
2. Наличие тофусов.
3. Наличие кристаллов моче кислого натрия в синовиальнойжидкости или отложений мочекислых солей в тканях, обнаруженное при химическом или микроскопическом исследовании.
4. Четкие анамнестические сведения о пораженных суставах(опухание с приступами болей). Эти приступы на ранних этапах должны характеризоваться внезапным началом острых болей и полной клинической ремиссией, наступающей через1-2 нед.
Диагноз считается определенным, если положительны 2 критерия.
Диагностические критерии (АРА)
I. Наличие характерных кристаллических уратов в суставнойжидкости и/или
II. Наличие тофусов (доказанных), содержащих кристаллические ураты, подтвержденные химически или поляризационной микроскопией, и/или
III. Наличие 6 из 12 ниже представленных признаков:
1) более чем одна острая атака артрита в анамнезе;
2) максимум воспаления сустава уже в первые сутки;
3) моноартикулярный характер артрита;
4) гиперемия кожи над пораженным суставом;
5) припухание или боль, локализованные в I плюснефаланговом суставе;
6) одностороннее поражение суставов свода стопы;
7) узелковые образования, напоминающие тофусы;
8) гиперурикемия;
9) одностороннее поражение I плюснефалангового сустава;
10) асимметричное припухание пораженного сустава;
11) обнаружение на рентгенограммах субкортикальных кист без эрозий;
12) отсутствие флоры в суставной жидкости.
Комбинация из 6 и более признаков подтверждает диагноз.
Тофусы(подагрическиеузлы) — специфичный признак подагры — образуются при высокой гиперурикемии и длительности заболевания свыше 5-6 лет. Тофусы — это узелки, содержащие ураты, окруженные соединительной тканью. Локализуются чащевсего на ушных раковинах, локтях, в бурсах локтевых суставов,стопах, на пальцах кистей, разгибательной поверхности предплечий, бедер, голеней, на лбу, в области хрящевой перегородки носа.
Узелки желтоватого цвета, их содержимое при приступах можетразжижаться и выделяться через свищи, но инфицируются они редко (ураты обладают бактерицидным эффектом), отделяемоебелого цвета.
Почечнокаменная болезнь возникает у 40% больных (проявляется почечной коликой обычно на фоне суставной подагрической атаки, может осложняться пиелонефритом), подагрическаянефропатия — подагрический интерстициальный нефрит (изостенурия, микрогематурия, протеинурия, цилиндрурия, артериальнаягипертензия, в дальнейшем ХПН) — у 30% больных.
studfile.net
причины, симптомы, диагностика и лечение

Подагрический артрит хроническое воспаление суставов, которое развивается в результате нарушения обмена пуринов.
Мочевая кислота, накапливающаяся в организме, со временем откладывается в стопе и внутренних органах. Для данной патологии характерно формирование подагрических узелков, которые носят название тофусы.
Подагра известна очень давно, название произошло из глубокой древности, в нем объединились два понятия: pus, то есть стопа и agra, то есть захват. Получается, что подагрический артрит развивается исключительно на стопе. Однако не стоит забывать, что это системное заболевание, которое поражает внутренние органы, в частности, почки.
«
Заболеваемость подагрой у мужчин и у женщин соответственно составляет 9:1.»
Такое сильное гендерное различие связано с тем, что у мужчин уровень мочевой кислоты гораздо более высокий. У женщин эти показатели сравниваются в период постменопаузы, поэтому для мужчин разгар подагрического артрита приходится на 35-50 лет, а у женщин на возраст старше 55 лет.
Причины и симптомы подагрического артрита
Мочевая кислота образуется при распаде пуринов и у здорового человека выводится почками. При высоком уровне мочевой кислоты происходит отложение урата натрия. Нарушение синтеза пуринов может происходить по различным причинам:
- В результате наследственной предрасположенности;
- При хронических лейкозах;
- При анемии;
- Эритроцитозах;
- При гемоглобинопатиях;
- При различных соматических заболеваниях: онкология, СКВ, ожирение, мононуклеоз, ХПН…;
- При интоксикации некоторыми лекарственным средствами: этанолом, фруктозой, варфарином, никотиновой кислотой.
Причин развития подагрического артрита множество. И их выявление важно для составления рациональной тактики лечения заболевания. Однако клиническая картина зависит от уровня мочевой кислоты в организме. По этому показателю можно составить классификацию заболевания:
- Гиперурикозурию, когда нет клинических проявлений болезни, но в анализах определяется повышенный уровень мочевой кислоты;
- Межприступный период;
- Острый подагрический артрит;
- Хроническая форма.
Симптомы подагры настолько явные и являются характерными для данного заболевания, что по ним согласно “Американской коллегии ревматологов” правомочно диагностировать подагру, если присутствует шесть различных симптомов:

- Монопоражение сустава;
- Наличие нескольких атак подагрического артрита;
- Острый воспалительный процесс, развивающийся в первые сутки;
- Покраснение кожи в области сустава;
- Боль I сустава большого пальца;
- Образования, похожие на тофусы;
- Гиперурикемия;
- Стерильности при исследовании суставной жидкости;
- Припухлость сустава;
- Ассиметричность поражения.
Заболевание постоянно прогрессирует, при этом между приступами может проходить до двух лет. Затем начинают поражаться другие суставы. Через несколько лет появляются тофусы поверх суставного хряща. По своей сути это кристаллы мочевой кислоты, отложившейся на суставе. Тофусы могут также появляться и во внутренних органах.
«
Вопреки распространенному мнению, в детском возрасте также развивается подагра.»
Лечение подагрического артрита
Лечение подагрического артрита преследует следующие цели:
- Необходимо купировать болевой синдром;
- Снизить количество уратов;
- Терапию одновременно осуществлять и самого артрита и органных проявлений.
Для выполнения этих задач назначают НПВП, противовоспалительные препараты, кортикостероиды. Обязательно проводится основное противоподагрическое лечение, которое снижает количество мочевой кислоты в крови. Все препараты этой группы делятся на уриколитики, которые расщепляют ураты, урикозурические – выводят ураты, и урикодпрессивные лекарственные средства, которые снижают продукцию мочевой кислоты.
Диета при подагрическом артрите
Несмотря на эффективность консервативной терапии, основным в лечении подагрического артрита остается диета. Необходимо частое и дробное питание, ограничение поступления животных жиров. Строго противопоказано употребление алкоголь содержащих напитков. Нельзя употреблять печень, шпроты, сельдь, жирное мясо, бульоны, горох, почки, шпинат.
Только соблюдение строгой диеты в сочетании с консервативной терапией позволяет снизить уровень мочевой кислоты, а значит – замедлить прогрессирование процесса.
Вернуться к списку
www.dikul.org











 Психосоматика травмы рук отражена в привычных устойчивых выражениях. В ситуации беспомощности мы говорим: *Как без рук*. А когда мы принимаем волевое решение действовать, то говорим, что *берем бразды правления в свои руки*. Она связана с нашей (не)способностью действовать , (не)участвовать, с отношением к себе (не)любимому. Психосоматика большого пальца правой руки проявляется в жесте одобрения (палец вверх-”круто”) или неодобрения (палец вниз — “отстой”), которым мы награждаем тех, кого оцениваем . А психосоматика травмы большого пальца правой руки связана с тем, как мы оцениваем себя. Этот перст указует нам на самих себя относительно других! Посмотрите, как он отличается от остальных пальцев на руке: у него две фаланги, а не три, и стоит большой палец особняком ото всех.
Психосоматика травмы рук отражена в привычных устойчивых выражениях. В ситуации беспомощности мы говорим: *Как без рук*. А когда мы принимаем волевое решение действовать, то говорим, что *берем бразды правления в свои руки*. Она связана с нашей (не)способностью действовать , (не)участвовать, с отношением к себе (не)любимому. Психосоматика большого пальца правой руки проявляется в жесте одобрения (палец вверх-”круто”) или неодобрения (палец вниз — “отстой”), которым мы награждаем тех, кого оцениваем . А психосоматика травмы большого пальца правой руки связана с тем, как мы оцениваем себя. Этот перст указует нам на самих себя относительно других! Посмотрите, как он отличается от остальных пальцев на руке: у него две фаланги, а не три, и стоит большой палец особняком ото всех. Приглашаем вас на бесплатный вебинар Константина Довлатова «Как жизненные кризисы превращать в ресурсы«.
Приглашаем вас на бесплатный вебинар Константина Довлатова «Как жизненные кризисы превращать в ресурсы«. Важно понимать, что речь идет о субъективном восприятии, то есть о том, как именно воспринимает других или событие человек, у которого возникла Специальная Биологическая Программа. Психсоматика при травмах пальцев рук проявляется часто у перфекционистов и сопровождается убеждениями в том, что человек что-то делает недостаточно хорошо, быстро, ловко. В результате травм пальцев рук работоспособность человека ограничена , тонкая моторика затруднена или блокирована, рука теряет былую силу.
Важно понимать, что речь идет о субъективном восприятии, то есть о том, как именно воспринимает других или событие человек, у которого возникла Специальная Биологическая Программа. Психсоматика при травмах пальцев рук проявляется часто у перфекционистов и сопровождается убеждениями в том, что человек что-то делает недостаточно хорошо, быстро, ловко. В результате травм пальцев рук работоспособность человека ограничена , тонкая моторика затруднена или блокирована, рука теряет былую силу.  Когда нам нужно на что-то надавить или нечто продавить, удобнее всего это сделать большим пальцем руки, согласитесь. Соответственно, большой палец связан с тем, как человек умеет давить, сопротивляться или не умеет этого делать. В древности кольца на большом пальце имели право носить только жрецы. А сейчас так носят кольца молодые люди, которые демонстрируют свою отдельность и непохожесть на других. Луиза Хэй в книге «Исцели себя сам» соотносит большой палец с интеллектом и беспокойством. А ее исцеляющая аффирмация звучит так: *в моей душе мир и спокойствие*.
Когда нам нужно на что-то надавить или нечто продавить, удобнее всего это сделать большим пальцем руки, согласитесь. Соответственно, большой палец связан с тем, как человек умеет давить, сопротивляться или не умеет этого делать. В древности кольца на большом пальце имели право носить только жрецы. А сейчас так носят кольца молодые люди, которые демонстрируют свою отдельность и непохожесть на других. Луиза Хэй в книге «Исцели себя сам» соотносит большой палец с интеллектом и беспокойством. А ее исцеляющая аффирмация звучит так: *в моей душе мир и спокойствие*. 
 Отвары из трав и плодов, природных анальгетиков, которые заживляют раны и снимают боль: ромашка, валериана, зверобой, полевой хвощ, шиповник. Принимать 3-5 раз в день по полстакана.
Отвары из трав и плодов, природных анальгетиков, которые заживляют раны и снимают боль: ромашка, валериана, зверобой, полевой хвощ, шиповник. Принимать 3-5 раз в день по полстакана. ©Kamille Corry
©Kamille Corry





















 Хондроз – это болезнь, поражающая межпозвоночные диски. Основная опасность при хондрозе – грыжа межпозвонкового диска, которая ведет к снижению подвижности спины, защемлению сосудов и нервов. Если операция еще не требуется (а требуется она редко), то заболевание лечат консервативными методами: медикаменты и физиопроцедуры.
Хондроз – это болезнь, поражающая межпозвоночные диски. Основная опасность при хондрозе – грыжа межпозвонкового диска, которая ведет к снижению подвижности спины, защемлению сосудов и нервов. Если операция еще не требуется (а требуется она редко), то заболевание лечат консервативными методами: медикаменты и физиопроцедуры. Как делать:
Как делать: Периостальный массаж – это смесь точечного массажа и мануальной терапии. Суть в том, что нужно воздействовать на кость рядом с поврежденным местом.
Периостальный массаж – это смесь точечного массажа и мануальной терапии. Суть в том, что нужно воздействовать на кость рядом с поврежденным местом. Банки, некогда столь популярные в СССР, сейчас выходят из моды ввиду низкой эффективности, но баночная мануальная терапия все еще имеет право жить. Для него потребуются: банка, массажное масло, свеча.
Банки, некогда столь популярные в СССР, сейчас выходят из моды ввиду низкой эффективности, но баночная мануальная терапия все еще имеет право жить. Для него потребуются: банка, массажное масло, свеча.








 Массаж с разогревающим средством облегчит болевые ощущения.
Массаж с разогревающим средством облегчит болевые ощущения. Массажер повышает кругооборот лимфы и крови.
Массажер повышает кругооборот лимфы и крови. Технически правильно выполненная процедура снимет спазм мышц и болевые ощущения в спине.
Технически правильно выполненная процедура снимет спазм мышц и болевые ощущения в спине. Приспособление стимулировать акупунктурные точки.
Приспособление стимулировать акупунктурные точки.




































 Активное вещество в составе Нурофена – ибупрофен, производное от фенилпропионовой кислоты. При приеме внутрь подавляет образование простагландинов – веществ, вызывающих воспалительную реакцию в организме человека (т.н. медиаторы воспаления), за счет чего возникает противовоспалительный, обезболивающий и жаропонижающий эффект.
Активное вещество в составе Нурофена – ибупрофен, производное от фенилпропионовой кислоты. При приеме внутрь подавляет образование простагландинов – веществ, вызывающих воспалительную реакцию в организме человека (т.н. медиаторы воспаления), за счет чего возникает противовоспалительный, обезболивающий и жаропонижающий эффект. Отзывы о Нурофене со стороны как врачей, так и пациентов свидетельствуют, что при применении строго по инструкции он переносится хорошо, и побочные эффекты после его применения случаются редко. Известны следующие побочные действия препарата:
Отзывы о Нурофене со стороны как врачей, так и пациентов свидетельствуют, что при применении строго по инструкции он переносится хорошо, и побочные эффекты после его применения случаются редко. Известны следующие побочные действия препарата:








 При переломах ребра проявляется выраженная симптоматика, которая свидетельствует о явном нарушении целостности кости:
При переломах ребра проявляется выраженная симптоматика, которая свидетельствует о явном нарушении целостности кости: Незначительные повреждения с подозрением на перелом или трещину ребра приведут к тому, что больной будет постоянно испытывать болезненные ощущения в месте ушиба. Резкие и сильные боли будут отмечаться при попытках выпрямиться, а также при вдохах и движении. В этом случае наиболее информативный способ инструментального обследования – рентгенография.
Незначительные повреждения с подозрением на перелом или трещину ребра приведут к тому, что больной будет постоянно испытывать болезненные ощущения в месте ушиба. Резкие и сильные боли будут отмечаться при попытках выпрямиться, а также при вдохах и движении. В этом случае наиболее информативный способ инструментального обследования – рентгенография.

 Единичные переломы без смещения лечат консервативным путем, без оперативного вмешательства. Противопоказаны тугие повязки и увязывания, а также накладывание гипса, в противном случае возрастает вероятность развития застойной пневмонии. Первые дни после получения травмы требуется строго соблюдать постельный режим.
Единичные переломы без смещения лечат консервативным путем, без оперативного вмешательства. Противопоказаны тугие повязки и увязывания, а также накладывание гипса, в противном случае возрастает вероятность развития застойной пневмонии. Первые дни после получения травмы требуется строго соблюдать постельный режим.
 Крепится ребро головкой к грудным позвонкам, которые имеют полуямки для них. За головкой следует шейка, после которой находится бугорок, он крепится при помощи сустава к поперечному отростку. Далее ребро имеет тело, оно плоское, сверху край закруглен, а внизу проходит бороздка ребра на всем протяжении. В бороздке находится сосудисто-нервный пучок.
Крепится ребро головкой к грудным позвонкам, которые имеют полуямки для них. За головкой следует шейка, после которой находится бугорок, он крепится при помощи сустава к поперечному отростку. Далее ребро имеет тело, оно плоское, сверху край закруглен, а внизу проходит бороздка ребра на всем протяжении. В бороздке находится сосудисто-нервный пучок.

 Как определить, ушиб или перелом ребра возник у человека вследствие травмы? Очень просто. Основным методом диагностики является рентгенологическое исследование. На снимках врач определяет наличие перелома, степень смещения отломков. В зависимости от результатов назначается соответствующее лечение.
Как определить, ушиб или перелом ребра возник у человека вследствие травмы? Очень просто. Основным методом диагностики является рентгенологическое исследование. На снимках врач определяет наличие перелома, степень смещения отломков. В зависимости от результатов назначается соответствующее лечение. Тактика ведения больных с переломами и ушибами значительно отличается. При нарушении целостности костей главной задачей является сопоставление отломков и надежная фиксация. Если консервативным путем это сделать не удалось, показана операция. В лечении ушибов важную роль играет адекватное обезболивание, симптоматическая терапия.
Тактика ведения больных с переломами и ушибами значительно отличается. При нарушении целостности костей главной задачей является сопоставление отломков и надежная фиксация. Если консервативным путем это сделать не удалось, показана операция. В лечении ушибов важную роль играет адекватное обезболивание, симптоматическая терапия.
 Период реабилитации при ушибе и переломе ребер отличается только по длительности. В первом случае уже через 2-3 дня можно посещать физиопроцедуры. При переломе первые несколько недель запрещены любые упражнения и физическая нагрузка. Дыхательная гимнастика выполняется с первых дней после получения травмы, в остром периоде в щадящем режиме. Чтобы образовалась костная мозоль, необходимо время. Слишком ранняя нагрузка может привести к повторному смещению отломков. Полное восстановление работоспособности зависит от вида и степени тяжести перелома, в среднем занимает до 1 месяца. При ушибе период реабилитации длится не больше 3 недель.
Период реабилитации при ушибе и переломе ребер отличается только по длительности. В первом случае уже через 2-3 дня можно посещать физиопроцедуры. При переломе первые несколько недель запрещены любые упражнения и физическая нагрузка. Дыхательная гимнастика выполняется с первых дней после получения травмы, в остром периоде в щадящем режиме. Чтобы образовалась костная мозоль, необходимо время. Слишком ранняя нагрузка может привести к повторному смещению отломков. Полное восстановление работоспособности зависит от вида и степени тяжести перелома, в среднем занимает до 1 месяца. При ушибе период реабилитации длится не больше 3 недель.


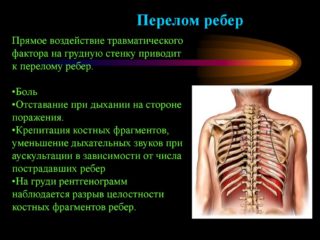
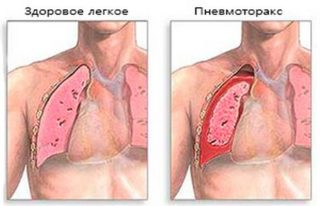

 Для возможности узнать о характере поражения необходимо пойти к врачу ортопеду-травматологу. Специалист на основании клинической картины назначит следующие методики инструментального исследования для визуализации изменений:
Для возможности узнать о характере поражения необходимо пойти к врачу ортопеду-травматологу. Специалист на основании клинической картины назначит следующие методики инструментального исследования для визуализации изменений:
















 В большинстве случаев переломы пальца ноги не сопровождаются повреждением кожных покровов, то есть, являются закрытыми.
В большинстве случаев переломы пальца ноги не сопровождаются повреждением кожных покровов, то есть, являются закрытыми. Открытую рану следует обработать раствором антисептика и наложить на нее стерильную повязку.
Открытую рану следует обработать раствором антисептика и наложить на нее стерильную повязку. Лечебная физкультура помогает восстановить функции поврежденного пальца.
Лечебная физкультура помогает восстановить функции поврежденного пальца. Загрузка…
Загрузка… 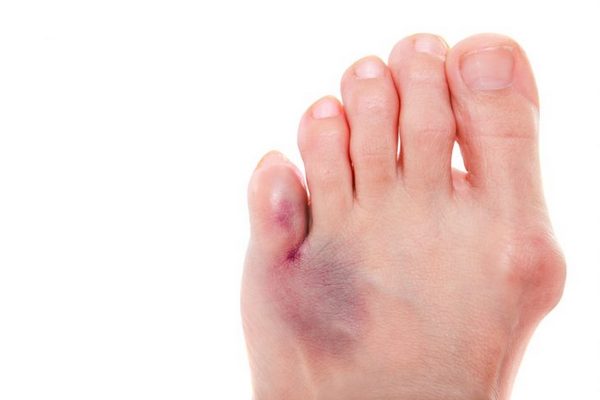
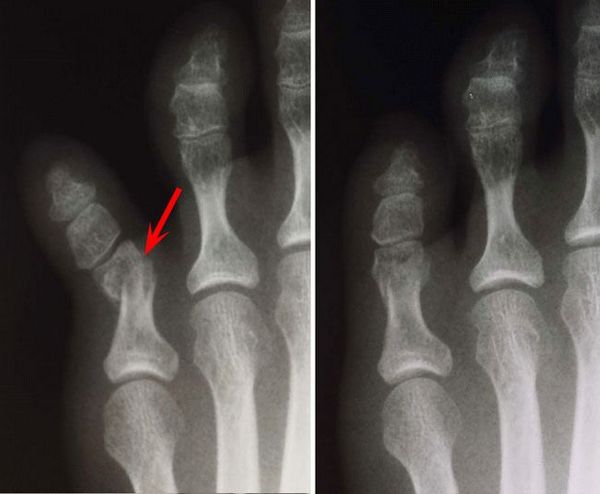
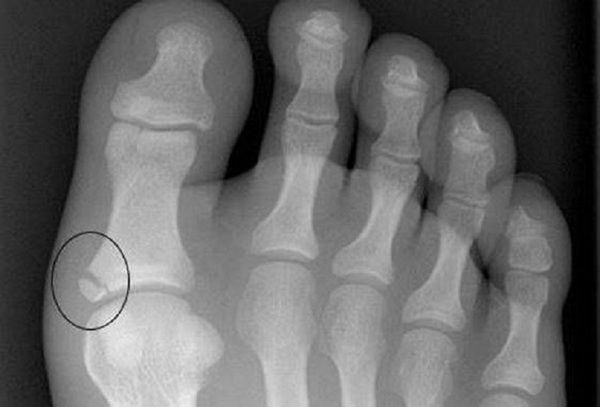
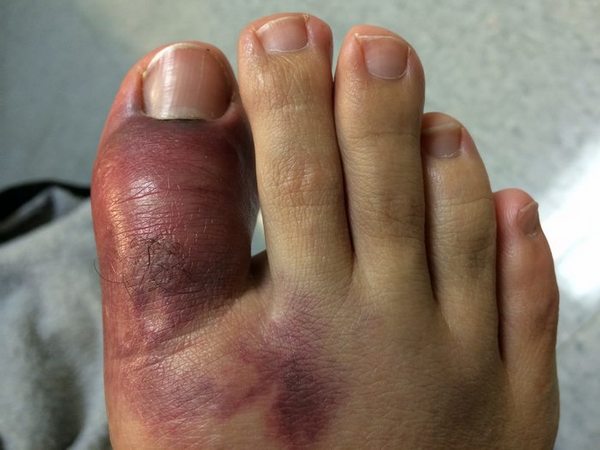
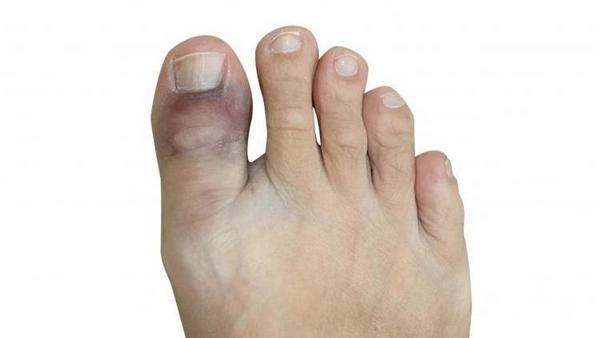






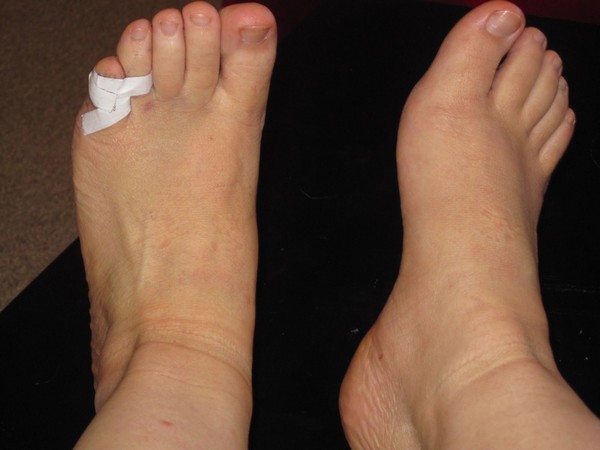

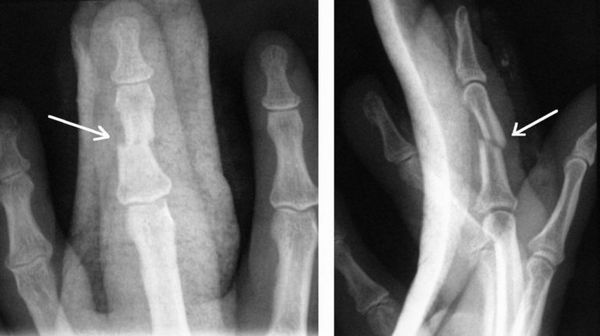

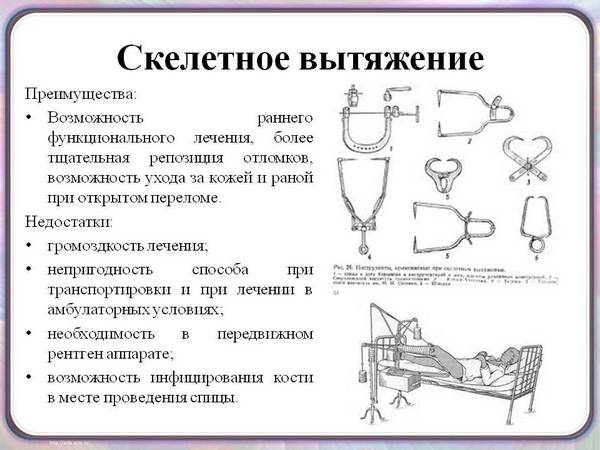


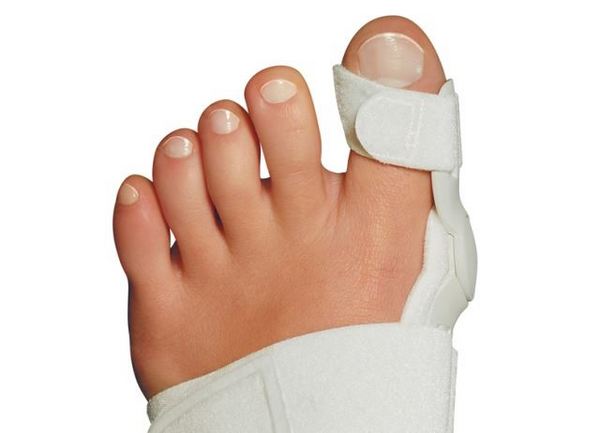
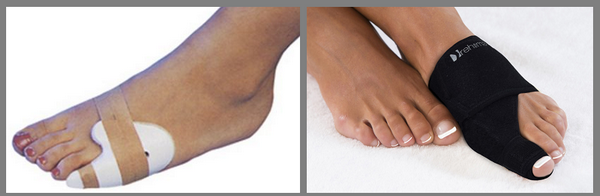











 полными;
полными;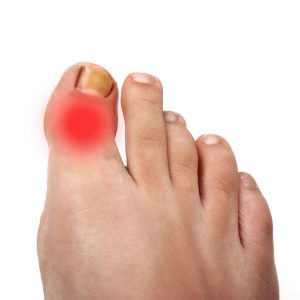 В число абсолютных признаков, явно свидетельствующих о произошедшем переломе, входит наличие хруста, возникающего при пальпации пальца, попытках подвигать им, изменение его конфигурации.
В число абсолютных признаков, явно свидетельствующих о произошедшем переломе, входит наличие хруста, возникающего при пальпации пальца, попытках подвигать им, изменение его конфигурации. Клиническая картина перелома может напоминать вывих пальца, поэтому для дифференцирования необходимо провести рентгенологическое исследование. По назначению специалиста оно может осуществляться в двух проекциях, благодаря чему можно более точно визуализировать присутствующие повреждения, определяя их характер. Например, на рентгеновском снимке можно увидеть, произошло ли смещение отломков или нет.
Клиническая картина перелома может напоминать вывих пальца, поэтому для дифференцирования необходимо провести рентгенологическое исследование. По назначению специалиста оно может осуществляться в двух проекциях, благодаря чему можно более точно визуализировать присутствующие повреждения, определяя их характер. Например, на рентгеновском снимке можно увидеть, произошло ли смещение отломков или нет. Необходимо в первую очередь остановить кровотечение, если оно присутствует, провести антисептическую обработку образовавшихся раневых поверхностей.
Необходимо в первую очередь остановить кровотечение, если оно присутствует, провести антисептическую обработку образовавшихся раневых поверхностей. Загрузка…
Загрузка…  перелом пальца на ноге
перелом пальца на ноге перелом пальца, первая помощь
перелом пальца, первая помощь лечение перелома
лечение перелома Мать-и-мачеха настой, свойства и противопоказания
Мать-и-мачеха настой, свойства и противопоказания Настои цветков липы, от кашля, потогоное средство
Настои цветков липы, от кашля, потогоное средство Лечение ран народными средствами
Лечение ран народными средствами Применение шрота расторопши, польза и вред правила приема
Применение шрота расторопши, польза и вред правила приема Масло расторопши, применение в косметологии, медицине
Масло расторопши, применение в косметологии, медицине Алоэ древовидное (столетник), сок алоэ и спиртовая настойка
Алоэ древовидное (столетник), сок алоэ и спиртовая настойка Алоэ вера: использование и польза
Алоэ вера: использование и польза Кориандр (кинза) польза, применение кориандра и вред
Кориандр (кинза) польза, применение кориандра и вред Василек синий, настой василька, василек противопоказания
Василек синий, настой василька, василек противопоказания Льнянка обыкновенная, львиный зев, женский лен
Льнянка обыкновенная, львиный зев, женский лен Расторопша пятнистая, шрот и масло применение
Расторопша пятнистая, шрот и масло применение Ромашка аптечная (лекарственная) настой и противопоказания
Ромашка аптечная (лекарственная) настой и противопоказания

 средство нового поколения, позволяющее восстановить нарушенную структуру хрящевой ткани. Дистрофические изменения в суставах провоцируются разными факторами:
средство нового поколения, позволяющее восстановить нарушенную структуру хрящевой ткани. Дистрофические изменения в суставах провоцируются разными факторами:
 для наружного применения можно применять капсулы Хондроитин-АКОС. Их принимают во время или после еды, запивая достаточным объемом жидкости. Разовая доза составляет 2 таблетки. Продолжительность приема варьируется в зависимости от диагноза, общего состояния пациента. Лечение длится не менее месяца, профилактические дозировки можно использовать в течение полугода.
для наружного применения можно применять капсулы Хондроитин-АКОС. Их принимают во время или после еды, запивая достаточным объемом жидкости. Разовая доза составляет 2 таблетки. Продолжительность приема варьируется в зависимости от диагноза, общего состояния пациента. Лечение длится не менее месяца, профилактические дозировки можно использовать в течение полугода.

 серьезные поражения хрящевой ткани – это заболевания, которые постоянно «молодеют». Врачи знают об этом, поэтому настаивают на периодических диагностических обследованиях и приеме лекарственных средств на основе хондроитина. Такой подход позволяет замедлить дегенеративные процессы.
серьезные поражения хрящевой ткани – это заболевания, которые постоянно «молодеют». Врачи знают об этом, поэтому настаивают на периодических диагностических обследованиях и приеме лекарственных средств на основе хондроитина. Такой подход позволяет замедлить дегенеративные процессы.
 Периоды развития женщины
Периоды развития женщины Внутренние половые органы женщины
Внутренние половые органы женщины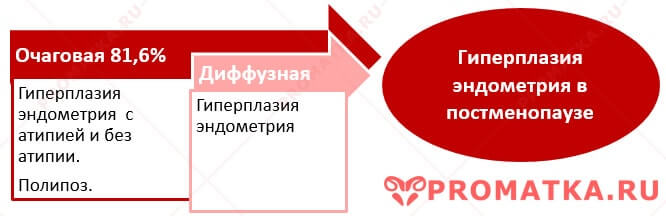 Структура гиперпластических процессов эндометрия в постменопаузе
Структура гиперпластических процессов эндометрия в постменопаузе Гиперплазия эндометрия — факторы риска
Вернуться к оглавлению
Гиперплазия эндометрия — факторы риска
Вернуться к оглавлению Лечение гиперплазии эндометрия в старшем возрасте
Лечение гиперплазии эндометрия в старшем возрасте















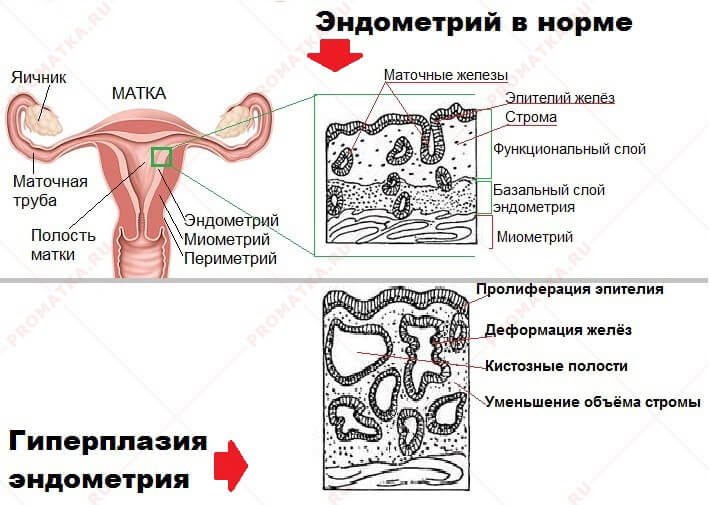 Эндометрий: строение, гиперплазия
Эндометрий: строение, гиперплазия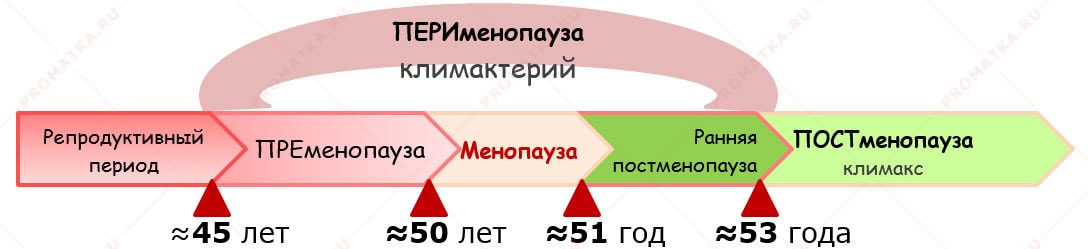 Периоды жизни женщины
Периоды жизни женщины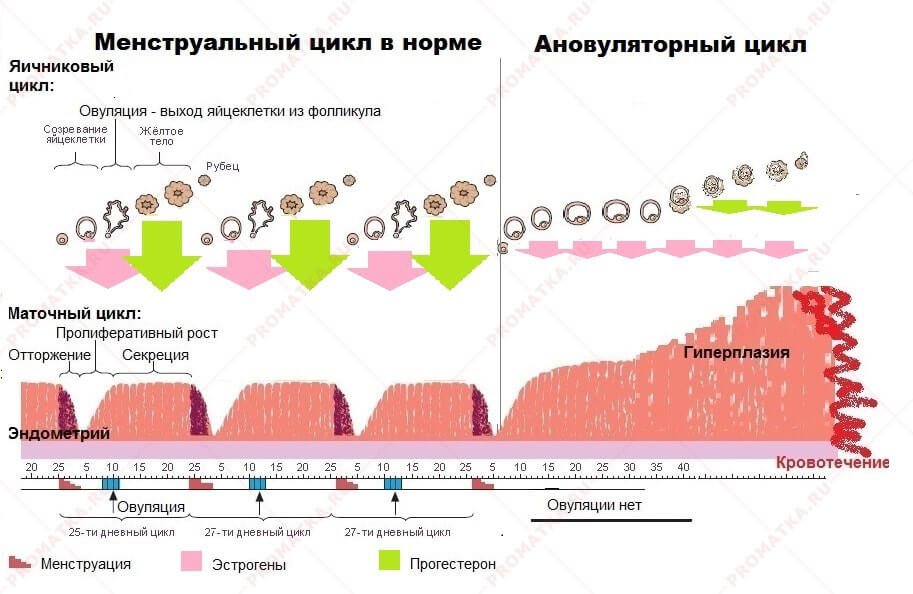 Ановуляторный менструальный цикл
Ановуляторный менструальный цикл Лишний вес в менопаузе
Лишний вес в менопаузе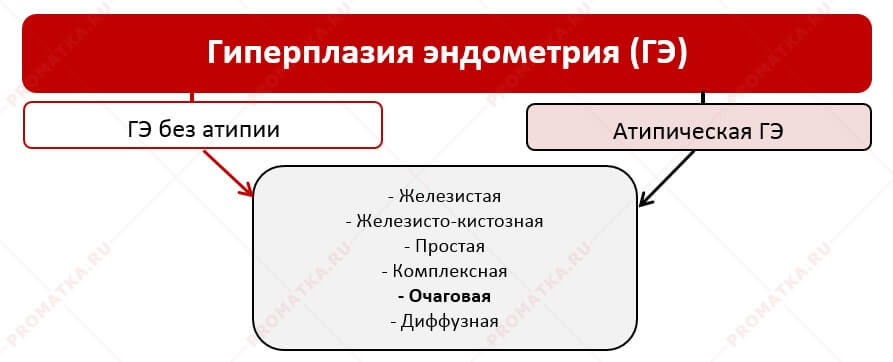 Классификация гиперплазии эндометрия
Классификация гиперплазии эндометрия Диагностическое выскабливание матки
Диагностическое выскабливание матки Последовательность лечения гиперплазии эндометрия
Последовательность лечения гиперплазии эндометрия Занятие в спортзале
Занятие в спортзале Менопауза для женщины является естественным процессом. В это время постепенно угасают репродуктивные функции: прекращаются месячные, регенерируют все половые органы, меняется гормональный фон, наступает бесплодие.
Менопауза для женщины является естественным процессом. В это время постепенно угасают репродуктивные функции: прекращаются месячные, регенерируют все половые органы, меняется гормональный фон, наступает бесплодие.












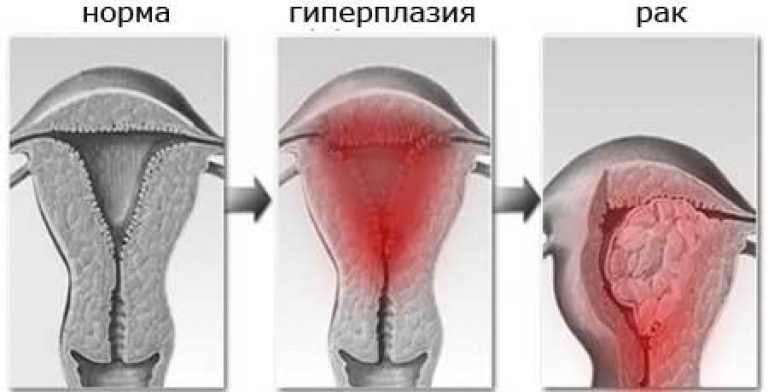
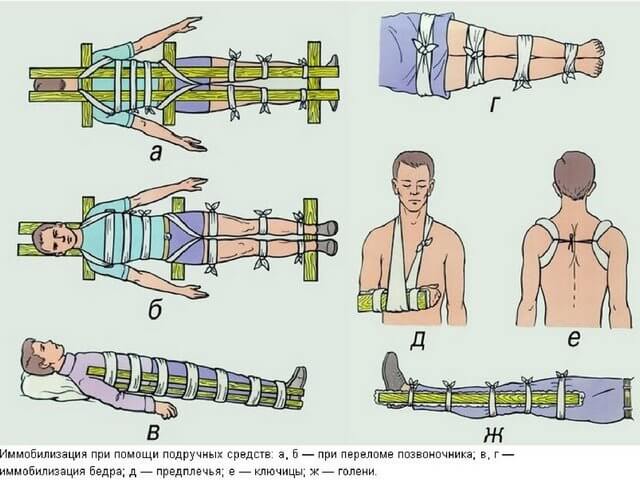
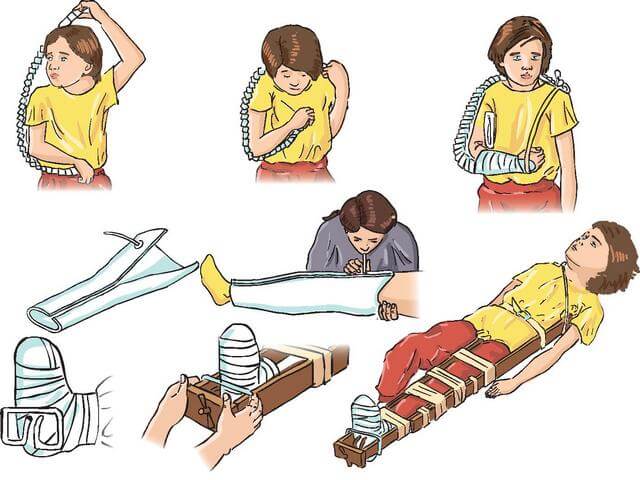
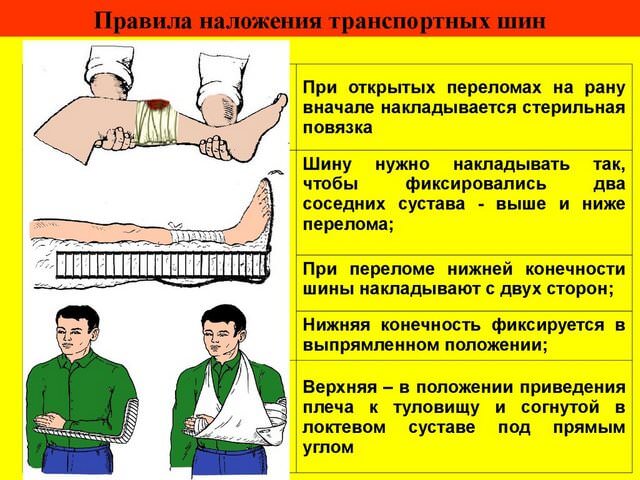
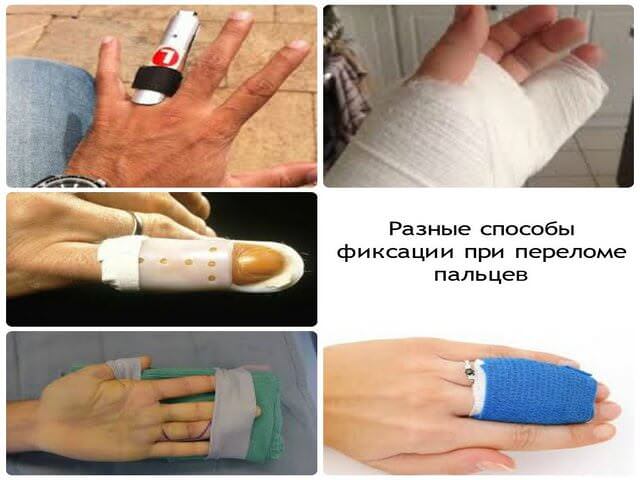



 о
время манипуляции вежливо общайтесь с
больным, поясняя ему ваши действия.
Проявляйте доброту и милосердие к нему.
о
время манипуляции вежливо общайтесь с
больным, поясняя ему ваши действия.
Проявляйте доброту и милосердие к нему. щательно
смоделируйте участок шины, прилегающей
к плечевому суставу. Для этого шину
согните под углом 115о и несколько закрутите по оси, чтобы она
плотно прилегла к плечевому суставу и
повторяла форму межлопаточного
пространства, заканчиваясь у края
противоположной лопатки;
щательно
смоделируйте участок шины, прилегающей
к плечевому суставу. Для этого шину
согните под углом 115о и несколько закрутите по оси, чтобы она
плотно прилегла к плечевому суставу и
повторяла форму межлопаточного
пространства, заканчиваясь у края
противоположной лопатки; ею
и надплечье защитите ватно-марлевыми
прокладками.
ею
и надплечье защитите ватно-марлевыми
прокладками.