Дисплазия пищевода что это – Пищевод Баррета, дисплазия и рак пищевода
Пищевод Баррета, дисплазия и рак пищевода
Наиболее серьезным осложнением ГЭРБ является пищевод Баррета (метаплазия Баррета), заболевание, являющееся фактором риска развития рака пищевода (аденокарциномы). Перерождение клеток слизистой оболочки при пищеводе Баррета происходит по типу так называемой кишечной метаплазии, когда обычные клетки слизистой оболочки пищевода замещаются клетками, характерными для слизистой оболочки кишечника.
Кишечная метаплазия может перейти в дисплазию (метаплазия и дисплазия – последовательные по нарастающей тяжести изменений процессы перерождения клеток) и затем развиться в злокачественную опухоль. Поэтому метаплазия Баррета является предраковым состоянием, хотя рак пищевода – довольно редкое заболевание, больше распространенное среди мужчин. Распространенность пищевода Баррета среди взрослого населения составляет 8-10%.
Кроме собственно рефлюксной болезни независимым фактором риска развития аденокарциномы пищевода является ожирение. При наличии обоих факторов риск развития аденокарциномы значительно повышается. Однако абсолютный риск аденокарциномы остается достаточно низким даже у людей с выраженными симптомами рефлюкса.
В зависимости от участка пищевода, где развивается метаплазия Баррета (и затем, возможно, аденокарцинома), специалисты разделяют это заболевание на три типа: метаплазия в области длинного сегмента пищевода, метаплазия в области короткого сегмента пищевода (в 3 см и менее от места перехода пищевода в желудок) и метаплазия в области кардиальной части желудка (часть желудка, расположенная сразу после перехода пищевода в желудок).
Распространенность метаплазии Баррета в области длинного сегмента пищевода по данным эндоскопических исследований составляет около 1%. Этот процент возрастает с увеличением тяжести ГЭРБ. Этот тип метаплазии чаще встречается в возрасте 55-65 лет, значительно чаще у мужчин (соотношение мужчин и женщин 10:1).
Метаплазия Баррета в области короткого сегмента встречается чаще, однако, распространенность этого заболевания оценить сложно, так как этот тип метаплазии при эндоскопическом исследовании сложно отличить от метаплазии в кардиальном отделе желудка. При этом злокачественная опухоль при метаплазии в области короткого сегмента пищевода и кардиальной части желудка развивается реже, чем при метаплазии в области длинного сегмента пищевода.
Хотя совершенно очевидно, что метаплазия Баррета в пищеводе возникает на фоне ГЭРБ и иногда приводит к развитию рака пищевода, остается не совсем ясно, почему происходит перерождение клеток по типу кишечной метаплазии в области кардиальной части желудка. Этот тип метаплазии встречается как при ГЭРБ, так и при гастрите при наличии инфекции Helicobacter pylori. Причем согласно данным исследований, метаплазия Баррета с области кардиальной части желудка, скорее всего, развивается на фоне гастрита даже чаще, чем на фоне ГЭРБ. Однако кишечная метаплазия и воспаление в этой области могут появиться и в отсутствии Helicobacter pylori, и в этом случае являться следствием хронического рефлюкса. Распространенность этого типа метаплазии составляет 1,4%.
Хотя непосредственная причина метаплазии Баррета остается неясной, тем не менее, очевидным является тот факт, что метаплазия развивается на фоне ГЭРБ и связана с чрезмерным патологическим воздействием кислоты на слизистую оболочку пищевода. Исследования с использованием рН-мониторирования показали, что у пациентов с метаплазией Баррета значительно увеличена частота рефлюксов и продолжительность пищеводного клиренса. Это может быть связано с выраженным нарушением сократительной функции мышц пищевода, развивающимся вследствие тяжелого эзофагита. Кроме того, у большинства пациентов с тяжелым эзофагитом имеется грыжа пищеводного отверстия диафрагмы.
Кроме того, манометрические измерения в области длинного сегмента пищевода при метаплазии Баррета показали, что при этом имеется снижение тонуса нижнего пищеводного сфинктера и нарушение перистальтики, сходные с таковыми при тяжелом эзофагите. Остается неясным, почему у одних пациентов с выраженным эзофагитом развивается метаплазия Баррета, а у других – нет. Существует предположение, что определенное значение имеет генетическая предрасположенность.
Пищевод Баррета – Наблюдение и лечение
В терапии больных с пищеводом Баррета основное внимание уделяется двум моментам: лечению ГЭРБ, на фоне которой развилась метаплазия, и предотвращение развития аденокарциномы пищевода. Принципы лечения имеющегося эзофагита и метаплазии Баррета остаются такими же, как и при обычной ГЭРБ, с учетом того, что поскольку имеется более выраженное воздействие кислоты на слизистую оболочку пищевода, терапия должна быть более интенсивной. Обычно бывает достаточно назначения ингибиторов протонной помпы, однако, может потребоваться и хирургическое вмешательство в случае неэффективности медикаментозного лечения.
Некоторые специалисты, основываясь на данных исследований, которые показали, что клеточные изменения происходят именно за счет патологического воздействия кислоты на слизистую оболочку желудка, предлагают использовать для лечения пищевода Баррета препараты, подавляющие секрецию соляной кислоты в желудке. Однако клинически не доказано, что применение антисекреторных препаратов или антирефлюксная операция могут предотвратить развитие аденокарциномы пищевода или привести к обратному развитию кишечной метаплазии. Таким образом, основной целью лечения является терапия эзофагита..
Поскольку в настоящее время не известны пути предотвращения развития метаплазии Баррета, действия врача должны быть направлены на уменьшение риска развития рака пищевода. С этой целью пациенты с пищеводом Баррета периодически проходят эндоскопическое обследование с обязательной биопсией на предмет степени перерождения клеток слизистой оболочки пищевода (метаплазия или дисплазия; насколько выраженная).
Сроки обследования устанавливаются в зависимости от тяжести имеющихся изменений слизистой оболочки пищевода. Так пациенты, у которых имеется только метаплазия Баррета без дисплазии, проходят обследование один раз в 2-3 года.
Если обнаружена дисплазия, проводится более тщательное обследование для определения степени дисплазии, так как при дисплазии высокой степени рак может развиться в течение 4 лет.
Пациентам с низкой степенью дисплазии назначается 12-недельный курс ингибиторов протонной помпы в высоких дозах, затем проводится повторное обследование с биопсией. Если обследование подтверждает наличие дисплазии низкой степени выраженности, то в последующем эндоскопия проводится через 6 месяцев, а затем ежегодно, если не отмечено развития дисплазии высокой степени.
Хирургическое лечение пищевода Баррета
Хирургическое лечение пищевода Баррета направлено на снижение количества эпизодов рефлюкса.
Хотя рефлюксная болезнь является фактором риска развития аденокарциномы пищевода, до конца не ясно, само ли существование пищевода Баррета предрасполагает к развитию рака или какие-то другие причины способствуют злокачественно перерождению клеток при наличии пищевода Баррета.
Уменьшению симптомов заболевания способствует как медикаментозное, так и хирургическое лечение пищевода Баррета. Однако по данным исследований даже прием ингибиторов протонной помпы в больших дозах не способствует уменьшению частоты рефлюкса. Поэтому, несмотря на улучшение состояния пациентов вследствие приема лекарств, хирургическое лечение пищевода Баррета имеет большое значение. Кроме того, данные некоторых исследований показывают, что после лапароскопической фундопликации риск развития рака пищевода значительно снижается, по сравнению с медикаментозной терапией. Хотя после хирургической операции повышается риск смертности, что связано с необъяснимым увеличением частоты заболеваний сердца у таких пациентов. В связи с этим решение об операции принимается врачом после тщательного взвешивания всех аргументов за и против хирургического лечения. Если операция проводится опытным хирургом, то ее результат может быть очень хорошим, хотя и не гарантирует полностью исчезновение симптомов заболевания, что иногда требует послеоперационного приема препаратов.
Данные исследований показывают, что медикаментозная терапия, в отличие от хирургического лечения, оказывает меньший эффект на частоту возникновения рефлюкса во время сна. В этой ситуации достаточно эффективными оказываются как лапароскопическая, так и открытая операция.
Кроме того, по некоторым данным, основанным на продолжительных наблюдениях, после фундопликации риск развития дисплазии и рака пищевода ниже, чем после лекарственной терапии.
Хирургическое лечение рекомендуется также пациентам, с пищеводом Баррета в сочетании с наличием грыжи пищеводного отверстия диафрагмы.
Эндоскопическая абляция
Этот метод хирургического лечения пищевода Баррета сопряжен с меньшим риском развития осложнений, чем большая хирургическая операция. Теоретически, данный метод является относительно безопасным.
Методика операции состоит в удалении пораженной части слизистой оболочки пищевода. На этом месте в дальнейшем происходит восстановление нормальной слизистой оболочки, что снижает риск развития рака пищевода. Пораженная часть слизистой оболочки удаляется с помощью воздействия лазерного или другого высокоэнергетического излучения. При этом пациенту назначается дополнительный прием ингибиторов протонной помпы в высоких дозах для улучшения восстановления нормальной слизистой оболочки пищевода.
Операция проводится либо без подготовки, либо после приема специальных препаратов, воздействующих на клетки измененной части пищевода и подготавливающих к лазерному воздействию для улучшения результата операции.
Хирургическое лечение при наличии высокой степени дисплазии
При дисплазии высокой степени риск развития аденокарциномы также становится высоким. Дисплазия может быть обнаружена только на одном участке слизистой оболочки пищевода (фокальная), а может развиться сразу в нескольких местах (мультифокальная), и такая дисплазия сочетается со значительным риском развития аденокарциномы (27% в течение 3 лет).
У пациентов с пищеводом Баррета с высокой степенью дисплазии не всегда целесообразно проведение эндоскопической абляции слизистой оболочки пищевода. Это связано с тем, что при таком подходе достаточно трудно полностью удалить пораженную ткань, а при высокой степени дисплазии риск развития рака пищевода также является высоким, даже при наличии небольшого участка пораженной ткани. Поэтому для проведения эндоскопической операции должны быть строгие показания. Должен быть тщательно оценен риск операции.
Эндоскопическая абляция проводится у тех пациентов, которым не рекомендуется проведение эзофагэктомии (большая операция, при которой удаляется часть пищевода или весь пищевод). В остальных случаях предпочтительным методом хирургического лечения пищевода Баррета с высокой степенью дисплазии остается эзофагэктомия.
Эзофагэктомия является эффективным методом лечения у молодых и в остальном здоровых пациентов, однако сопряжена с относительно высоким риском смертности (3-10%). В связи с этим некоторые специалисты рекомендуют вместо немедленной операции при дисплазии высокой степени у пациентов с пищеводом Баррета поводить постоянное (с высокой периодичностью) эндоскопическое наблюдение.
Поскольку операция удаления пищевода сопряжена с высоким риском, в качестве альтернативного метода хирургического лечения пищевода Баррета с высокой степенью дисплазии применяется эндоскопическая абляция. Эта операция может проводиться термическим, химическим или механическим способом. В любом случае операция состоит в удалении метаплазированного или дисплазированного эпителия в сочетании с интенсивной антисекреторной терапией, что в последующем обуславливает восстановление нормального эпителия слизистой оболочки пищевода.
Эндоскопическая резекция слизистой оболочки пищевода
Это еще один метод хирургического лечения пищевода Баррета. Методика операции состоит в хирургическом иссечении пораженной части слизистой оболочки с помощью специальных эндоскопических инструментов, в том числе электрокоагулятора (который используется, например, при эндоскопическом удалении полипов).
Успех данной операции достаточно высок, однако часто уже в течение первого года после операции может развиться рецидив заболевания.
Термическая абляция производится с помощью электрокоагулятора, аргонового плазменного коагулятора или лазерного облучения. Одним из осложнений данной операции является перфорация пищевода. Другой способ абляции – фотодинамическое облучение с помощью специального прибора. Как и термическая абляция, данный метод может вызвать некоторые побочные эффекты: боль в груди, тошноту и развитие стриктур пищевода. Кроме того, следует предупредить пациентов о том, что после операции необходимо избегать длительного пребывания на солнце, так как возможно развитие реакции повышенной чувствительности к ультрафиолетовому облучению со стороны кожи. Данная процедура является весьма эффективной и приводит к обратному развитию дисплазии у 90% пациентов. Остаточные явления метаплазии Баррета наблюдаются в течение 2-62 месяцев у 58% пациентов, прошедших процедуру фотодинамической абляции.
Механическая абляция заключается в механическом удалении измененной части слизистой оболочки пищевода с помощью специальных эндоскопических инструментов. Эта процедура рекомендуется тем пациентам, у которых наблюдается ранняя стадия развития рака пищевода и которым по тем или иным причинам не может быть проведена большая хирургическая операция (удаление пищевода).
ivanovv.ru
Дисплазия пищевода – Онкология
В 62% наблюдений рак сочетается с дисплазией пищевода высокой степени (ДВС), очевидна важность этого патологического состояния.
Дисплазия пищевода низкой степени (легкая)
Легкая дисплазия пищевода 1 степени (poor predictor) — показатель маловероятного риска возникновения рака пищевода. Только 2-3% пациентов с такой дисплазией заболевают раком, в то время как у 65% пациентов происходит со временем регрессия дисплазии. Кроме того, Рейд и соавт. показали, что пациенты с дисплазией низкой степени не имеют достоверно более высокого риска рака по сравнению с больными без дисплазии в сегменте Барретта (3/43, 6,9% против 5/129, 3,9%) .
Дисплазия пищевода высокой степени (тяжелая)
ДВС расценивают как показатель высокого риска возникновения инвазивной аденокарциномы пищевода. В большинстве центров при диагностике дисплазии пищевода 2-3 степени двумя независимыми специалистами-патоморфологами пациентам предлагают эзофагэктомию . Обоснованность такого подхода базируется на следующих наблюдениях.
- У 40% больных, перенесших резекцию пищевода по поводу ДВС, обнаруживали аденокарциному. В хирургической литературе за 10-летний период (1991-2000) в общей сложности 201 больной перенес резекцию с предоперационным диагнозом ДВС, из них 79 больных (39%) имели аденокарциному . В табл. 5-1 показан конечный патоморфологически подтвержденный диагноз у 162 пациентов, перенесших эзофагэктомию по поводу ДВС .
- Несмотря на активный эндоскопический скрининг с многократными биопсиями, многие опухоли не идентифицируются до резекции.
- Следует опасаться, что необнаруженный рак чреват поражением лимфатических узлов при продолжении консервативного наблюдения дисплазии пищевода 3 степени по причине уникальной, обширно развитой лимфатической системы пищевода.
- Резекция пищевода при дисплазии высокой степени или при ранней стадии аденокарциномы сопровождается летальностью (в среднем 1,2%) и хорошей отдаленной выживаемостью, которая при отсутствии поражения лимфатических узлов приближается к 90%.
- Ранняя аденокарцинома пищевода, ассоциированная с ДВС, возникающая при ДВС, бывает мультифокальной у 60% пациентов.
Несмотря на эти соображения, у многих гастроэнтерологов вызывает беспокойство политика выполнения эзофагэктомии при ДВС по следующим причинам.
- Биологическое развитие дисплазии пищевода высокой степени хорошо не документировано. У некоторых больных ДВС не прогрессирует до рака много лет. У небольшой доли пациентов с последующей эндоскопией и биопсией ДВС не подтверждается. Пока не ясно, следует считать этот феномен результатом ошибки выборочного исследования с помощью биопсии или действительно происходит регресс ДВС.
- Создание подробных эндоскопических протоколов биопсии помогает дифференцировать дисплазию пищевода и инвазивный рак, вследствие чего выявление недиагностированного рака в резецированном пищеводе после эзофагэктомии при ДВС может быть уменьшено до 10% и менее.
- 60% больных, перенесших эзофагэктомию по поводу ДВС, не имеют инвазивного рака. Это было бы приемлемым для операций с низким риском, но эзофагэктомия сопряжена с летальностью, достигающей 14%, как часто указывают врачи, несмотря на публикуемую летальность ниже 2% . Более того, резекция пищевода связана с серьезными осложнениями, в том числе и отдаленными. В попытке разрешить это противоречие Шнелл и соавт. классифицировали раннюю аденокарциному, возникающую при ДВС, как распространенную, или инцидент. Распространенная аденокарцинома была определена как опухоль, которую обнаруживают при ДВС во время первого эндоскопического исследования или которая была выявлена в течение первого года наблюдения. Пациенты с НДД, не имеющие рака при первичном эндоскопическом исследовании, были подвергнуты четырем дальнейшим эндоскопическим исследованиям в течение первого года (каждое — с многократными биопсиями, из четырех точек на каждые 2 см сегмента Барретта). Авторы описывают этот период как «охоту» на распространенный инвазивный рак. Первичным раком считали только опухоли, обнаруженные в период наблюдения. У 34 пациентов при биопсии обнаружили ДВС без рака при первом эндоскопическом исследовании. У 4 из этих 34 пациентов была диагностирована аденокарцинома во время периода «охоты», значит, истинная распространенная дисплазия пищевода содержит скрытую нераспознанную аденокарциному в 12% случаев. Всего 75 пациентов с ДВС были включены в программу наблюдения. У 12 пациентов (15%) развилась аденокарцинома в среднем после 8 лет наблюдения. У 11 диагностирован ранний рак пищевода, что позволило провести резекцию, в то время больной с распространенным раком в тяжелой стадии не пережил 10-летний период. Только 1 из этих 75 больных с дисплазией пищевода, после длительного проспективного эндоскопического наблюдения, умер от рака пищевода, в то время как 63 пациента избежали этой участи благодаря эзофагэктомии. Это исследование предполагает, что ДВС при эндоскопически плоской слизистой оболочке, без признаков распространенного рака, можно курировать интенсивным эндоскопическим наблюдением со строгим соблюдением протокола биопсии, проводя эзофагэктомию больным с доказанной аденокарциномой .
Это исследование — наиболее крупное и продолжительное моноцентровое отдаленное наблюдение больных с ДВС, опубликованное в медицинской литературе. Исследование значительно аргументирует пользу врачебного контроля ДВС в хорошо финансируемой системе частного здравоохранения . В то время как Шнелл и соавт. приводят доводы против эзофагэктомии в качестве профилактического средства при ДВС, Рейд и соавт. сообщают о 30% риске развития рака во время эндоскопического наблюдения. Стратегия Шнелла была также подвергнута критике по следующим причинам.
- Нет четких соглашений между морфологами, исследующими желудочно-кишечный тракт, в их способности дифференцировать ДВС от инвазивного рака слизистой оболочки. Это весьма затруднительно при ДВС с отмеченной архитектурной сложностью, но при недостаточности данных в определении нарушений базальной мембраны. Следовательно, опытные патологи часто не соглашаются с диагнозом ДВС вместо внутрислизистого рака .
- Задержка хирургического вмешательства до диагностики аденокарциномы может увеличить распространенность T1b стадии рака (подслизистый) в резецированных образцах.
- Во многих недостаточно финансируемых системах здравоохранения практичность и стоимость интенсивного строгого эндоскопического наблюдения создают определенные затруднения. Следовательно, выбор метода лечения больных с дисплазией пищевода, возникающей в пищеводе Барретта, включает длительное эндоскопическое наблюдение в центрах, где повторная эндоскопия с многократными биопсиями может быть предпринята с 3-месячными интервалами, в то время как эзофагэктомия остается предпочтительной стратегией в большинстве центров мира.
Статью подготовил и отредактировал: врач-хирург Пигович И.Б.
Видео:
Полезно:
surgeryzone.net
Дисплазия пищевода (пищевод Барретта) – Онкология
Карциногенез в пищеводе возникает из последовательности от кишечной метаплазии через высоко- или низкодифференцированную дисплазию и в конечном итоге оканчивается инвазивным раком.
Наличие дисплазии пищевода рассматривают как наилучший маркер злокачественного перерождения эпителия. Дисплазию пищевода гистологически классифицируют на высоко- и низкодифференцированную с «неопределенной» применимостью, когда дисплазия не может быть четко дифференцирована от реактивных или регенеративных изменений, вызванных воспалением. Эта классификация — модификация гистопатологической классификации, используемой для оставшейся части ЖКТ, особенно для дисплазии толстой кишки, вызванной воспалительным заболеванием кишечника.
Классификация дисплазии пищевода
- Низкодифференцированную дисплазию пищевода диагностируют, когда выявлены особые цитологические изменения. В частности, ядра клеток значительно изменены по размеру и форме, клетки теряют полярность. То же наблюдается, если отмечена потеря криптами архитектуры со значительным изменением строения.
- Высокодифференцированную дисплазию классифицировать намного труднее, но при ней определяют потерю клетками дифференцировки и утрату бокаловидных клеток. Изменения крипт и клеток менее выражены, чем при низкодифференцированной дисплазии.
- Внутрислизистый рак диагностируют, когда возникает прорастание через базальную мембрану в собственную пластинку. Термин «карцинома in situ» оставлен, поскольку вызывает путаницу.
Существуют разногласия между экспертами в толковании (гистологической диагностике) диспластических изменений при пищеводе Барретта. Межэкспертные и внутриэкспертные исследования показывают, что патологи могут демонстрировать удовлетворительный уровень согласия между двумя главными группами сравнения низкодифференцированной дисплазии с карциномой и отсутствия дисплазии с неопределенной и высокодифференцированной дисплазией (величина каппа 0,8). Однако разделение на четыре группы отсутствия дисплазии, сравнительно неясной дисплазии и высокодифференцированной дисплазии, низкодифференцированной дисплазии и карциномы показывает, что существует низкий уровень согласия (внутриэкспертная величина каппа 0,64, межэкспертная величина каппа 0,43) .
Важно рассмотреть причины, по которым возникает сравнительно низкий уровень согласия для высокодифференцированной дисплазии пищевода. Этот факт демонстрирует, что патологи испытывают большие трудности в отделении воспаления от высокодифференцированной дисплазии. Это становится особенной проблемой, когда у пациента расположены рядом желудочные ямки «слабовыраженного» эпителия и более выраженный кишечный тип эпителия (с более выраженной в свою очередь пролиферативной зоной). Это типичный патологический признак в мозаике различных типов эпителия, которые появляются в выстланном цилиндрическим эпителием пищеводе. Этот признак также выявляют при кишечной метаплазии слизистой оболочки желудка. Возможно, это один из наиболее частых поводов для применения категории «неопределенная дисплазия». Патологов следует поощрять применять эту категорию при какой-либо неуверенности. Такой диагноз не означает, что патолог не определился, чаще это свидетельствует о невозможности с уверенностью исключить высокодифференцированную дисплазию в материале с воспалительными изменениями.
Изменения на молекулярном уровне, вызывающие переход от метаплазии к дисплазии, крайне важны и явны. Важно отметить, что большая часть клеток эпителия Барретта — стабильные клетки, не подвергающиеся злокачественному перерождению. Однако некоторые клетки, обычно кишечного типа, приобретают увеличенный пролиферативный индекс и трансформируются, экспрессируя онкогенный фенотип. Они заметно различаются и экспрессируют онкогены, например c-erbB2. Аномалии клеточного цикла часто можно встретить во время раннего злокачественного перерождения. Клетки мобилизуются из фазы G0 в фазу G1, утрачивают переход G1-S, большее количество клеток пребывает в фазе G2 . Циклины, как регуляторы клеточного цикла, редко подвергаются избыточной экспрессии в аденокарциномах пищевода . Регуляция клеточного цикла представляет собой также функцию p53, поскольку он — «защитник генома». Любое повреждение ДНК активирует p53, который останавливает клеточный цикл в G1-S фазе и стимулирует восстановление нуклеиновых кислот. Мутантный p53s неактивен, его накопление — основа для обнаружения белка иммуногистохимическими методами. Определение белка p53 при пищеводе Барретта и раке в настоящее время признано точным методом. Его не обнаруживают в эпителии без диспластических изменений, но он присутствует в 9% образцов неясной или высокодифференцированной дисплазии, в 55% низкодифференцированной дисплазии и в 87% карцином . Это показывает, что p53 может быть пригодным прогностическим маркером. У пациентов с высокодифференцированной дисплазией и экспрессией p53 более вероятна прогрессия до низкодифференцированной дисплазии или, более того, до карциномы. Если экспрессии нет, менее вероятна дальнейшая злокачественная дегенерация. Поэтому пациенты с неясной высокодифференцированной дисплазией и экспрессией p53 должны находиться в дальнейшем под более строгим контролем. Следует особо подчеркнуть, что не все аденокарциномы пищевода экспрессируют p53, и у пациентов без экспрессии возможно развитие рака.
Предпринимают попытки найти другие молекулярные и гистологические маркеры для идентификации пациентов с высоким риском злокачественной трансформации. Анализ состава ДНК с использованием проточной цитометрии показывает, что анэуплоидия или увеличение G2/тетраплоидной фракции связаны с увеличением риска злокачественной прогрессии . Другой ключевой момент в неопластической прогрессии — потеря клетками способности к адгезии с неправильной экспрессией адгезивных молекул. В наибольшей степени снижается экспрессия E-кадерина с определением катенинов в ядре, поскольку слизистая оболочка становится более злокачественной .
Дисплазия: естественное развитие
Патогенез злокачественной прогрессии при пищеводе Барретта — ключевой момент, но все еще остаются вопросы, ответы на которые не получены. Их несколько. Во-первых, мы должны спросить, у какой доли больных, имеющих предоперационный гистологический диагноз низкодифференцированной дисплазии пищевода, обнаруживают инвазивный рак во время операции. Эта группа пациентов избирательна, поскольку из нее исключены пациенты, не пригодные для расширенного хирургического вмешательства с удалением пищевода. В некоторых исследованиях до 50% пациентов с предоперационным диагнозом низкодифференцированной дисплазии имеют карциному. Это подтверждает важность точной гистологической оценки и применения строгого протокола биопсии.
Биопсия при дисплазии пищевода
У пациентов с дисплазией следует забирать биоптат в соответствии с протоколом. Большие 9-миллиметровые открытые биопсийные щипцы следует применять с отсосом и методикой вращения (поворот и засасывание) для получения наибольшего размера биоптата слизистой оболочки. Поэтому следует использовать эндоскоп с большим каналом. После тщательной идентификации всех ориентиров берут биоптат сегмента Барретта из наиболее нижней точки, расположенной выше места перехода плоского эпителия в цилиндрической. Образцы следует брать из всех мест, где видны изменения слизистой оболочки и где до этого была обнаружена низкодифференцированная дисплазия. Биоптаты берут из всех четырех квадрантов пищевода с шагом 2 см. Следует предположить, что распространение низкодифференцированной дисплазии может быть важным фактором развития карциномы, но еще не существует согласованных критериев для определения распространения в биоптате. В настоящее время показано, что распространение низкодифференцированной дисплазии не предсказывает наличия незаподозренной карциномы при эзофагоэктомии. Количество образцов может быть (и часто должно быть) более 50.
Пациенты, подвергающиеся такому инвазивному наблюдению, могут быть уверены, что рак (если он у них разовьется) будет обнаружен очень рано, а затем будет своевременно выполнена эзофагоэктомия. Если низкодифференцированную дисплазию считать показанием к эзофагоэктомии, тогда правомерно утверждать, что некоторым пациентам с дисплазией, занимающей маленькую площадь, можно провести профилактическую эзофагоэктомию. К сожалению, некоторые из этих пациентов умирают от послеоперационных осложнений . В одном исследовании операционной смертности пациентов, оперированных по поводу низкодифференцированной дисплазии пищевода, летальность достигала 14%, с отсутствием смертельных исходов при незамеченном раке. Не может быть сомнений, что пациенты, подвергающиеся наблюдению и имеющие обнаруженный при этом наблюдении рак, будут иметь более долгую выживаемость, чем пациенты, у которых рак обнаружили из-за появившихся симптомов . Поэтому продолжаются споры относительно того, что считать конечной точкой наблюдения: первоначальный диагноз низкодифференцированной дисплазии, персистирующую низкодифференцированную дисплазию или окончательный диагноз инвазивного рака.
Возникли вопросы или что-то непонятно? Спросите у редактора статьи – здесь.Несмотря на сложности анализа, следует попытаться выяснить, всегда ли низкодифференцированная дисплазия прогрессирует в рак за время жизни пациента. Данные исследований сбивают с толку и неточны. Наиболее важное и информативное одиночное исследование включало 58 пациентов с низкодифференцированной дисплазией . Эти пациенты были тщательно осмотрены и подвергнуты биопсии со строгим соблюдением протокола. У 7 из них отмечена прогрессия во внутрислизистый рак за средний период наблюдения 38 мес, а у 21 состояние оставалось стабильным (низкодифференцированная дисплазия пищевода) в течение 32 мес наблюдения. Мы не можем предположить, что у всех пациентов будет прогрессия в рак из низкодифференцированной дисплазии. Более недавнее и считающееся провокационным исследование показало, что только у 12 из 75 пациентов с низкодифференцированной дисплазией развился рак за период наблюдения 7,3 года. Это исследование важно, поскольку авторы исключили сопутствующий, но не распознанный рак, путем исключения пациентов, у которых рак был обнаружен в течение первого года интенсивного наблюдения. Ситуация с пациентами, имеющими высокодифференцированную дисплазию пищевода, еще более запутана. У некоторых будет развиваться карцинома без обнаружения низкодифференцированной дисплазии, а у некоторых состояние будет регрессировать до метаплазии. Также остается еще один вопрос: может ли низкодифференцированная дисплазия регрессировать. К сожалению, данные недостаточно ясны. В некоторых исследованиях зарегистрировано, что низкодифференцированная дисплазия может самопроизвольно исчезать. Но мы должны оставаться осторожными в этом вопросе, поскольку возможны ошибки с образцами и необходимо долгосрочное наблюдение.
Статью подготовил и отредактировал: врач-хирург Пигович И.Б.
Видео:
Полезно:
surgeryzone.net
Метаплазия слизистой оболочки пищевода – диета и лечение
Каковы причины появления пищевода Барретта? В каких случаях существует риск развития рака? Исследуем симптомы и лечение метаплазии пищевода, а также диету борьбы с рефлюксом желудочного сока.
Что такое пищевод Баррета
Пищевода Баррет – это заболевание, при котором клетки, которые покрывают внутренние стенки нижней части пищевода в непосредственной близости от кардиального отдела, во время непрерывного процесса репликации заменяются клетками типа тех, которые покрывают внутреннюю стенку желудка и двенадцатиперстной кишки (первая часть тонкого кишечника).
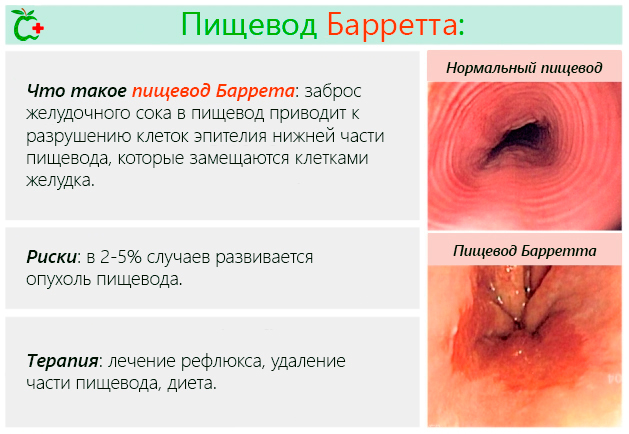
Процесс замены клеток, описанный выше, имеет название метаплазия.
Как развивается метаплазия
Пищевод Барретта и метаплазия являются прямым следствием эрозии эпителия (поверхностных клеток) пищевода при воспалительном процессе, который развивается при продолжительном или случайном забросе в трубку пищевода соков желудка и кишечника.
Эти соки сильно кислые, поэтому разрушают нормальные клетки эпителия пищевода, которые не рассчитаны на такие условия.
Таким образом, образование пищевода Барретта может быть истолковано, как попытка защиты организма от постоянного травмирования пищевода. Патологическим состоянием, которое вызывает повторяющиеся контакты пищевода с желудочным соком, является рефлюкс эзофагит.
Сама болезнь практически бессимптомна и, следовательно, не добавляет каких-либо симптомов в плане клинической картины ГЭРБ. Пациент, по сути, не испытывает каких-либо признаков процесса замены клеток в его пищеводе. Поэтому было бы разумно предполагать, что пищевод Баррет не добавляет каких-либо проблем, связанным с желудочно-пищеводным рефлюксом.
К сожалению, это не правда.
Осложнения пищевода БарреттаНа самом деле доказано, что пищевод Барретта увеличивает примерно в 30-40 раз вероятность развития редкой формы рака – аденокарцинома пищевода (встречается у 2-5% пациентов, имеющих пищевод Барретта). Аденокарцинома – это форма опухоли, для которой, к сожалению, ещё не существует эффективного лечения и, таким образом, она быстро приводит к смерти (выживаемость в течение 5 лет после постановки диагноза значительно ниже 10%). Конечно, образование пищевода Баррета не означает обязательного развития рака. Риск невелик, и снижается ещё, если заболевание своевременно диагностировано и проводится соответствующее лечение. |
Классификация пищевода Барретта
Классификации можно проводить в зависимости от размера повреждения:
- Длинный сегмент пищевода Барретта, если метаплазия охватывает больше 3 см.
- Короткий сегмент пищевода Барретта, если поражение меньше 3 см.
Классификация может также осуществляться в зависимости от типа метаплазии, т.е. в зависимости от того как и какие клетки были заменены:
- Первый тип. Обычные клетки плоского эпителия пищевода были заменены из полноценной семьёй клеток кишечника.
- Второй тип. Плоскоклеточные клетки были заменены на клетки желудка и бокаловидные клетки.
- Третий тип. Плоскоклеточные клетки были заменены на бокаловидные клетки.
Симптомы пищевода Барретта
Как было сказано, пищевод Баррета – это практически бессимптомное заболевание. Однако, это сопровождается характерной клинической картиной желудочно-пищеводного рефлюкса, обращают на себя внимания следующие симптомы и признаки:
- Боль в области груди, чуть выше устья желудка, этот симптом, в некоторых случаях, путают с признаком инфаркта миокарда.
- Кашель без мокроты из-за раздражения верхних дыхательных путей при срыгивании кислот.
- Охриплость, вызванная раздражением голосовых связок от срыгивания кислот.
- Трудности и боли при глотании (одинофагия).
- Изжога.
- Рвота со следами крови.
- Черный стул, указывающий на кровотечение из пищеварительного тракта.
Причины метаплазии пищевода и факторы риска
Как уже говорилось, было бы логично рассмотреть пищевод Барретта как осложнение от рефлюкс эзофагита. По сути, организм пытается защитить эпителий пищевода от эрозии по действием желудочного сока, заменив нормальные клетки на клетки типичные для двенадцатиперстной кишки, которые способны противостоять высокой кислотности. Но оказывается, что существует довольно много пациентов с пищеводом Барретта, которые никогда не страдали от изжоги и рефлюкса. Таким образом, в настоящее время истинная причина пищевода Барретта неизвестна.
Однако, прекрасно известны ряд факторов, увеличивающие риск его развития:
- Наличие желудочно-пищеводно рефлюкса.
- Переход 60-летнего возраста. Пищевод Барретта – это редкость среди молодых людей.
- Мужской пол. Мужчины имеют большую вероятность развития болезни (в два раза чаще, чем у женщин).
- Принадлежность к кавказской расе.
- Потребления чрезмерного количества алкоголя.
- Курение табака.
- Ожирение. Оно увеличивает риск рефлюксной болезни и, следовательно, образование пищевода Барретта.
Диагностика пищевода Баррета – эндоскопическое исследование
Диагностика проводится с помощью специального эндоскопического исследования верхних путей желудка. Исследование заключается во введении через рот в пищевод эндоскопа, который имеет на вершине лампочку и миниатюрную видеокамеру.
Через видеокамеру на внешний экран выводиться изображение эпителия, который покрывает внутренние стенки пищевода. В нормальных условиях эпителий имеет бледно-розовую и блестящую окраску. В случае болезни эпителий становится красным или алым и бархатистым.
Эндоскоп позволяет также получить образцы ткани. Её забор осуществляется в нескольких точках подозрительных областей. Образцы в дальнейшем исследуются под электронным микроскопом, который позволяет оценить мутации клеток, а также степень дисплазии, что является признаком возможной раковой пролиферации.
Может быть обнаружена:
- Кишечная метаплазия без дисплазии. В некоторых областях эпителий пищевод претерпел генетическую модификацию, в частности, замещение клетками двенадцатиперстной кишки. Все это придает пострадавшему участку красный цвет и бархатистую поверхность.
- Низкая дисплазия. Менее 50% клеток приняли новую организацию и форму. Скорость роста клеток увеличивается. Клетки изменены, однако, содержатся в только эпителии.
- Дисплазия высокой степени. Аномальные клетки превышает 50% от общего числа. Их организация сильно отличается от физиологической, а скорость роста значительно увеличивается. Аномальные клетки по-прежнему, содержатся эпителиальном слое.
Конечно, дисплазия высокой степени, как наиболее близкая к опухолевой дегенерации, требует быстрого принятия лечения.
Лечение и профилактика болезни Барретта
Выбор терапии зависит, как уже сказано , от степень дисплазии клеток пищевода, что оценивают при диагностике. Если дисплазия отсутствует, то устранение проблемы рефлюкса, естественно, предотвращает развитие зон эрозии.
Частота мониторинга зависит от состояния дисплазии.
Если дисплазия отсутствует, то эндоскопию повторяют через год, если она по-прежнему отсутствует, то тест необходимо повторить через 3 года.
Если дисплазия низкого уровня, то исследование повторяют через шесть месяцев после первого теста.
Если обнаруживается дисплазия высокой степени – это требует хирургического лечения:
- Обычное хирургическое лечение. Проводится с помощью традиционной хирургии, под общим наркозом и удаляется часть поврежденного пищевода. Эта процедура сопряжена с риском, так как не все пациенты, учитывая возраст и здоровье, могут её выдержать.
- Удаление модифицированных клеток эндоскопическим методом. Менее инвазивный метод и поэтому лучше переносится.
- Радиочастотная абляция тканей. Использует тепло, которое получают с помощью радиочастот, для уничтожения аномальных клеток.
- Фотодинамическая терапия. Пациенту вводят препарат, который делает раковые клетки чувствительными к световому потоку от лазера, смонтированному на эндоскопе.
Правила гигиены для снижения риска развития патологии
Соблюдение ряда элементарных правил гигиены, позволяет существенно снизить риск развития пищевода Баррета.
- Поддержание вес тела в пределах физиологической нормы.
- Сдержанность в употреблении алкоголя и отказ от курения.
- Более частое употребление пищи меньшими порциями. Способствуют пищеварению и уменьшает рефлюкс.
- Избегание употребления пищи перед сном. Лежачее положение способствует регургитации полного желудка.
- Повышение уровня изголовья кровати. Уменьшает вероятность срыгивания кислот во время сна.
Диетическое питание для профилактики пищевода Баррета
Также необходимо придерживаться здорового рациона питания. Чтобы предотвратить рефлюкс и заброс желудочного сока в пищевод необходимо придерживаться диеты, которая не вызывает медленного пищеварения и способствует быстрому опорожнению желудка.
Кроме того, рекомендуется принимать щелочные продукты, которые позволяют противостоять повышенной кислотности желудочного сока.
Таким образом, следует избегать:
- продукты с высоким содержанием жиров, такие как сыры, колбасы, жареная пища, шоколад;
- раздражающих продуктов, таких какие специи, вино и алкоголь, лук, чеснок и мята, цитрусовые, газированные напитки;
- белковых продуктов.
Вместо этого рекомендуются:
- фрукты и овощи;
- обезжиренное молоко, которое эффективно нейтрализует кислотность;
- макаронные изделия, хлеб и рис;
- постное мясо.
sekretizdorovya.ru
Предопухолевая патология пищеварительной системы – Медицинский портал «health-ua.org»
Желудочно-кишечный тракт (ЖКТ) особенно подвержен развитию злокачественных новообразований. В связи с этим одной из главных задач современной гастроэнтерологии является предотвращение опухолей пищеварительной системы.
Т.А. Соломенцева, к.м.н., Институт терапии им Л.Т. Малой АМН Украины, г. Харьков
 В Украине отмечается тенденция к росту заболеваемости злокачественными новообразованиями и смертности от них. Как правило, большинство заболевших обращаются за медицинской помощью на стадии развернутой картины заболевания, когда возможности радикального лечения ограничены. Несмотря на применение самых современных методов лечения, в течение года после установления диагноза около 50% пациентов умирают.
В Украине отмечается тенденция к росту заболеваемости злокачественными новообразованиями и смертности от них. Как правило, большинство заболевших обращаются за медицинской помощью на стадии развернутой картины заболевания, когда возможности радикального лечения ограничены. Несмотря на применение самых современных методов лечения, в течение года после установления диагноза около 50% пациентов умирают.
Упрощенно модель формирования онкопатологии пищеварительной системы можно представить следующим образом: норма → фоновое заболевание → предраковые изменения → рак.
Патология пищевода
Предраковыми заболеваниями пищевода можно считать ахалазию кардии, метаплазию Барретта. Кроме собственно патологии пищевода, независимым фактором риска развития аденокарциномы пищевода является ожирение.
В 40-50-х гг. ХХ столетия только 2-3% случаев злокачественных опухолей пищевода были представлены аденокарциномой, в остальных случаях диагностировался плоскоклеточный рак. В настоящее время многие зарубежные авторы указывают на значительное увеличение частоты аденокарциномы пищевода, которая уже достигает 50% от числа всех больных со злокачественными опухолями этого органа. Крупные исследования, проведенные в США и странах Западной Европы, показали, что большинство случаев аденокарциномы развивается на фоне пищевода Барретта.
Пищевод Барретта – одно из осложнений длительно существующей гастроэзофагеальной рефлюксной болезни (ГЭРБ). Возникновение этой патологии связано с трансформацией клеток многослойного плоского эпителия пищевода в метаплазированный цилиндрический эпителий.
Длительный контакт соляной кислоты со слизистой оболочкой пищевода приводит к ее изъязвлению и развитию воспаления. Репарация сопровождается увеличением количества стволовых клеток. В условиях низкого рН, сопровождающего рефлюкс, эти клетки могут дифференцироваться в цилиндрический эпителий, который более устойчив к воздействию кислоты. Выявление специализированного тонкокишечного цилиндрического эпителия в биоптатах, взятых из любого участка грудного отдела пищевода, является основанием для постановки диагноза «пищевод Барретта».
Патогномоничных клинических симптомов пищевода Барретта не существует, поэтому его необходимо исключать у любого пациента с длительным (более 5 лет) анамнезом ГЭРБ. Однако известны случаи диагностики пищевода Барретта у пациентов без предшествующей ГЭРБ.
Метаплазия Барретта выявляется на участках длинного и короткого (в 3 см и менее от места перехода пищевода в желудок) сегментов пищевода и кардиальной части желудка, расположенной сразу после перехода пищевода в желудок.
Распространенность метаплазии Барретта в области длинного сегмента пищевода, по данным эндоскопических исследований, составляет около 1%, которая возрастает с увеличением тяжести ГЭРБ. Такой тип метаплазии чаще встречается в возрасте 55-65 лет, значительно чаще у мужчин (соотношение мужчин и женщин 10:1). Пищевод Барретта в области короткого сегмента наблюдается чаще, однако распространенность этого заболевания оценить сложно, так как этот тип метаплазии при эндоскопическом исследовании сложно отличить от метаплазии в кардиальном отделе желудка. При этом злокачественная опухоль при метаплазии в области короткого сегмента пищевода и кардиальной части желудка развивается реже, чем при метаплазии в области длинного сегмента пищевода.
Многочисленными исследованиями доказано, что метаплазия Барретта в пищеводе возникает на фоне ГЭРБ и иногда приводит к развитию рака пищевода. Не известна причина возникновения кишечной метаплазии в области кардиальной части желудка. Этот тип метаплазии встречается при ГЭРБ и гастрите при наличии инфекции H. рylori, причем на фоне гастрита развивается даже чаще, чем на фоне ГЭРБ. Однако кишечная метаплазия и воспаление в этой области могут появиться и в отсутствие H. рylori, являясь следствием хронического рефлюкса. Распространенность этого типа метаплазии составляет 1,4%.
Остается открытым вопрос, почему у одних пациентов с выраженным эзофагитом и длительным течением ГЭРБ развивается метаплазия Барретта, а у других – нет. Высказывается предположение, что определенное значение имеет генетическая предрасположенность.
Обоснованием активного диспансерного наблюдения больных пищеводом Барретта является возможность предупреждения аденокарциномы пищевода путем ранней диагностики дисплазии эпителия и проведения адекватного лечения предракового заболевания.
На сегодня в Украине не приняты единые официальные рекомендации по ведению больных пищеводом Барретта. Согласно большинству рекомендаций данная группа больных должна находиться под активным наблюдением. Пациенты с метаплазией Барретта должны подвергаться эндоскопическому исследованию не реже 1 раза в 2-3 года. При наличии низкой степени дисплазии рекомендована ежегодная верхняя эндоскопия с гистологическим исследованием биоптатов пищевода. При выявлении дисплазии высокой степени необходима консультация хирурга для решения вопроса об активной тактике ведения пациентов. По возможности динамическое эндоскопическое обследование таких пациентов должно осуществляться 1 раз в 3-6 мес.
Гистологическое исследование слизистой оболочки пищевода при наличии метаплазии Барретта должно проводиться обязательно во всех случаях эндоскопического обследования для верификации диагноза и уточнения степени дисплазии.
В терапии больных с пищеводом Барретта основное внимание уделяется двум моментам: лечению ГЭРБ, на фоне которой развилась метаплазия, и предотвращению развития аденокарциномы пищевода.
По данным многочисленных исследований, патологические изменения в пищеводе происходят за счет длительного воздействия кислоты на слизистую оболочку. Для лечения пищевода Барретта предлагается использовать препараты, подавляющие секрецию соляной кислоты в желудке. Однако на сегодня нет достаточных доказательств того, что применение антисекреторных препаратов и антирефлюксная операция предотвращают развитие аденокарциномы пищевода или приводят к обратному развитию кишечной метаплазии.
Тем не менее медикаментозная терапия рекомендуется во всех случаях эрозивной формы ГЭРБ и при пищеводе Барретта. Принципы лечения имеющегося эзофагита и метаплазии Барретта остаются такими же, как и при обычной ГЭРБ. Препаратами выбора являются ингибиторы протонной помпы в случае неэффективности медикаментозного лечения рассматривается вопрос о хирургическом вмешательстве.
Первичное выявление дисплазии пищевода низкой степени является показанием для назначения не менее 20 мг рабепразола в сутки с последующим контрольным обследованием через 3 мес для оценки адекватного контроля над клиническими симптомами и состоянием слизистой оболочки пищевода. При сохранении дисплазии низкой степени продолжают постоянный прием 20 мг рабепразола в сутки и проводят гистологическое исследование ежегодно. При дисплазии высокой степени рекомендуется назначение не менее 20-40 мг рабепразола в сутки с оценкой результатов гистологического исследования и последующим решением вопроса об эндоскопическом или хирургическом лечении пищевода Барретта.
При необходимости длительной антисекреторной терапии пищевода Барретта целесообразно обследование пациентов на наличие инфекции H. рylori, в случае обнаружения которой рекомендуется проведение эрадикационной терапии для предупреждения прогрессирования атрофического хеликобактерного гастрита.
Активная тактика ведения пациентов с дисплазией пищевода высокой степени не однозначна. Одни авторы рекомендуют радикальное хирургическое лечение – резекцию или экстирпацию пищевода, чтобы до минимума снизить риск возникновения аденокарциномы или удалить еще не найденный, но уже существующий рак на ранней стадии. В пользу такой агрессивной тактики лечения свидетельствуют данные о том, что у значительного числа больных, оперированных по поводу дисплазии пищевода высокой степени, при гистологическом исследовании удаленного участка определяется аденокарцинома. Кроме того, злокачественная трансформация дисплазии высокой степени в аденокарциному может произойти внезапно, и этот момент может быть пропущен при динамическом наблюдении.
По мнению других исследователей, такой подход к лечению больных без очевидных доказательств малигнизации процесса не оправдан. Обширное оперативное вмешательство травматично для пациента, связано с высоким риском осложнений и риском летального исхода. Тем более, что пациенты с пищеводом Барретта, как правило, пожилого возраста и имеют серьезные сопутствующие заболевания. С другой стороны, предвидеть прогрессию дисплазии высокой степени до аденокарциномы не представляется возможным. Не существует предикторов, которые могли бы указать на скорость прогрессирования процесса. Гистологические изменения пищевода очень вариабельны и индивидуальны для каждого пациента.
Компромиссным решением вопроса лечения пациентов с дисплазией высокой степени может быть применение малоинвазивных эндоскопических вмешательств, характеризующихся ограниченной глубиной повреждения слизистой оболочки пищевода (мультиполярная электрокоагуляция, коагуляция аргоновой плазмой, лазерная деструкция) или полное удаление метаплазированного участка слизистой оболочки в сочетании с интенсивной медикаментозной терапией. Для этой категории больных такое комбинированное лечение, вероятно, является методом выбора.
Патология желудка
Наибольшие успехи достигнуты в изучении предопухолевой патологии желудка.
В последние годы в некоторых странах отмечено снижение частоты и распространенности рака дистального отдела желудка. В Японии, где на долю рака желудка приходится 50% всех опухолей, последний подъем заболеваемости отмечен в 1968 г.
На сегодня лучшей моделью патогенеза рака желудка является так называемая модель профессора Correa, которая удачно подходит к последовательности событий, развивающихся при раке кишечного типа, но не объясняет возникновение рака диффузного типа. Модель Correa показывает цепь последовательных этапов развития карциномы желудка, возникающей на фоне хронического гастрита. По мнению Correa, патогенез хронического гастрита и рака желудка – это мультифакторный процесс, для которого важны и факторы внешней среды, и генетические особенности организма.
В настоящее время существуют надежные эпидемиологические доказательства тесной связи между инфицированием H. pylori и развитием рака желудка. У больных, инфицированных H. рylori, рак желудка встречается в 4-6 раз чаще, чем у неинфицированных. Расчеты показывают, что риск развития рака желудка у H. pylori-позитивных лиц в 8 раз выше, чем у неинфицированных.
Инфицирование слизистой оболочки желудка H. рylori запускает цепь последовательных событий, которые способствуют возникновению хронического воспаления в ней, а при длительной персистенции приводят к атрофии и кишечной метаплазии, а затем к дисплазии и раку кишечного типа. Какие изменения в слизистой оболочке желудка считать предраковыми? В 1978 г. координационным комитетом ВОЗ эти изменения были обозначены термином «дисплазия». В соответствии с новой международной классификацией, принятой в Вене в 2000 г., они определяются как «неоплазия» – клон клеток, отличающихся от других тканей автономным ростом и соматическими мутациями. При неоплазии низкой степени риск развития рака желудка в течение 5 лет составляет 10%, а при неоплазии высокой степени – 96%, уже через 3 мес такая неоплазия может перейти в ранний рак.
Что такое ранний рак желудка? Это понятие в 1962 г. ввело японское общество эндоскопистов, согласно которому ранний рак желудка – карцинома, инвазия которой ограничивается слизистой или подслизистой оболочкой. Успехи японских специалистов заключаются в том, что они на несколько лет раньше диагностируют эти изменения и совершенно по-иному оперируют.
Что определяет курабельность рака желудка? Опыт японских специалистов, имеющих наибольший опыт в этой области в мире, свидетельствует о том, что при определенных подходах рак желудка и ранний рак желудка являются абсолютно курабельными заболеваниями. На курабельность влияют глубина инвазии раннего рака и наличие микрометастазов. Эти два параметра и определяют выбор вмешательства.
Совершенно четко показано, что если инвазия ограничивается слизистой оболочкой, то 5-летняя выживаемость достигает 100%, т. е. больные живут более 5 лет. Если инвазия распространена в подслизистую область, то выживаемость хуже, но она тоже высока – 90%. В связи с этим наибольшую актуальность приобретает ранняя диагностика рака желудка.
До недавнего времени единственным методом диагностики атрофических и неопластических изменений в слизистой оболочке желудка было эндоскопическое исследование с биопсией. На сегодня стала возможна неинвазивная диагностика атрофии антрального отдела и тела желудка. Предложен метод иммуноферментного анализа при помощи тестовой панели, позволяющий по анализу крови судить о состоянии слизистой оболочки желудка. В основе такой диагностики лежит определение уровней пепсиногена-І, IІ, гастрина-17 и антител к H. pylori в сыворотке крови. Снижение концентрации гастрина-17 в сыворотке крови свидетельствует об уменьшении секреторных G-клеток, а следовательно, об атрофии антрального отдела желудка. Маркерами атрофических изменений в теле желудка являются пепсиноген-І и IІ.
Естественно, что определение сывороточных маркеров атрофии является методом скрининга. При выявлении снижения концентрации маркеров атрофии в сыворотке крови всем больным необходимо проведение верхней эндоскопии с последующей биопсией и гистологическим исследованием слизистой оболочки желудка для уточнения стадии атрофии и наличия метапластических изменений эпителия.
Больные с выявленными атрофическими и диспластическими изменениями в желудке должны находиться под динамическим наблюдением. Пациенты с морфологически подтвержденным атрофическим гастритом должны проходить эндоскопическое обследование не реже одного раза в 2-3 года. В случае выявления у таких больных дисплазии І-ІІ степени, показана гастроскопия 1 раз в год. При выявлении дисплазии ІІІ степени у больных с заболеваниями желудка необходимы повторные эндоскопические исследования с множественными биопсиями каждые 3 мес.
В последние годы интенсивно изучается влияние разнообразных факторов на замедление прогрессирования атрофического гастрита и снижение риска развития дисплазии и рака желудка. Существуют противоречивые данные о том, на какой стадии H. pylori-инфицированные предраковые изменения будут регрессировать или, по меньшей мере, останавливаться.
Несмотря на наличие огромного количества лекарственных препаратов в качестве средств медикаментозной профилактики рака желудка, обсуждаются антихеликобактерная терапия и применение нестероидных противовоспалительных препаратов (НПВП). Общие рекомендации по профилактике включают изменение образа жизни, отказ от курения, умеренное потребление соли и алкоголя, обогащение пищевого рациона свежими овощами.
Использование НПВП с целью предотвращения злокачественных новообразований ЖКТ не может быть официально рекомендовано в связи с небольшим накопленным опытом по данному вопросу. В последнее время стали появляться публикации о регрессии атрофии и кишечной метаплазии после применения НПВП. Однако эффективность различных препаратов этой группы, режимы дозирования и продолжительность терапии все еще недостаточно изучены.
Более перспективной в профилактике рака желудка представляется антихеликобактерная терапия. По данным ряда авторов, успешная антихеликобактерная терапия позволяет уменьшить активность воспаления в слизистой оболочке желудка (снизить степень пролиферации и апоптоза), а следовательно, и риск развития рака желудка. Согласно официальным рекомендациям по лечению хеликобактерной инфекции (Маастрихт-3) атрофический гастрит, ассоциированный с H. рylori, является показанием для проведения эрадикационной терапии.
Эффективная эрадикация H. pylori, проведенная пациентам после эндоскопической резекции неинвазивной аденокарциномы, снижает риск рецидива опухоли и увеличивает продолжительность жизни больных.
В настоящее время опубликовано большое количество работ и продолжает проводиться много научных исследований по вопросу регрессии и замедления прогрессирования атрофических и диспластических изменений в слизистой оболочке желудка в ответ на уничтожение H. рylori. Большинство работ свидетельствует о положительном влиянии такой терапии на слизистую оболочку желудка. Однако данных для окончательного вывода о том, может ли считаться антихеликобактерная терапия адекватным методом профилактики рака желудка, недостаточно. По-видимому, ответ на этот вопрос будет получен в недалеком будущем.
Патология кишечника
В Украине колоректальный рак занимает 2-е место по заболеваемости онкологической патологией среди мужчин, и 3-е – у женщин. Ежегодно в стране регистрируется 15 тыс. новых случаев рака толстой кишки. Распространенность данной патологии составляет 36 случаев на 100 тыс. населения.
Рак толстого кишечника обычно делят на наследственный (семейный) и приобретенный (спорадический). При семейном типе колоректального рака, на долю которого приходится примерно 15% случаев, больной является носителем аномального гена, а факторы окружающей среды могут вызывать лишь дополнительные генетические изменения. Возникновение спорадического рака (около 85% случаев) обусловлено факторами внешней среды и чаще всего связано с фоновой патологией кишечника.
Генетическими факторами высокого риска рака толстой кишки являются наследственный аденоматозный полипоз, семейные наследственные синдромы (Пейтца-Егерса, Гарднера, Тюрко и др.), наличие колоректального рака у родственников первой линии. Эта группа пациентов должна наблюдаться с детского возраста, в случае необходимости им показана ранняя колэктомия, что способствует увеличению продолжительности жизни этой категории больных.
Спорадические случаи колоректального рака возникают на фоне хронических заболеваний толстого кишечника. Спектр предраковой патологии толстой кишки включает такие фоновые заболевания, как аденоматозные полипы и воспалительные заболевания кишечника.
Риск развития рака толстого кишечника у больных с аденоматозными полипами повышен в 3-5 раз по сравнению с общей популяцией. Предикторами возникновения аденокарциномы толстой кишки являются размеры полипов более 2 см, отсутствие ножки, ворсинчатые (но не тубулярные) аденомы. С целью профилактики колоректального рака в отношении аденоматозных полипов должна применяться активная тактика лечения, т. е. все обнаруженные полипы толстой кишки подлежат немедленному удалению. Исключением являются небольшие, не более 0,5 см, одиночные полипозные образования, за ростом которых наблюдают с помощью колоноскопии.
Люди, страдающие воспалительными заболеваниями кишечника, язвенным колитом и, в меньшей степени, болезнью Крона, также имеют большую вероятность заболеть раком кишечника.
Относительный кумулятивный риск возникновения колоректального рака при язвенном колите находится в интервале 3,1-5,7. Дисплазия слизистой оболочки толстой кишки при болезни Крона встречается значительно реже, чем при язвенном колите. Риск рака ободочной кишки при болезни Крона составляет 2,64, при этом наиболее важными факторами риска являются протяженность поражения слизистой оболочки кишки и длительность заболевания. По данным исследования, проведенного в округе Олмстед (Olmsted), штат Миннесота (США), были получены следующие данные. При язвенном колите 4 из 6 случаев колоректального рака возникли на фоне распространенного воспалительного процесса. Риск рака толстой кишки у больных с болезнью Крона был особенно выраженным у мужчин, заболевших до 29 лет. Полученные результаты не показали повышенного риска колоректального рака у больных с дистальным язвенным колитом легкого течения. Риск аденокарциномы толстой кишки был несколько повышен при обширном распространении язвенного колита, а также у пациентов с болезнью Крона. Риск рака тонкого кишечника оказался повышенным более чем в 40 раз у пациентов с болезнью Крона по сравнению с общей популяцией, что согласуется с выводами других популяционных исследований.
У пациентов с язвенным колитом отмечаются разнообразные колоноскопические проявления: воспалительные полипы, стриктуры, укорочение кишки, участки выраженного воспаления. Выявленные при колоноскопии указанные изменения могут служить маркерами риска развития рака неоплазий. Макроскопическое выявление особенностей предшествующего и продолжающегося воспаления отражают увеличенный риск колоректального рака. При нормальных макроскопических данных в процессе колоноскопии риск заболевания раком не отличается от общей популяции.
Выживаемость пациентов с колоректальным раком напрямую зависит от стадии заболевания, поэтому крайне важна как можно более ранняя диагностика аденокарциномы кишки и адекватное лечение предопухолевой патологии кишечника. Активное наблюдение за пациентами, принадлежащими к группам умеренного и высокого риска, способствует профилактике рака толстой кишки.
В Украине не разработаны и не приняты программы скрининга колоректального рака и наблюдения за пациентами с повышенными факторами риска. Методы скрининга, а также оптимальные группы лиц, требующие активного наблюдения, еще обсуждаются. Однако мировой опыт свидетельствует, что скринингу для раннего выявления колоректального рака должны подвергаться все лица старше 50 лет в общей популяции. Наиболее информативными методами скрининга считаются анализ кала на скрытую кровь и гибкая сигмоскопия.
На страницах научных изданий широко обсуждаются вопросы хемопрофилактики колоректального рака. Диета с высоким содержанием пищевых волокон снижает риск развития рака толстого кишечника. Диетические волокна обеспечивают профилактику рака толстого кишечника путем нормализации консистенции кишечного содержимого, абсорбирования волокнами потенциальных канцерогенов, увеличения веса каловых масс (снижения времени транзита пищи через ЖКТ), изменения бактериальных характеристик кишечного содержимого и изменения метаболизма желчных кислот. По результатам других исследований, уменьшение содержания в диете жира и увеличение пищевых волокон не влияет на риск рецидивирования колоректальных аденом. Это же относится к витаминам и микроэлементам. Исследования на животных свидетельствуют, что магниевая диета может сыграть роль в предупреждении колоректального рака, но данные по применению препаратов у людей недостаточны. Работа, представленная Шведским маммографическим обществом, основанная на обобщении данных, полученных при обследовании 61 443 женщин без изначально установленного диагноза рака в возрасте от 40 до 75 лет за период 1987-1990 гг., свидетельствует, что высокое потребление магния может снижать риск развития колоректального рака у женщин. По данным недавно проведенного экспериментального исследования на животных, недостаточное содержание в рационе фолиевой кислоты может привести к увеличению риска развития рака кишечника. Анализ результатов рандомизированных клинических исследований показал, что употребление селена снижает риск колоректальной неоплазии, но устойчивой связи в этих исследованиях не было доказано.
Существуют данные о том, что регулярное употребление НПВП снижает риск возникновения колоректальных полипов. Однако для того чтобы получить окончательный ответ на этот вопрос, необходимы хорошо спланированные популяционные исследования.
Гепатоцеллюлярная карцинома – первичная опухоль печени, происходящая из клеток паренхимы печени и преимущественно обусловленная вирусной инфекцией. В США и Западной Европе, где программы вакцинации против гепатита В принесли реальную отдачу, инфекция вирусом гепатита С (HCV) выходит на 1-е место среди причин цирроза печени и гепатоцеллюлярной карциномы. Мягкое бессимптомное течение острого вирусного гепатита С приводит к поздней диагностике. У большинства больных (7585%) заболевание переходит в хроническую форму и нередко впервые диагностируется у пациентов со сформировавшимся циррозом печени.
Вторым, не менее важным фактором развития рака печени является хронический вирусный гепатит В. Риск возникновения печеночноклеточного рака у носителей вируса возрастает в 200 раз, причем у мужчин-носителей он выше, чем у женщин.
В Украине, по данным ВОЗ, вирусом гепатита В (HBV) инфицировано от 2 до 7% населения. Около 500 тыс. человек в мире ежегодно погибает от HBV-инфекции: 52 тыс. – от острого гепатита В, 470 тыс. – от гепатоцеллюлярной карциномы и цирроза.
Процесс формирования гепатоцеллюлярной карциномы у больных, инфицированных вирусом гепатита В, в среднем составляет 50 лет. Для HCV-инфекции это еще более длительный период. Однако существуют факторы, способствующие раннему развитию гепатоцеллюлярной карциномы. Прежде всего, это злоупотребление алкоголем, особенно в сочетании с вирусной инфекцией.
Развитию рака печени может способствовать избыточное содержание в организме железа, паразитарные болезни (описторхоз, шистосомоз и др.). Канцерогенное воздействие на печень могут оказывать промышленные продукты – полихлорированные дифенилы, хлорированные углеводородные растворители (например, нитрозамины), органические хлорсодержащие пестициды, а также афлатоксины, которые способны индуцировать мутацию гена р53.
Единственным методом, способным предотвратить прогрессию гепатита в цирроз печени и снизить риск развития гепатоцеллюлярной карциномы, является адекватное лечение HBV- и HСV-инфекций.
В результате данных, полученных при метаанализе исследований, посвященных интерферонотерапии при хронических вирусных гепатитах, можно сделать вывод о том, что устойчивый вирусологический ответ снижает риск развития гепатоцеллюлярной карциномы.
Читайте также
www.health-ua.org
Пищевод Барретта > Клинические рекомендации РФ (Россия) > MedElement
Патогенез
Злокачественная трансформация эпителия пищевода проходит через ряд последовательных этапов, включающих рефлюкс-эзофагит, цилиндроклеточную кишечную метаплазию эпителия, дисплазию низкой и высокой степени[24].
Причины и факторы, запускающие развитие метаплазии и дисплазии эпителия пищевода до сих пор в достаточной мере не изучены.
В 1970 г. С.Bremner и соавт доказали на животных моделях, что в поврежденной слизистой оболочке пищевода замещение многослойного плоского неороговевающего эпителия на цилиндрический происходит при наличии рефлюкса кислоты. По данным суточного внутрипищеводного мониторирования рН при ПБ определяются более продолжительные рефлюксы кислоты, чем у пациентов с неосложненной ГЭРБ. Суточное внутрипищеводное мониторирование рН и билирубина выявили, что у 80-90% пациентов с ПБ преобладает смешанный кислотно-билиарный рефлюкс.
Смешанный рефлюкс вызывает более значительное повреждение клеточных мембран и межклеточных контактов вследствие синергизма воздействия соляной кислоты желудочного сока и конъюгатов желчных кислот. Конъюгированные липофильные желчные кислоты (дезоксихолевая и тауродезоксихолевая) повышают внеклеточную проницаемость, проницаемость апикальных клеточных мембран, способствуя диффузии водородных ионов внутрь ткани, что, в итоге, оказывает основное повреждающее действие.
Повреждение клеток поверхностного слоя плоского эпителия стимулирует его регенерацию и ведет к компенсаторному утолщению эпителиального пласта под влиянием, в частности, эпидермального фактора роста [24,79]. Трофические эффекты эпидермального фактора роста приводят к увеличению ширины базальной пролиферативной зоны эпителиального пласта и удлинению сосочков собственной пластинки слизистой оболочки [24,80]. При этом, стволовые эпителиальные клетки базального слоя на высоте сосочков приближаются к поверхности эпителиального пласта, где еще больше подвергаются воздействию кислоты.
Стволовые клетки, расположенные на базальной мембране эпителия, являясь частично комиттированными, под воздействием кислоты и компонентов желчи могут дифференцироваться не в плоский, а в более устойчивый к воздействию кислоты цилиндрический эпителий. Промежуточной стадией, вероятно, является формирование полиморфного эпителия, имеющего ультраструктурные и цитохимические черты как плоского, так и цилиндрического эпителия. В работах с применением антител к цитокератинам были выявлены участки такого эпителия при ПБ [81]. Сегмент ПБ у одного и того же пациента, как правило, включает несколько типов эпителия (желудочный кардиальный, желудочный фундальный, кишечный, плоский эпителий), расположенных мозаично. Помимо бокаловидных клеток в эпителии ПБ встречаются высокие цилиндрические клетки, имеющие сходство с клетками, выстилающими желудочные ямки. Эти клетки получили название «промежуточных или переходных клеток». Часть из них содержит нейтральные муцины желудочного типа, а часть кислые муцины, не характерные для желудочного эпителия. На ультраструктурном уровне часть клеток схожи с клетками желудка, а часть имеет черты, как муцин-продуцирующих клеток желудка, так и кишечных абсорбирующих клеток [82].
Основным, доступным практическому врачу, маркером злокачественной трансформации эпителия ПБ остается дисплазия эпителия. Риск развития аденокарциномы у больных с дисплазией низкой степени оценивается менее чем 1% в год, а при наличии дисплазии высокой степени он значительно выше и составляет уже около 12% в год, причем, достаточно часто, дисплазия высокой степени (тяжелая) в трети случаев ассоциирована с уже существующей аденокарциномой[24].
diseases.medelement.com
что это такое? Лечение и симптомы дисплазии, как лечить дисплазию, степени и виды дисплазии
Дисплазия – это нарушение строения тканей организма, с упрощением их структуры, деформацией клеток и их составных частей. Обусловленные генетическими причинами врожденные дисплазии, как правило, имеют многообразные проявления, часто множественные и в разных системах.
Дисплазии слизистых оболочек имеют локальную привязку к определённому органу, как-то желудок, кишечник, шейка матки. В отличии от всех прочих дисплазий этот вид патологии не наследуется и не связан с глобальным генетическим сбоем, а вызывается жизнедеятельностью патологической микрофлоры.
Виды дисплазии
Дисплазии очень разнообразны и разнородны, врожденные и благоприобретенные дисплазии по сути очень разные процессы, одни захватывают несколько систем, другие – только участки слизистой оболочки.
Врожденные дисплазии проявляются аномалиями развития – отклонениям в строении, не мешающими нормальному функционированию, и пороками развития – эти аномалии уже нарушают функционирование анатомической области.
Дисплазии слизистой не формируют пороков и аномалий развития, но способны привести к злокачественным процессам. Абсолютно разные проявления дисплазий не позволяют создать единую классификацию, каждый исследователь проблемы предлагает собственную систематизацию разнородной патологии, не свободную от недостатков.
Врожденные дисплазии формируются во внутриутробном периоде, клинические проявления затрагивают покровные ткани и костно-мышечную систему, разделение их весьма условно.
Выделяют дисплазию эктодермы – поверхностной ткани зародыша, из которой формируются наружные покровы: кожа с ногтями и волосами и слизистая ротовой полости с зубами. Патология может проявиться в любом возрасте, в любом наборе признаков и с любой их выраженностью. Это может быть только сухость кожи с небольшими пятнышками атрофии и почти полным отсутствием зубов или гнездная плешивость с без ногтей и с лунообразными дефектами зубной эмали при полном наборе зубов. Возможно и просто снижение числа потовых желез в коже, что приводит к быстрому перегреванию уже в младенчестве и опасности внезапной смерти.
У подавляющего большинства страдающих генетической дисплазией соединительной ткани возможны нарушения всех систем организма от незначительных до опасных для жизни и с любым набором признаков: неврологические нарушения, пороки сердечных клапанов, изменения скелета, аневризмы сосудов, размягчение колец трахеи, опущение почек, а также приводящие к внезапной смерти сочетанное поражение сердечно-сосудистой и дыхательной систем. Наиболее активный всплеск проявлений отмечается в подростковом возрасте, когда, например, резко прогрессирует сколиоз и плоскостопие, появляется сердечная аритмия и близорукость. Сформировано несколько синдромов с характерными внешними проявлениями, опять-таки с вариабельной выраженностью – от мизерных отдельных проявлений до чрезвычайно выраженных с ранней гибелью от осложнений, как синдром Марфана и несовершенный остеогенез.
Дисплазия суставов проявляется врожденными пороками развития крупных – тазобедренных и коленных, а также мелких суставов кисти и стопы, и по своей сути может считаться все той же дисплазией соединительной ткани, но в отдельно взятой суставной системе. Как правило, патология выявляется у грудничка, но в минимальной форме может проходить незаметно, констатируют которую при обследовании по поводу случайной травмы ноги.
Дисплазию фиброзную выдают одиночные и множественные кисты в костях. Некоторые люди до глубокой старости проживают здоровую жизнь и узнают о генетической патологии в виде небольшой кисточки случайно при рентгене по другому поводу. Другие страдают хроническими болями и деформацией конечности, часто с укорочением, из-за множества кистозных полостей в костной ткани.
Дисплазию слизистых оболочек внутренних органов «зарабатывают» в процессе жизни. В большинстве случаев процесс не проявляется симптомами или имеет нехарактерные и нестабильные минимальные признаки, находят его при микроскопии кусочка ткани. Дисплазия может прогрессировать от легкой степени, через среднюю и тяжелую вплоть до рака нулевой стадии – и в этом её главная опасность. Тяжелую степень дисплазии сложно, а иногда и невозможно достоверно отличить от неинвазивного рака in situ.
Дисплазия желудка клинически может проявляться желудочной патологией, нередко у пациента отмечается инфицирование хеликобактерией. Патология заключается в упрощении клеточного строения – снижении дифференцировки, изменении клеточных ядер и других внутриклеточных структур. Легкая дисплазия не только переходит в среднюю, но и регрессирует, аналогично протекает и средняя, а тяжелая считается предраковым процессом и подлежит серьёзному лечению и наблюдению. Желудочная дисплазия по частоте встречаемости существенно уступает метаплазии – формированию в слизистой участков из клеток очень похожих на клетки толстой или тонкой кишки. При микроскопии вокруг любой дисплазии обязательно находят участки кишечной метаплазии и это тоже предраковый процесс.
Первичная дисплазия уротелия – нечасто встречающаяся патология, проявляющаяся симптоматикой раздраженного мочевого пузыря с частыми и болезненными позывами на мочеиспускание. Этот вариант дисплазии не принято разделять на степени, вероятность развития рака на диспластичном фоне чуть больше 15% и переход в нулевую стадию рака займет от 4 до 8 лет.
Цервикальная или дисплазия слизистой шейки матки очень частая патология, поскольку её ведущая причина – инфицированность вирусом папилломы человека. Сам вирус убить невозможно – он устойчив к любым лекарствам, но он смертен и у подавляющего большинства женщин самостоятельно излечивается в ближайшие два-три года.
Степени дисплазии
На трёх женщин с легкой дисплазией шеечной слизистой приходится одна пациентка со средней и тяжелой дисплазией. У девяти из десяти женщин место патологического изменения слизистой расположено у перехода плоского эпителия в железистый, который в норме находится у начала цервикального канала, но вследствие родов и абортов может перемещаться вглубь канала ближе к полости матки.
Дисплазия характеризуется появлением неправильных клеток – атипичных, но межклеточные структуры совсем не страдают. Клетки изменяют свою форму, ядра в них тоже меняют размер, форму и цвет. Ядра более крупные, неровные с толстой наружной оболочкой, внутриклеточная жидкость светлеет и увеличивается в объёме. Вместо абсолютно одинаковых клеточек эпителия появляется полная клеточная пересортица, усиленно делящаяся на такие же дефектные экземпляры. Вероятность развития рака в этой группе разноразмерных клеток доходит до 50%, правда, на это потребуются многие годы.
Степени дисплазии или по современной классификации, подчеркивающий возможность прогрессии до злокачественного процесса, цервикальной интраэпителиальной неоплазии или CIN градуируются следующим образом:
- Легкая цервикальная дисплазия или CIN I – патология располагается в одной трети пласта эпителия. Исследования показали, что у двух третей женщин в течение трёх лет с момента заражения вирусом папилломы человека 16 и 18 типов (ВПЧ) процесс самопроизвольно разрешится вследствие естественной гибели пораженной вирусом клетки, которую вирус не успеет покинуть и слущится вместе со своим клеточным «домиком». У трёх из десяти зараженных женщин ВПЧ продолжит жить дальше, а у одной перейдёт в среднюю степень дисплазии, тем не менее легкая дисплазия не считается предраком.
- Средняя степень цервикальной дисплазии или CIN II – поражение охватывает больше половины толщины эпителия – до двух третей. У трёх из сотни с течением времени такая дисплазия прогрессирует в тяжелую.
- При тяжелой степени цервикальной дисплазии или CIN III свободным от атипических клеток остается только поверхность эпителия, визуально даже в электронном микроскопе это патологическое состояние очень похоже на рак in situ. Предполагается, что у каждой седьмой женщины с диагностированной CIN III уже есть злокачественные клетки, тем не менее, у каждой третьей пациентки тяжелая дисплазия может уйти в среднюю и легкую степень и даже исчезнуть. Проблема в одном – нельзя сказать у кого в будущем будет рак шейки матки, а кто им не заболеет.
Риск рака реален у женщины с длительной цервикальной неоплазией, поэтому оперируют даже легкую дисплазию, не исчезнувшую после 36 месяцев наблюдения. Кстати, инфицирование ВПЧ не обещает обязательной дисплазии, у каждой четвертой зараженной женщины вирус не внедряется внутрь клеток – «проносится» мимо к выходу из половых путей.
Диагностика заболевания
Дисплазия слизистой не болит, не мешает жить – у неё нет симптомов.
Самый простой способ выявления патологии слизистой шейки матки был придуман Папаниколау в 1940-х годах и состоял он из взятия соскоба поверхностных клеток. Сегодня применяется модифицированный инструментарий, позволяющий собрать больше материала. Исследование клеток под микроскопом – цитология позволяет определиться во следующим диагностическим этапом – кольпоскопией.
Расширенная кольпоскопия – осмотр тканей под большим увеличением от пятикратного до 30-кратного, с дополнительным усилением «картинки» специальными обработками растворами, что помогает выбору оптимального места для взятия кусочка ткани – биопсии участка дисплазии. Кусочки слизистой размером не менее 3 миллиметров отправляются на микроскопию – гистологию. Биопсия исключается при воспалении и инфекциях, но только на время.
Дальше при морфологическом подтверждении дисплазии проводится выскабливание слизистой оболочки цервикального канала для выявления его изменений, у женщины дисплазия может локализоваться в железистых криптах – ямках слизистой и зона эпителиального перехода способна смещаться выше. Выскабливание визуализирует скрытый от глаза патологический субстрат.
Лечение дисплазии
При врожденных дисплазиях радикального лечение не существует, при некоторых опасных для жизни пороках развития проводятся операции, но вся терапия направлена только на уменьшение симптомов с увеличением двигательной активности и паллиативная по своей сути.
При дисплазии суставов разработаны эффективные, но тягостные методики многомесячной фиксации для создания покоя и предоставления времени для не случившегося во внутриутробном периоде развития.
При дисплазии желудка проводится избавление от хеликобактерии, налаживается ритм питания, модифицируется диета и образ жизни в сторону нормального, используются защищающие слизистую от повреждений лекарственные средства.
Лечение дисплазии шейки матки зависит от её выраженности: при легкой степени дисплазии прибегают к консервативным мероприятиям. Вирус папилломы человека устойчив к лекарственному воздействию, но его жизнедеятельность поддерживают нарушения слизистой оболочки при хроническом воспалении, способствует снижение иммунитета при гормональных нарушениях и системных заболеваниях.
Здоровой женщине проще избавится от ВПЧ, но при наличии у неё болезней необходимо помочь организму – излечить острое воспаление, перевести хронический процесс в длительную ремиссию, добиться гормонального баланса, нормализовать сахар и другие элементы крови.
При длительно существующей CIN I, которую наблюдают почти 3 года без тенденции ткани к нормализации структуры, тоже оперируют – удаляют сектор шейки. Сектор похож на геометрическую фигуру – конус, отсюда и название операции – конизация.
Среднюю и тяжелую дисплазию лечат только хирургией – проводится конизация шейки матки радиоволновым или лазерным методами. Операция высокоэффективна, почти не оставляет рубцов и не мешает в дальнейшем забеременеть и выносить ребенка.
Восстановительный период
Биопсия шейки матки для диагностики дисплазии при правильном выполнении не чревата проблемами, но некоторым пациенткам с хроническими воспалительными процессами половой сферы требуется профилактическое применение антибиотиков. Не допускается использование в послеоперационном периоде вагинальных тампонов и промывания влагалища, на 2 недели также исключается половая жизнь.
После конизации по поводу дисплазии несколько дней беспокоят не столько боли, сколь неприятные ощущения внизу живота. Будут и выделения, в первые дни могут быть прожилки крови или окрашивание кровью. С течением времени выделения осветляются и уменьшается их количество. Длительность истечения зависит от скорости заживления. Возможно усиление менструации. На полное восстановление слоя слизистой потребуется несколько недель, период ограничений увеличивается, как минимум до месяца, то есть на это время полностью исключается секс, тампоны, спринцевания и высокие физические нагрузки.
Восстановление обязательно должен контролировать врач. Результат лечения оценивает контрольная кольпоскопия и соскоб слизистой – не должно быть признаков атипии и участков дисплазии.
Предраковые процессы и дисплазии умеют лечить обычные гинекологи, но наблюдение специалиста с онкологической подготовкой, тем более в специализированной онкологической клинике поднимает диагностику и терапию на должный уровень качества.
Запись на консультацию круглосуточно
Список литературы
- Каприн А.Д., Новикова Е.Г., Трушина О.И., Грецова О.П. /Скрининг рака шейки матки – нерешенные проблемы // Исследования и практика в медицине; 2015, т. 2, N 1.
- Короленкова Л.И. /Цервикальные траэпителиальные неоплазии и ранние формы рака шейки матки: клинико-морфологическая концепция цервикального канцерогенеза// М., 2017.
- Короленкова Л.И., Ермилова В.Д./ Зона трансформации шейки матки как объект канцерогенного действия вирусов папилломы человека при возникновении CIN и инвазивного рака – отражение в клинике// Архив патологии; 2011, Т. 73, N 6.
- Кудинова Е.Г., Момот А. П. /Наследственные нарушения соединительной ткани и семейный рак: есть ли взаимосвязь?// Архив внутренней медицины; 2015; 4(24).
- Митрофанов А. И., Борзунов Д. Ю. /Результаты лечения пациентов с активными солитарными костными кистами с применением чрескостного остеосинтеза //Гений ортопедии; 2010, № 2.
- Яковлев В.М., Нечаева Г.И., Мартынов А.И., Викторова И.А. /Дисплазия соединительной ткани в практике врачей первичного звена здравоохранения: Руководство для врачей//М.: КСТ Интерфорум; 2016.
- Darragh T.M., Colgan T.J., Cox J.T., et al. /The Lower Anogenital Squamous Terminology Standardization Project for HPV-Associated Lesions: background and consensus recommendations from the College of American Pathologists and the American Society for Colposcopy and Cervical Pathology // Arch. Pathol. Lab. Med.; 2012 Oct. Vol. 136, N 10.
- Saslow D., Solomon D., Lawson H.W., et al. /American Cancer Society, American Society for Colposcopy and Cervical Pathology, and American Society for Clinical Pathology screening guidelines for the prevention and early detection of cervical cancer // Am. J. Clin. Pathol.; Vol. 137.
Запись на консультацию круглосуточно
www.euroonco.ru

